白首乌C-21甾体苷体外抑制大鼠胶质瘤细胞生长的作用
2011-05-31王一奇张如松魏尔清
王一奇,杨 波,张如松,魏尔清
(1.浙江中医药大学药学院,浙江 杭州 310053;2.浙江大学医学院药理学系,浙江 杭州 310058)
白首乌系萝藦科鹅绒藤属植物耳叶牛皮消(Cynanchum auriculatum Royle ex Wight)的干燥块根,是传统的补益中药。现代研究表明,C-21甾体苷是白首乌的主要活性成分,它可以有效清除羟自由基和氧自由基,调节免疫,保护肝脏和神经细胞[1-2]。研究表明,C-21甾体总苷(CG)有确切的体内外抗肿瘤作用[3-4]。按CG极性大小做进一步分离,得到A、B、C三个部分,即CGA、CGB、CGC。其中CGB具有显著的抗肿瘤活性,且毒性较小,目前已经从中分离鉴定了四个C-21甾体苷类化合物,其化学结构如图1所示[5-6]。研究表明,CGB及其所包含的化合物对人乳腺癌(MCF-7)、人肝癌(BEL-7402)等体外培养的细胞株,以及小鼠移植性肿瘤 H22、S180的生长都有确切的抑制作用[7-9],但是对神经肿瘤的抑制作用至今尚无报道。神经胶质瘤是颅内常见的恶性肿瘤,而且多数为高度恶性的星形细胞瘤,治疗十分困难。本实验在前期研究的基础上,首次评价了CGB对体外培养的神经胶质瘤细胞生长的抑制作用,并且初步评价了其诱导细胞凋亡与阻滞细胞周期的作用。
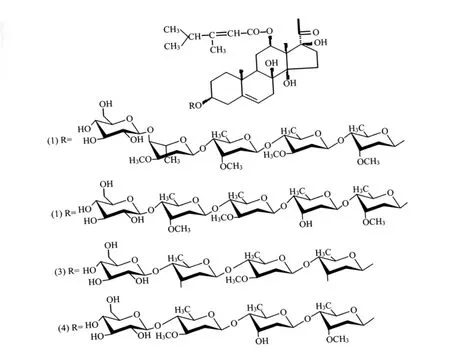
图1 CGB中四个C-21甾体苷类化合物的结构图Fig.1 Chemical structure of four C-21 Steroidal Glycosides in CGB
1 材料与方法
1.1 材料
1.1.1 细胞系 大鼠胶质瘤细胞(C6)由浙江大学医学院药理学系魏尔清教授提供。
1.1.2 药物及试剂 白首乌苷B部分(CGB)由本实验室从白首乌药材(经浙江中医药大学张如松教授鉴定为耳叶牛皮消Cynanchum auriculatum Royle ex wight的干燥块根)中提取分离纯化(提取分离工艺见方法1.2.1)。100目和200~300目硅胶购自青岛海洋化工厂;硅胶柱色谱用甲醇、氯仿为分析纯;DMEM培养基、胰蛋白酶购自Gibco公司;胎牛血清购自杭州四季青生物材料公司;MTT购自生工生物工程(上海)有限公司;Annexin V/PI凋亡检测试剂盒、PI细胞周期检测试剂盒购自联科生物技术有限公司。
1.1.3 仪器 Thermo Forma细胞培养箱(生命科学国际有限公司);CKX41倒置显微镜、BX51荧光倒置显微镜(日本OLYMPUS公司);680型全自动酶标仪(美国BIO-RAD公司);FACSCalibur型流式细胞仪(美国 Becton Dickson公司);AB104-N型电子天平(瑞士METTLER TOLEDO公司)。
1.2 方法
1.2.1 药物提取、分离 白首乌药材80 kg粉碎后,以甲醇提取,再经氯仿提取,氯仿可溶部分投入正己烷,得正己烷不溶部分,干燥,得到白首乌总苷(CG)约2.4 kg(3%)。CG先后用100~200目和200~300目硅胶经柱层析分离纯化,用氯仿-甲醇体系梯度洗脱,借助薄层层析分析,取薄层板上的中部斑点对应的流分,减压回收,所得的白首乌苷B部分(CGB)约65 g(0.08%)。CGB经K-K反应及L-B反应检识为C-21甾体类化合物。体外试验时CGB以二甲亚砜(DMSO)配制成12 g/L的贮存液,试验前用培养基稀释至相应浓度。
1.2.2 细胞培养及细胞活性检测 用DMEM培养基(含10%胎牛血清)培养细胞,每3 d更换新鲜培养液。待细胞铺满培养瓶底部时,用0.25%胰酶消化,收集细胞,以1×107/L的密度接种单细胞悬液于96孔培养板,每孔100 μl。设只加培养液、不加细胞和药物的空白调零孔和不加药、加细胞、溶剂及培养液的对照孔,均设四个复孔,预培养1 d后加入CGB,使药物终浓度为 30、60、120 mg·L-1,继续培养24 h、48 h或72 h后,每孔加入5 g/L MTT溶液20 μl,孵育 4 h,吸净孔内液体,每孔加入 DMSO 150 μl,震荡 10 min,使结晶物充分溶解,用酶标仪于490 nm处测各孔吸光度A值。给药72 h后,在加入MTT前,于光学倒置显微镜下观察细胞形态并拍照。
1.2.3 细胞凋亡及细胞周期检测 细胞以每瓶1×106个接种于50 ml培养瓶,预培养1 d后加入 CGB,使药物终浓度为 30、60、120 mg·L-1,继续培养24 h,收集细胞,按照试剂盒说明用Annexin V/PI染色后,流式细胞仪测细胞凋亡率;或收集细胞,用70% 冰乙醇-20℃固定24 h后,按照试剂盒说明用PI染色,流式细胞仪测细胞周期。
2 结果
2.1 CGB对C6细胞活性的影响 CGB 30、60、120 mg/L给药72 h后,细胞数量明显减少,部分细胞皱缩变圆(图2A);CGB 30、60、120 mg/L给药24、48、72 h后,C6细胞活性明显降低(P<0.001),且给药浓度越大、给药时间越长,下降幅度越大(图2B)。
2.2 CGB诱导C6细胞凋亡的作用 CGB 30 mg/L给药24 h后,细胞未发生明显凋亡和坏死;CGB 60、120 mg/L给药24 h后,细胞凋亡率和坏死率均明显升高(图3)。
2.3 CGB对C6细胞周期的影响 CGB 30、60、120 mg/L作用24 h后,G0/G1期细胞比例增加(P<0.05),S期细胞比例明显减少(P<0.01,图4)。
3 讨论
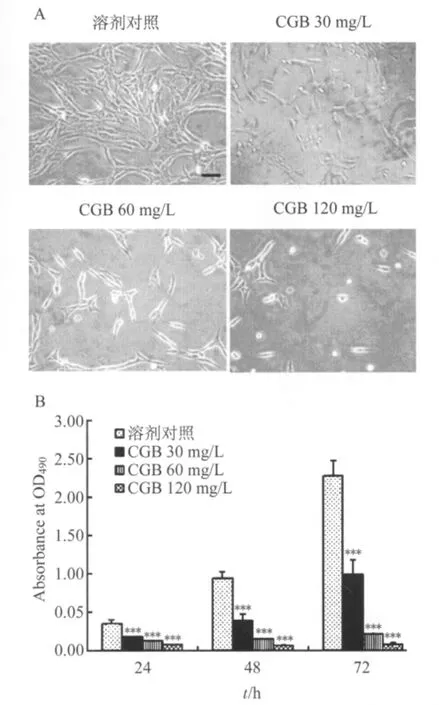
图2 CGB对C6细胞活性和形态的影响Fig.2 Effects ofCGB on cellviability and morphology in C6 cells
本实验结果表明,CGB 30、60、120 mg/L 对体外培养的大鼠胶质瘤细胞C6细胞的生长有显著的抑制作用;CGB 60、120 mg/L能诱导细胞凋亡,阻滞细胞周期,使G0/G1期细胞比例明显增加,S期细胞比例明显降低。虽然有关白首乌C-21甾体苷类成分对体外培养的肿瘤细胞的细胞毒作用已有多篇文献报道,但是对神经肿瘤的作用,本研究属首次报道。
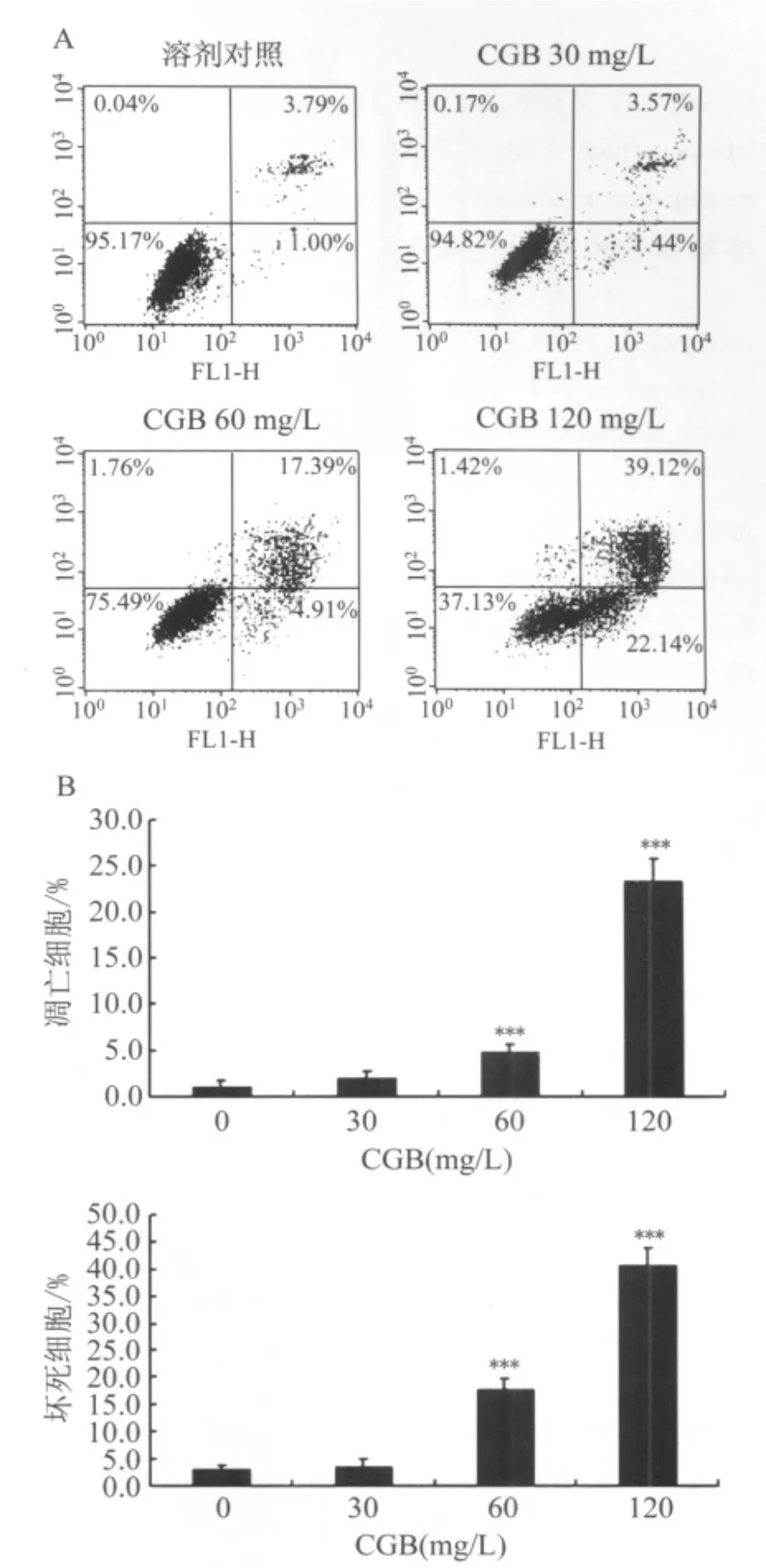
图3 CGB诱导C6细胞凋亡的作用Fig.3 Inducing effect of CGB on apoptosis of C6 cells
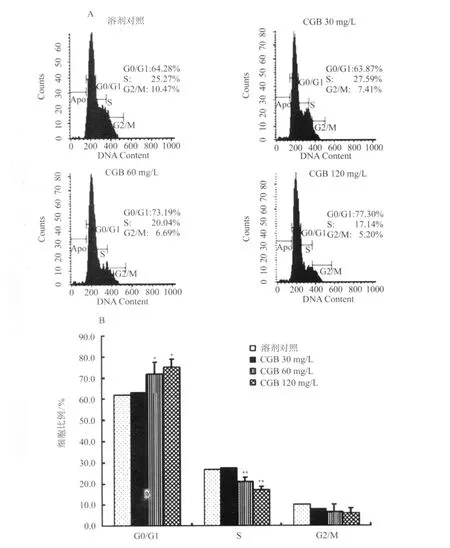
图4 CGB对C6细胞周期的影响Fig.4 Effect of CGB on cell cycle in C6 cells
本研究发现的CGB作用特点与文献报道一致。彭蕴茹、王冬艳等人曾在肝癌细胞中证实,白首乌C-21甾体苷类成分有诱导肿瘤细胞周期G0/G1期阻滞的作用、并诱导细胞凋亡,其诱导凋亡的剂量也与本实验结果基本一致[3-4]。但是,也有文献报道,CGB中所包含的两个C-21甾体苷类化合物诱导人乳腺癌细胞MCF-7凋亡的剂量较高,在80 mg/L作用72 h时才出现明显的凋亡率升高和典型的细胞核形态变化[8-9]。而本实验结果表明,CGB 60 mg/L作用24 h时细胞凋亡率就显著升高。分析原因有三方面:一是肿瘤细胞类型不一样,导致药物效应不一致;二是药物不完全一样;三是检测凋亡的方法不一样。文献中检测凋亡采用PI单一染料标记DNA,本实验采用Annexin V-PI双标记。前者检测凋亡的原理是凋亡细胞核内DNA会形成凋亡小体溢出,导致核内DNA含量减少。通过计数核内DNA减少的细胞数量就可以计算凋亡率。这种检测可能会导致一部分凋亡早期的细胞被遗漏。因为细胞核内DNA片断化往往出现在凋亡晚期。在凋亡早期时,细胞核内DNA断裂尚未发生,但细胞膜的改变已非常明显,即原先存在于细胞膜内表面的磷脂酰丝胺酸(PS)暴露于膜外表面。Annexin V在钙离子存在的环境中,可以迅速结合膜外表面的PS,灵敏地检测出早期凋亡细胞,因此,本实验采用的Annexin V-PI双标记检测凋亡更灵敏、准确[10-11]。
综上所述,本实验首次证明白首乌C-21甾体苷类成分对体外培养的神经胶质瘤细胞生长具有显著抑制作用,该作用与诱导细胞凋亡和阻滞细胞周期有关。这将为今后该类药物的开发提供线索和依据。目前对细胞凋亡的通路及细胞周期阻滞的分子机制已经比较明确,如Cyclin D、CDK4、CDK6对 G0/G1期起调控作用,Cyclin E、CDK2对G1晚期细胞进入S期起调控作用[12]。今后还需要深入研究白首乌C-21甾体苷类化合物对这些分子的作用机制。
[1]LEE M K,YEO H,KIM J,et al.Protection of rat hepatocytes exposed to CCl4in-vitro by cynandione A,a biacetophenone from Cynanchum wilfordii[J].Pharm Pharmacol,2000,52(3):341-345.
[2]LEE M K,YEO H,KIM J,et al.Cynandione A from Cynanchum wilfordii protects cultured cortical neuronsfrom toxicity induced by H2O2,L-glutamate,and kainate[J].Neurosci Res,2000,59(2):259-264.
[3]WANG Dong-Yan,ZHANG Hong-Quan,LI Xin(王冬艳,张洪泉,李 心).Apoptosis induced by the C21 sterols in Baishouwu and its mechanism of action in hepatoma[J].Acta Pharm Sin(药学学报),2007,42(4):366-370.(in Chinese)
[4]PENG Yun-Ru,LI You-Bin,LIU Xiao-Dong,et al(彭蕴茹,李友宾,刘晓东,等).Apoptosis Induced by Caudatin in Human Hepatoma CellLine SMMC7721 [J].Chinese Journal of Natural Medicines(中国天然药物),2008,6(3):210-213.(in English)
[5]ZHANG Ru-song,YE Yi-Ping,SHEN Yue-Mao,et al(张如松,叶益萍,沈月毛,等).Studies on the cytotoxic constituents of Cynanchum auriculatum Royle ex Wight[J].Acta Pharm Sin(药学学报),2000,35(6):431-437.(in Chinese)
[6]ZHANG R S,YE Y P,SHEN Y M,et al.Two new cytotoxic C21 steroidal glucosides from the root of Cynanchum auriculatum [J].Tetrahedron,2000,56(24):3875-3879.
[7]ZHANG Ru-song,YE Yi-Ping,LIU Yu-lan(张如松,叶益萍,刘玉兰).Studies on in vitro Antitumor Activity of Total Steroidal Glycoside from the Root of Cynanchum auriculatum [J].Chin Tradit Herbal Drugs(中草药),2000,31(8):599-601.(in Chinese)
[8]ZHANG R S,LIU Y L,WANG Y Q,et al.Cytotoxic and apoptosis-inducing properties of auriculoside A in tumor cells[J].Chem Biodivers,2007,4(5):887-92.
[9]WANG Yi-qi,LIU Yu-lan,ZHANG Ru-song(王一奇,刘玉兰,张如松).Study on antitumor activity of cynanauriculoside A and its effect of apoptosis induction in tumor cells[J].Chin Tradit Herbal Drugs(中草药),2009,40(6):6-9.(in Chinese)
[10]OVERBEEKE R, STEFFENS-NAKKEN H,VERMES I,et al.Early features of apoptosis detected by four different flow cytometry assays[J].Apoptosis,1998,3(2):115-121.
[11]VERMES I,HAANEN C,REUTELINGSPERGER C.Flow cytometry of apoptotic cell death [J].J Immunol Methods,2000,243(1-2):167-190.
[12]VERMEULEN K,VANBOCKSTAELEDR,BERNEMAN Z N.The cell cycle:a review of regulation,deregulation and therapeutic targets in cancer[J].Cell Prolif,2003,36(3):131-149.
