骨髓间充质干细胞-海藻酸钠凝胶治疗脊髓损伤的实验研究
2011-05-31史晨悦阮玲琴冯依慧方嘉霖宋晨骄袁张根丁悦敏
史晨悦,阮玲琴,冯依慧,方嘉霖,宋晨骄,袁张根,丁悦敏,2
(1.浙江大学城市学院医学与生命科学学院,浙江 杭州 310015;2.浙江大学医学院生理系,浙江 杭州 310058)
近年来随着我国高空作业事故、交通事故及地质灾害的频繁发生,脊髓损伤(spinal cord injury,SCI)患者逐年增多。SCI最终常可导致受损脊髓节段以下肢体运动和感觉能力的丧失,即发生瘫痪,给家庭和社会带来极大的负担。而长期以来SCI的治疗一直是个难题,近年来干细胞移植治疗给脊髓损伤后的功能修复带来了新希望,是最近SCI修复研究的热点之一[1]。骨髓间充质干细胞(mesenchymal stem cells,MSCs)是一种多功能干细胞,具有多潜能性,MSCs移植治疗研究已经涉及脊髓损伤、多发性硬化、帕金森病和阿尔茨海默病等多种神经系统疾病[2]。动物实验和临床研究均表明,MSCs移植治疗SCI后,MSCs可分化为神经样细胞或分泌神经营养物质,促进损伤脊髓修复和神经功能恢复[3]。可见MSCs移植是SCI修复治疗中的一种有效手段。但需要指出的是,在干细胞治疗的移植载体选择和植入方式等方面尚存在许多问题。
海藻酸钠(sodium alginate,SA)是褐藻中普遍存在的酸性多糖,在二价阳离子存在条件下可交联形成网状水凝胶。该凝胶具有很好的亲水性,营养物质易于渗透扩散,且其酶解产物对细胞无毒害作用,故在组织工程研究中日益受到重视[4]。近来已经有研究者研究了海藻酸钠对MSCs的生物学效应[5-6],将海藻酸钠作为细胞移植的载体用于脊髓损伤的治疗,并观察到运动功能的恢复[7]。但生物材料在使用前都需要进行灭菌处理,由于海藻酸钠受热不稳定[8],经过灭菌后其理化性质可能会发生改变,这种改变也可能会影响细胞的活性。海藻酸钠作为细胞移植载体,其制备方法的不同,对MSCs的生物学特性带来的影响及其在SCI治疗中的效果尚未见报道。
1 材料与方法
1.1 药品与试剂 海藻酸钠(SA)和四甲基偶氮唑蓝(MTT)购自美国sigma公司。胎牛血清,DMEM培养基,胰酶购自美国Gibco公司。神经丝NF-200抗体,FITC抗兔荧光二抗购自博士德生物工程公司。
1.2 海藻酸钠凝胶制备 分别以生理盐水和去离子水作为海藻酸钠的溶剂,比较海藻酸钠凝胶的溶解性。具体方法为:先称取海藻酸钠粉末,将粉末缓缓加入装有少量溶剂的离心管中,同时边加粉末边加剩余溶剂,最后用旋涡混合器震荡5 min后55℃水浴加热过夜。为比较不同灭菌方法对海藻酸钠凝胶理化性质的影响,分别以液态形式(已配制成凝胶)和固态形式(粉末)对海藻酸钠进行高压蒸汽灭菌,固态灭菌的粉末进一步在无菌条件下配成凝胶,用于细胞实验。
1.3 小鼠骨髓间充质干细胞(mMSCs)的分离、培养和纯化 取出生7 d的ICR雄性小鼠两侧股骨,剔除肌肉等其他组织,用D-Hanks液将细胞从骨髓腔中吹打出,经离心后加入至含有15%胎牛血清的DMEM培养基,按3×106/cm2接种于6 cm的培养皿中。置于37℃的5%CO2饱和湿度为95%的CO2孵箱内培养。2 d后全量换液,以后每2~3 d更换一次培养基。细胞融合达80%时用0.25%胰蛋白酶消化2~3 min,用全培养液终止消化,1000 r/min离心5 min,弃上清后用全培养液重新悬浮细胞。每皿细胞重新接种到2个培养皿内,进行传代扩增纯化。
1.4 MTT法测定细胞活性 分别用固态灭菌和液态灭菌两种方法,各配制浓度为1%和5%及10%的海藻酸钠凝胶铺于96孔板底。取第3代对数生长期的mMSCs,制备单细胞悬液,按750个细胞/孔接种于铺有海藻酸钠凝胶并含完全培养液的96孔培养板中。6 d内每天进行MTT试验。每孔细胞加入10 μl MTT(1 g/L),继续培养4 h。离心去除培养液,加入二甲亚砜裂解细胞,570 nm波长下测定OD值。以未加MTT孔为本底,其余孔的OD值扣除本底后均以该组未铺凝胶孔为基准换算成百分数。
1.5 动物及SCI模型 雄性ICR小鼠18只(购自浙江省医学科学院),体重(20±2)g。动物随机分成3组:移植组(SA-mMSCs组,n=6),手术对照组(control组,n=6)以及假手术组(sham组,n=6)。SCI模型采用脊髓全横断方法制备。小鼠麻醉后手术,打开椎板暴露T9-T10节段脊髓,在T9-T10脊髓节段之间切除一段脊髓,建立脊髓全横断损伤模型。移植组术后于椎管内填充等剂量包裹有mMSCs的海藻酸钠凝胶;手术对照组术后不填充任何物质;假手术组仅打开椎板,不切断脊髓。手术后给予定期排尿,每日1次腹腔注射青霉素抗感染。
1.6 行为学评分 实验小鼠分别在术后1、3、6、10、14 d进行行为学评分,采用Basso小鼠后肢运动功能评分法(Basso mouse scale,BMS)评价小鼠脊髓神经功能恢复情况。将小鼠放在旷场上,5 min内观察其爬行时臀、膝、踝关节、行走、躯干运动及其协调情况。评分在双盲条件下进行。
1.7 组织切片观察 实验动物于术后14 d处死,经灌注固定后取出脊髓组织,分别经固定及蔗糖梯度脱水后,行冰冻连续纵切片,片厚20 μm。脊髓组织切片用抗神经丝(NF-200)进行免疫荧光染色,结果在荧光显微镜(尼康ECLIPSE 50i)下观察。每张切片在镜下(×200)随机选取5个不同的视野拍照,采用自带图像分析软件,计数每个视野中全部的阳性细胞个数取平均值。
2 结果
2.1 海藻酸钠凝胶的制备 比较两种溶剂配制的浓度分别为1%和5%及10%的海藻酸钠凝胶的溶解度,发现随着浓度增高,两组凝胶的溶解度均下降,不同程度出现沉淀现象;去离子水配制的海藻酸钠凝胶,在各个浓度均较生理盐水配制的凝胶有更好的溶解度,故选用去离子水作为本研究中海藻酸钠的制备溶剂。
2.2 不同灭菌方法制备的海藻酸钠凝胶对mMSCs活性的影响 分别将mMSCs培养于用液态灭菌和固态灭菌方法制备的海藻酸钠凝胶上,连续6 d用MTT法测定细胞活性。各时间点的细胞活性分别以未加海藻酸钠凝胶孔为基准换算成百分数。与液态灭菌法相比,固态灭菌法配置的海藻酸钠可以显著提高mMSCs的细胞活性(P<0.01),这种促进作用在培养第4天达到最大(P<0.01)。而两种方法配置的不同浓度的海藻酸钠中,10%浓度均为最佳效应浓度(表1)。
2.3 海藻酸钠凝胶包被mMSCs移植对SCI小鼠行为学评分的影响 在小鼠脊髓全横断模型中,用固体灭菌法配置的浓度为10%的海藻酸钠包被mMSCs填充断端,该组小鼠从术后第6天起,2周内的BMS评分均高于断端未填充任何物质的手术对照组(表2)。
表1 不同灭菌方法制备的海藻酸钠凝胶对mMSCs活性的影响Table 1 The effect of sodium alginate gels prepared with different sterilization on the cell viability of mMSCs(n=10,)
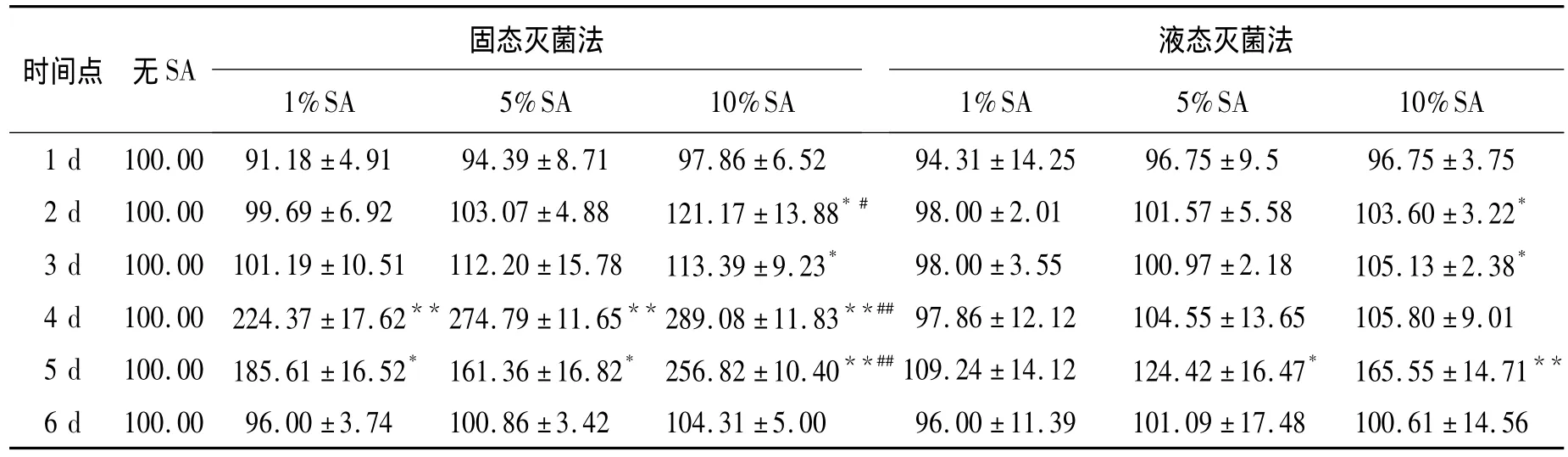
表1 不同灭菌方法制备的海藻酸钠凝胶对mMSCs活性的影响Table 1 The effect of sodium alginate gels prepared with different sterilization on the cell viability of mMSCs(n=10,)
与无 SA 组比较,*:P <0.05,**:P <0.01;与液态灭菌法处理比较,#:P <0.05,##:P <0.01.
固态灭菌法液态灭菌法时间点 无SA 1%SA 5%SA 10%SA 1 d 100.00 91.18 ±4.91 94.39 ±8.71 97.86 ±6.52 91 %SA 5%SA 10%SA 4.31 ±14.25 96.75 ±9.5 96.75 ±3.752 d 100.00 99.69 ±6.92 103.07 ±4.88 121.17 ±13.88*# 98.00 ±2.01 101.57 ±5.58 103.60 ±3.22*3 d 100.00 101.19 ±10.51 112.20 ±15.78 113.39 ±9.23* 98.00 ±3.55 100.97 ±2.18 105.13 ±2.38*4 d 100.00 224.37 ±17.62**274.79 ±11.65** 289.08 ±11.83**##97.86 ±12.12 104.55 ±13.65 105.80 ±9.015 d 100.00 185.61 ±16.52* 161.36 ±16.82* 256.82 ±10.40**##109.24 ±14.12 124.42 ±16.47* 165.55 ±14.71**6 d 100.00 96.00 ±3.74 100.86 ±3.42 104.31 ±5.00 96.00 ±11.39 101.09 ±17.48 100.61 ±14.56
表2 不同时间点各组小鼠BMS评分比较Table 2BMS score at different time points after SCI(n=6,)
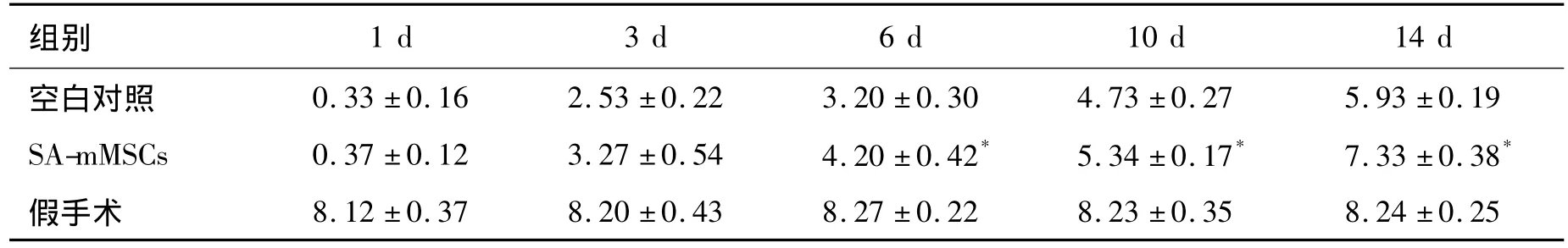
表2 不同时间点各组小鼠BMS评分比较Table 2BMS score at different time points after SCI(n=6,)
与空白对照组比较,*:P<0.05.
组别1 d 3 d 6 d 10 d 14 d空白对照 0.33 ±0.16 2.53 ±0.22 3.20 ±0.30 4.73 ±0.27 5.93 ±0.19 SA-mMSCs 0.37 ±0.12 3.27 ±0.54 4.20 ±0.42* 5.34 ±0.17* 7.33 ±0.38*假手术 8.12 ±0.37 8.20 ±0.43 8.27 ±0.22 8.23 ±0.35 8.24 ±0.25
2.4 免疫荧光染色结果 假手术组小鼠脊髓纵切片的灰质部NF-200阳性细胞明显多于其余2组,且细胞有较多突起,结构有序。手术对照组的断端附近结构紊乱,灰质部NF阳性细胞减少,细胞形态异常。而SA-mMSCs组小鼠脊髓纵切片的NF阳性细胞明显多于手术对照组(P<0.01),且组织的形态结构也较对照组有明显改善(图1)。
3 讨论
海藻酸钠是一类从褐藻中提取出的天然线性多糖,由β-D-甘露糖醛酸(M)和α-L-古洛糖醛酸(G)通过1,4-糖苷键结合而成。海藻酸钠较难溶于水,其粉末遇水变湿形成微粒,微粒迅速粘合在一起形成团块,后者缓慢水化并溶解。当水中含有其它影响海藻酸盐水合的化合物时,如水中的糖、淀粉或蛋白质及浓度高于0.5%的单价阳离子盐,海藻酸钠会更难溶解于水,故在配制溶液时需要延长混合时间。本实验比较了去离子水和生理盐水两种溶剂配制的海藻酸钠凝胶的溶解性,发现生理盐水单价阳离子的存在的确增加了海藻酸钠溶解的难度,当浓度达到10%时出现沉淀。故本实验选用去离子水作为海藻酸钠的溶剂。
海藻酸钠自身带有二价阴离子,在二价阳离子存在条件下可交联形成网状水凝胶。该凝胶为细胞的生长提供了三维空间,又因其具有很好的亲水性,营养物质易于渗透扩散,且其酶解产物对细胞无毒害作用,故非常适宜细胞生长。因此,海藻酸钠凝胶在组织工程研究中日益受到重视[4]。用于组织工程的材料在使用前都需要进行灭菌处理,而海藻酸钠是一种对热敏感的多糖单链大分子,在溶液状态下,加热和照射都会导致分子链断裂,以至于影响海藻酸钠的理化性能[8]。李洪川等研究了不同的消毒方法对海藻酸钠-明胶共混体的pH值、吸光度值和黏度的影响,发现固体高压蒸汽灭菌法的影响相对较小,是较好的灭菌方法[9]。本实验在其研究基础上,比较了液态高压蒸汽灭菌法和固态高压灭菌法制备的海藻酸钠凝胶的pH值及其对MSCs的生物学性状的不同影响。
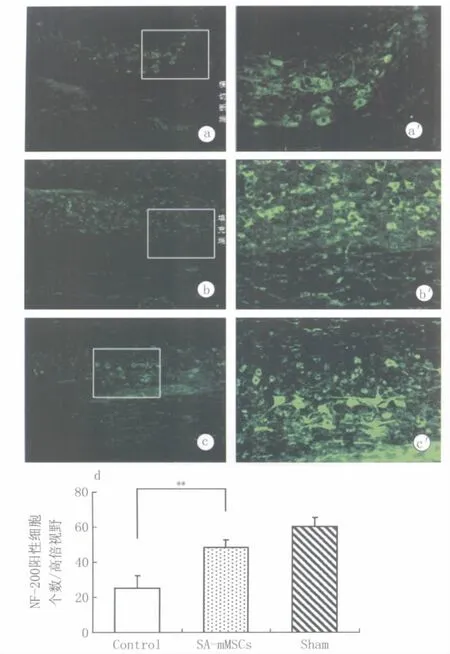
图1 术后2周各组小鼠脊髓组织NF-200阳性细胞的比较Fig.1 Positive staining of NF-200 in spinal cord tissues 2 weeks after SCI
海藻酸钠作为组织工程的载体,使细胞的生活状态接近体内状态,有利于细胞内环境的维持[10-11]。王嫣等观察了海藻酸钠对大鼠MSCs的生物学效应,发现MSCs在海藻酸钠凝胶中生长良好,且向成骨细胞分化[5]。王海宝等将海藻酸钠作为许旺细胞移植的载体用于脊髓损伤的治疗,观察到许旺细胞-海藻酸钠凝胶移植能抑制大鼠脊髓损伤后脊髓细胞凋亡、促进Bcl-2的表达,促进脊髓运动功能的恢复[7]。为明确海藻酸钠凝胶对mMSCs的生物学效应,我们用两种不同灭菌方法制备了1%、5%、10%三种浓度的海藻酸钠凝胶,分别用作mMSCs的载体,以MTT法鉴定不同时间点细胞活性。结果发现,固态高压蒸汽灭菌法制备的海藻酸钠凝胶pH值为7.21,与小鼠生理条件最为接近;同时,该法制备的凝胶可提高mMSCs的活性,且以浓度为10%最为明显。故我们选择用固态灭菌法制备的浓度为10%的海藻酸钠凝胶作为mMSCs移植的载体,用于脊髓全横断模型的干细胞移植治疗。
干细胞移植被认为是脊髓损伤修复最有前景的治疗手段[12],研究发现SCI后移植MSCs,后者可通过抑制免疫反应,分化为神经样细胞,或分泌神经营养物质,促进损伤脊髓修复和神经功能恢复。但是干细胞移植过程中常需要合适的载体。基于海藻酸钠凝胶良好的生物相容性,较大的细胞载入量及我们观察到的提高活性作用,我们用固态灭菌法配制浓度为10%的海藻酸钠凝胶包被mMSCs,填充小鼠脊髓断端,2周内评价小鼠后肢的运动功能,并在组织切片上观察神经丝的表达情况。研究结果发现,与未进行移植治疗的SCI组小鼠比,海藻酸钠-mMSCs移植组小鼠的后肢运动功能明显增强,与之对应,其脊髓切片NF-200阳性细胞明显较未移植组多,且组织的形态结构有较显著的改善。这些结果提示,用固态灭菌法制备的海藻酸钠凝胶包被mMSCs不仅能在体外促进细胞活性,还能在体内改善mMSCs的生存环境,从而促进损伤段神经的再生,加速脊髓损伤的修复过程。
综上所述,我们分别在细胞水平和动物模型整体水平上,探讨了不同方法制备的海藻酸钠凝胶对mMSCs的生物学性状的影响及其临床应用价值,结果表明,用固态高压蒸汽灭菌法制备的海藻酸钠凝胶能在体外促进mMSCs的活性,将其作为干细胞的移植载体在小鼠脊髓损伤治疗中有较好的疗效,为临床干细胞移植治疗中细胞载体的选择提供了实验参考。
[1]CAI Pei-qiang,TANG Xun,LIN Yue-qiu(蔡培强,汤 逊,林月秋).Present situation and progress in research on transplantation and repair of spinal cord injuries[J].Chinese Journal of Trauma(中华创伤杂志),2004,20(11):701-707.(in Chinese)
[2]UCCELLI A,BENVENUTO F,LARONI A,et al.Neuroprotective features of mesenchymal stem cells[J].Best Pract Res Clin Haematol,2011,24(1):59-64.
[3]CHEN Shao-qiang,LIN Jian-hua(陈少强,林建华).Advances in Repair of Spinal Cord Injury by Transplantation 0f Marrow Mesenchymal Stem Cells[J].Chinese JournalofReparative and Reconstructive Surgery(中国修复重建外科杂志),2007,21(5):507-514.(in Chinese)
[4]HE Shu-lan,YIN Yu-ji,ZHANG Min,et al(何淑兰,尹玉姬,张 敏,等).Research Advances on Sodium Alginate Hydrogels for Tissue Engineering[J].ChemicalIndustry and Engineering Progress(化工进展),2004,11(23):1174-1178.(in Chinese)
[5]WANG Yan,CHEN Xiao-ju,WANG Lan,et al(王嫣,陈小菊,王 兰,等).The Effects of Alginate Gels on Bone Mesenchymal Stem Cells[J].Journal of Chongqing Medical University(重庆医科大学学报),2006,31(4):478-536.(in Chinese)
[6]WANG Yan,CHEN Xiao-ju,WANG Lan,et al(王嫣,陈小菊,王 兰,等).Induction of Bone Mesenchymal Stem Cells to Form Osteoblast on Alginate Gels[J].China Biotechnology(中国生物工程杂志),2006,26(9):38-42.(in Chinese)
[7]WANG Hai-bao,MA Xue-qian,LIU Zeng-Xu,et al(王海宝,马学强,刘曾旭,等).Schwann cellsalginic acid sodium hydrogel transplantation for repair of spinal cord injury in rats[J].J ournal of Clinical Rehabilitative Tissue Engineering Research(中国组织工程研究与临床康复),2009,13(38):7539-7542.(in Chinese)
[8]LI Bo,DOU Ming,YANG Hong-xia(李 博,窦明,杨红霞).Study on Heat Stabilization of Sodium Alginate[J].Journal Of Anhui Agricultural Sciences(安徽农业科学),2009,37(35):17348-17375.(in Chinese)
[9]LI Hong-chuan,YUAN Xiao-ming,XIA Yang,et al(李洪川,袁晓明,夏 扬,等).Effect of Different Sterilization on Sodium Polymannuronate-Gelatin Complex[J].Journal of Clinical Rehabilitative Tissue Engineering Research(中国组织工程研究与临床康复),2009,13(3):510-512.(in Chinese)
[10]YU J,CHRISTMAN K L,CHIN E,etal.Restoration ofLeftVentricularGeometry and Improvement of Left Ventricular Function in a Rodent Model of Chronic Ischemic Cardiomyopathy[J].J Thorac Cardiovasc Surg,2009,137(1):180-186.
[11]YU J,GU Y P,DU K T,et al.The Effect of Injected RGD Modified Alginate on Angiogenesis and Left Ventricular Function in a Chronic Rat InfarctModel[J].Biomaterials,2009,30:751-756.
[12]WRIGHT K T,EL MASRI W,OSMAN A,et al.Bone Marrow for the Treatment of Spinal Cord Injury:Mechanisms and Clinical Application[J].Stem Cells,2010,29(2):169-178.
