维生素E琥珀酸酯联合紫杉醇对Her-2过表达乳腺癌细胞的诱导凋亡研究
2011-05-30赵妍李里姜秋颖申维喜武露艳阎婷婷
赵妍 李里 姜秋颖 申维喜 武露艳 阎婷婷
哈尔滨医科大学附属第二医院肿瘤内科,黑龙江 哈尔滨 150086
乳腺癌是危害女性健康的常见恶性肿瘤,其发病率占妇女肿瘤的31%,其中有10%~34%属于Her-2基因过表达[1]。目前,紫杉醇已成为治疗乳腺癌的有效药物之一。研究证明,乳腺癌细胞中Her-2基因的过度表达降低了其对紫杉醇的敏感性[2-4],Bcl-2蛋白是一种重要的细胞凋亡抑制蛋白,有研究报道,Bcl-2可使肿瘤细胞对紫杉醇产生抗药性,相反降低细胞Bcl-2的水平可使细胞对紫杉醇敏感[5]。维生素E琥珀酸酯(vitamin E succinate,VES)是天然维生素E的酯化衍生物,可诱导肿瘤细胞凋亡,却对正常细胞组织没有毒性作用[6]。研究报道VES作用于白血病细胞Raji、前列腺癌细胞后,Bcl-2蛋白表达下降[7-8],本研究以VES、紫杉醇单独及联合作用于Her-2过表达乳腺癌细胞MDA-MB-453,通过检测其诱导凋亡率,判断VES对紫杉醇诱导Her-2过表达乳腺癌细胞MDA-MB-453的影响。
1 材料和方法
1.1 主要试剂与仪器
VES为Sigma公司产品;紫杉醇为百时美施贵宝公司产品;鼠抗人Her-2单抗、SP检测试剂盒及DAB显色试剂盒均购自北京中杉金桥生物技术有限公司;Annexin V-FITC凋亡检测试剂盒购自北京宝赛生物技术有限公司;TUNEL凋亡检测试剂盒购自Roche公司(产品规格:20T,产品货号:SK-9000);流式细胞仪为哈尔滨医科大学公卫学院提供。
1.2 细胞与细胞培养
人乳腺癌MDA-MB-453细胞株购自中国科学院上海生命科学研究院;优级胎牛血清为杭州四季青公司产品;RPMI 1640培养基为北京赛默飞世尔生化制品有限公司产品。MDAMB-453细胞在含10%胎牛血清的RPMI 1640培养基中于37 ℃、CO2体积分数为5%的条件下培养。
1.3 免疫细胞化学法检测MDA-MB-453细胞株Her-2蛋白的表达
取对数生长期MDA-MB-453乳腺癌细胞株于离心管中离心(1 000 r/min,离心半径为13.5 cm,5 min),弃上清液,加中性甲醛固定(甲醛与细胞量之比为7∶1)后制备成石蜡切片,共制备5张切片,按照Her-2染色试剂盒操作步骤检测表达率。
1.4 流式细胞仪检测该细胞株的自身凋亡率及VES组和乙醇组MDA-MB-453细胞株的凋亡率
取对数生长期MDA-MB-453细胞,用RPMI 1640和10%FS培养液充分吹打使细胞混匀,细胞计数为71×104/mL,为达到2×106/mL的上机标准,于1 000 r/min离心5 min后去上清液,各加1 mL正常培养液充分吹打使细胞混匀后,吸出移至2个EP管中并分别标记为0和1,再离心弃上清液加PBS冲洗离心3次(1 000 r/min,离心半径13.5 cm,5 min),加 200 μL Binding Buffer,培养 36 h 后加入10 μL Annexin V-FITC和5 μL PI轻混匀,避光反应10 min后追加300 μL Binding Buffer后上机。乙醇组除所用培养液为0.15%的乙醇+RPMI 1640+10%FS,其他操作同上。VES组除培养液为15 mg/L VES+ RPMI 1640+10%FS,其他操作同 上,以上步骤每组均重复3次。
1.5 TUNEL法检测不同浓度的VES及不同浓度的紫杉醇分别单独作用于MDA-MB-453细胞株的凋亡率
VES以0.15%的乙醇溶解,配制成浓度为10、20 mg/L的VES。取对数生长期的MDAMB-453细胞珠接种于96孔板中,细胞计数每孔约1×106个,加培养液至300 μL,分别用10、20 mg/L的 VES,50、100 nmol/L的 紫 杉醇处理MDA-MB-453细胞24、48 h后,参照TUNEL试剂盒染色检测细胞凋亡,计算凋亡指数,凋亡指数(AI)=(凋亡细胞数/计数总细胞数)×100%。
1.6 TUNEL法检测VES联合紫杉醇作用于MDA-MB-453细胞株的凋亡率
VES联合紫杉醇作用于MDA-MB-453细胞, 共8组, 第1组:VES 10 mg/L, 紫 杉醇50 nmol/L,作用时间24 h;第2组VES 10 mg/L,紫杉醇50 nmol/L,作用时间48 h;第3组VES 10 mg/L,紫杉醇100 nmol/L,作用时间24 h;第4组:VES 10 mg/L,紫杉醇100 nmol/L, 作 用 时 间 48 h;第 5组:VES 20 mg/L,紫杉醇50 nmol/L,作用时间24 h;第 6组:VES 20 mg/L, 紫 杉 醇 50 nmol/L,作用时间48 h;第7组:VES 20 mg/L,紫杉醇100 nmol/L,作用时间24 h;第8组:VES 20 mg/L,紫杉醇100 nmol/L,作用时间48 h;各组药物分别作用于MDA-MB-453细胞,参照TUNEL试剂盒染色检测细胞凋亡,计算凋亡指数。
1.7 统计学处理
采用SPSS 10.0软件进行统计学分析,显著性比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 免疫细胞化学法检测乳腺癌细胞MDAMB-453的Her-2表达水平
5张切片Her-2蛋白表达率分别为65.30%、68.67%、63.64%、65.12% 和69.57%,其95%CI:63.32%~69.60%,进一步验证了MDA-MB-453细胞为Her-2蛋白过表达乳腺癌细胞(图1)。
2.2 MDA-MB-453细胞株的自身凋亡率及VES组和乙醇组作用于该细胞株的凋亡率
MDA-MB-453细胞的自身凋亡率为2.1%。0.15%的乙醇作用于MDA-MB-453细胞株36 h后的凋亡率为2.4%。15 mg/L的 VES作用于MDA-MB-453细胞株36 h后的凋亡率为9%。和空白对照组相比,乙醇组凋亡率改变不明显(P>0.05),VES 组凋亡明显 (P<0.05)。
2.3 VES和紫杉醇单独作用以及联合作用于MDA-MB-453细胞的凋亡率
VES单独作用可诱导Her-2过表达乳腺癌细胞凋亡,并成剂量和时间依赖关系;紫杉醇单独作用诱导Her-2蛋白过表达乳腺癌细胞凋亡呈剂量和时间依赖关系(表1)。
VES和紫杉醇联合作用的TUNL染色结果见图2,根据染色结果计算凋亡指数,可见VES联合紫杉醇作用于Her-2过表达乳腺癌细胞后,对细胞增殖的抑制作用较两药单药作用时明显增强,具有统计学意义(P<0.05,表1)。但这种诱导凋亡作用不成剂量和时间依赖关系,其中以10 mg/L的 VES联合100 nmol/L的紫杉醇作用时间为48 h对MDA-MB-453细胞的诱导凋亡作用最强。

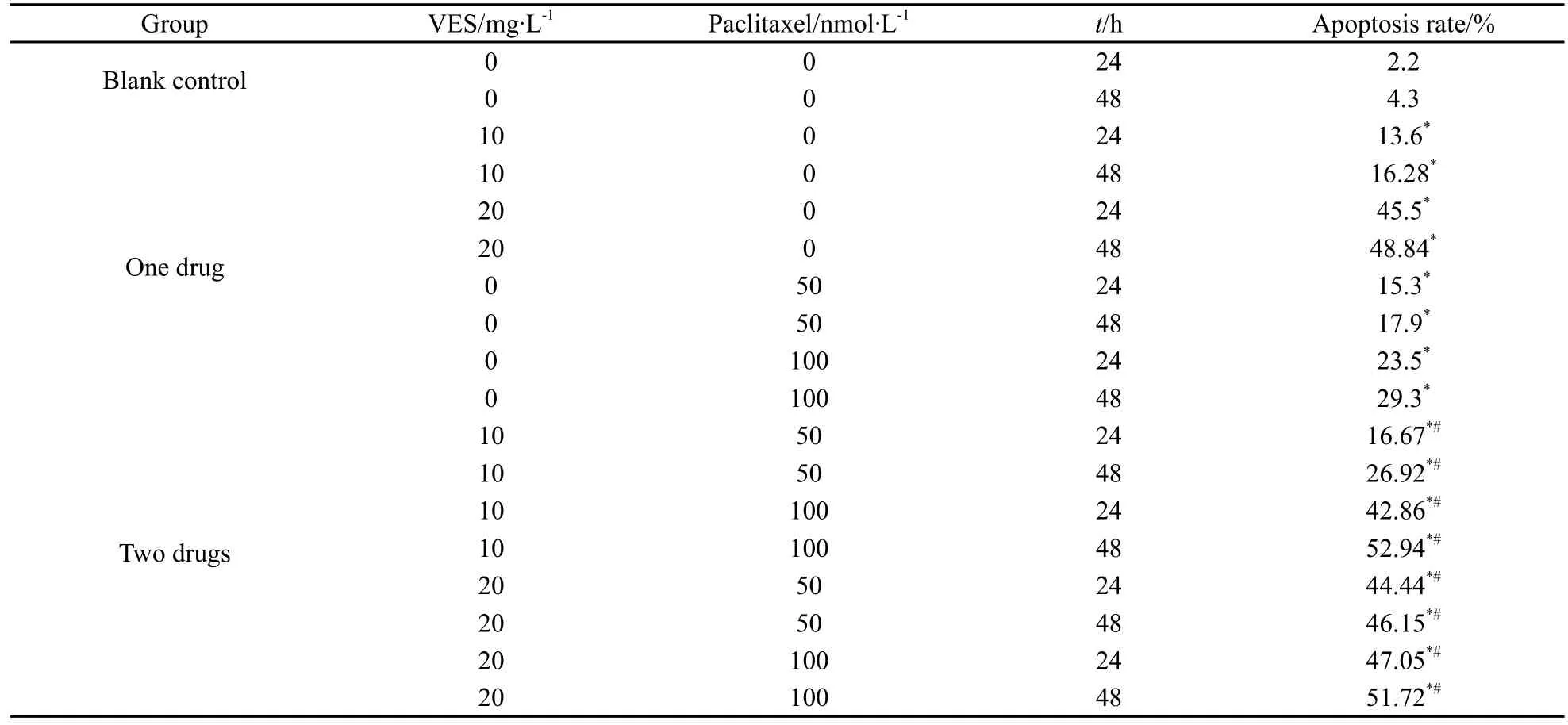
表 1 两种药物单独及联合对Her-2过表达乳腺癌细胞的诱导凋亡率Tab.1 The induction of apoptosis by the two drugs in breast cancer cells
3 讨 论
乳腺癌是危害女性健康的常见恶性肿瘤,其发病率占妇女肿瘤的31%,目前的治疗手段基本可以使患者获得较高的生存率。紫杉醇是治疗乳腺癌的有效药物之一,其机制主要是促进微管聚合和稳定已聚合微管,将细胞阻滞于G2/M期,抑制肿瘤细胞的迁移,激活免疫细胞等对乳腺癌细胞进行杀伤[9-10]。然而,约有30%的乳腺癌患者为Her-2基因过表达,研究表明其对化疗药物存在明显耐药,常导致化疗失败[11]。Ciardiello等[12]也已证明Her-2基因过表达的乳腺癌细胞对紫杉醇的敏感性下降,为了提高紫杉醇的疗效,可以寻找一些紫杉醇化疗增敏的途径。
VES可使肿瘤细胞阻滞于G1期,对恶性肿瘤细胞有特异性的生长抑制作用,却对正常细胞组织没有毒性作用。研究表明,VES对乳腺癌、前列腺癌、舌癌及肾癌等恶性肿瘤均具有显著的诱导凋亡作用[13-16]。经证实,VES在体外诱导乳腺癌细胞凋亡,在体内对荷乳腺癌小鼠有抑瘤作用[17-18]。
本实验用免疫细胞化学法验证了MDAMB-453乳腺癌细胞为Her-2蛋白过表达乳腺癌细胞,以50、100 nmol/L的紫杉醇作用于MDA-MB-453细胞24、48 h后的诱导凋亡率分别为:15.3%、17.9%、23.5%和29.3%。以10和20 mg/L的VES作用于MDA-MB-453细胞24、48 h后的凋亡率分别为13.6%、16.28%、45.5%和48.84%。说明紫杉醇和VES对Her-2蛋白过表达乳腺癌细胞MDA-MB-453均有诱导凋亡作用,这种作用成浓度和时间依赖关系。本研究再以两药联合作用于MDAMB-453细胞,结果表明两药联合的诱导凋亡率明显高于单药,并证实两药有协同作用(P<0.05),随着对VES的深入研究,其有望成为紫杉醇化疗药物发挥疗效的增敏剂。
已证实 Bcl-2蛋白是一种重要的细胞凋亡抑制蛋白,定位于线粒体内膜、内质网膜及核膜上。有报道,Bcl-2可使细胞对紫杉醇产生抗药性,相反降低Bcl-2的水平可使细胞对紫杉醇敏感,表明Bcl-2水平与细胞对紫杉醇的耐药直接相关。研究证明VES作用于白血病细胞Raji、前列腺癌细胞后,Bcl-2蛋白表达下降,本实验VES作用于MDA-MB-453细胞有可能通过降低Bcl-2的水平使肿瘤细胞对紫杉醇敏感而产生协同作用。此外,紫杉醇将细胞阻滞于G2/M期,VES可使肿瘤细胞阻滞于G1期,协同作用有可能与两种药物作用于细胞的不同周期有关。但具体机制需要下一步研究。
[1]SHIN S J, HYJEK E, EARLY E, et al.intratumoral heterogeneity of Her-2/neu in invasive mammary carcinomas using fluorescence in-situ hybridization and tissue microarray[J].Int J Surg Pathol, 2006, 14(4): 279-284.
[2]师以康, 张胜华, 黄云虹, 等.乳腺癌细胞的Her-2过表达降低其对紫杉醇的药物敏感性 [J].中国药理学通报,2009, 25(4): 444-448.
[3]LU J, TAN M, HUANG W C, et al.Mitotic deregulation by survivin in erbB2-overexpressing breast cancer cells contributes to Taxol resistance [J].Clin Cancer Res, 2009,15(4): 1326-1334.
[4]WANG S, HUANG X, LEE C K, et al.Elevated expression of erbB3 confers paclitaxel resistance in erbB2- overexpressing breast cancer cells via upregulation of Survivin [J].Oncogene, 2010, 29(29): 4225-4236.
[5]ZHOU M, LIU Z, ZHAO Y, et al.MicroRNA-125b confers the resistance of breast cancer cells to paclitaxel through suppression of proapoptotic Bcl-2 antagonist killer 1 (Bak1)expression [J].J Biol Chem, 2010, 285(28): 21496-21507.
[6]NEUZIL J, WEBER T, GELLERT N, et al.Selective cancer cell killing by alpha-tocopheryl succinate [J].Br J Cancer,2001, 84(1): 87-89.
[7]肖浩文, 叶建锋, 欧程山, 等.VES抑制Raji细胞增殖中对CDK2和Bcl-2/Bax蛋白表达的影响 [J].中国公共卫生,2003, 19(1): 1-3.
[8]REAGAN-SHAW S, NIHAL M, AHSAN H, et al.Combination of vitamin E and selenium causes an induction of apoptosis of human prostate cancer cells by enhancing Bax/Bcl-2 ratio [J].Prostate, 2008, 68(15): 1624-1634.
[9]JORDAN M A, WILSON L.Microtubules as a target for anticancer drugs [J].Nat Rev Cancer, 2004, 4(4): 253-265.
[10]GLIGOROV J, LOTZ J P.Preclinical pharmacology of the taxanes: Implications of the differences [J].Oncologist,2004, 9(Suppl 2): 3-8.
[11]MENARD S, PUPA S M, CAMPIGLIO M, et al.Biologic and therapeutic role of Her-2 in cancer [J].Oncogene, 2003,22(42): 6570-6578.
[12]CIARDIELLO F, CAPUTO R, POMATICO G, et al.Resistance to taxanes is induced by c-erbB-2 overexpression in human MCF-10A mammary epithelial cells and is blocked by combined treatment with an antisense oligonucleotide targeting type Ⅰ protein kinase A [J].Int J Cancer, 2000,85(5): 710-715.
[13]KLINE K, YU W, SANDERS B G.Vitamin E and breast cancer [J].J Nutr, 2004, 134(Suppl 12): 3458-3462.
[14]ISRAEL K, YU W, SANDERS B G, et al.Vitamin E succinate induces apoptosis in human prostate cancer cells: roles of Fas in vitamin E succinate- triggered apoptosis [J].Nutr Cancer, 2000, 36(1): 90-l00.
[15]曹选平, 王树斌, 周弘, 等.维生素E琥珀酸酯诱导舌鳞癌Tca8113细胞凋亡的研究 [J].华西口腔医学杂志, 2008,26(4): 362-364.
[16]WU X X, KAKEHI Y, JIN X H, et al.Induction of apoptosis in human renal cell carcinoma cells by vitamin E succinate in caspase-independent manner [J].Urology, 2009, 73(1):193-199.
[17]张伟, 张军初, 徐昕昀, 等.维生素E琥珀酸酯对乳腺癌荷瘤裸鼠的抑瘤作用 [J].中国普通外科杂志, 2005,14(12): 918-921.
[18]张伟, 徐昕昀, 张军初, 等.维生素E琥珀酸酯诱导MDAMB-435乳腺癌细胞的凋亡 [J].肿瘤, 2006, 26(4): 318-321.
