枯草芽孢杆菌a1所产抗真菌活性物质的稳定性研究
2011-05-30钟啸萍熊智强陈小龙
钟啸萍,熊智强,陈小龙
(浙江工业大学生物与环境工程学院发酵工程研究所,浙江 杭州 310014)
真菌引起的植物病害位居植物3类病害之首,其危害大于细菌病害和病毒病害[1]。目前对植物病害的防治普遍采用速克灵、百菌清、多菌灵等化学农药[2-3],而化学农药对非靶标生物的毒害、对环境的污染、使有害物产生抗药性的问题至今仍难以解决。化学农药的残留问题,更是极大的危害人类健康,引起了食品安全的信任危机。开发新型的广谱、高效、低毒的生物农药被认为是一条解决上述问题的有效途径。
本实验室以顺丁烯二酸酐为基础碳源,从土壤中分离得到的1株对灰霉病菌具有较强抑制作用的菌株a1,发现其具有较好的潜力开发成生物农药,对其进行形态学、生理生化鉴定和16 SrDNA序列分析,确定其为枯草芽孢杆菌 Bacillus subtilis[4]。之后又对a1菌株所产抗真菌活性物质发酵条件进行了初步研究[5]。为了明确a1菌株发酵液的保存环境及分离纯化活性物质的条件,我们对a1菌株发酵液在不同温度,酸碱和光照条件下的稳定性进行了测定,其结果为开发新型生物源农药提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试验菌株
实验室自行筛选的枯草芽孢杆菌a1(Bacillus subtilis a1)。
1.1.2 供试病原菌
番茄灰霉病菌 (Botrytis cinerea)和油菜菌核病菌 (Sclerotinia sclerotiorum)均由实验室提供。
1.1.3 培养基
PDA培养基:土豆200 g,葡萄糖200 g,水1 000 mL,pH自然。种子液培养基和发酵培养基均为PDA液体培养基。
1.2 方法
1.2.1 发酵液的制备
从PDA斜面上刮下2环枯草芽孢杆菌a1到种子液培养基中,30℃、180 r·min-1培养24 h后,按5%的接种量接入发酵培养基中,30℃、180 r·min-1震荡培养96 h。
1.2.2 抑菌活性的测定
采用生长速率法测定[6]。发酵结束后取30 mL发酵液置于15 000 r·min-1的离心机上离心 10 min,然后取上清液稀释10倍。取1 mL稀释液与9 mL的融化的PDA固体培养基混匀。待培养基冷却凝固后,接种直径为6 mm的供试病原菌菌饼,2~3 d后,测量菌圈直径,计算抑菌率。用十字交叉法[7]测菌圈直径。以无菌水作对照,做3个平行取平均值。
菌圈直径 (mm)=实际测得菌圈直径 -6,抑菌率 (%)=(对照菌圈直径-处理菌圈直径)/对照菌圈直径×100。
1.2.3 确定抗菌物质产生部位试验
从PDA斜面上刮下2环枯草芽孢杆菌a1到种子液培养基中,30℃、180 r·min-1培养24 h后,按5%的接种量接入发酵培养基中,30℃、180 r·min-1震荡培养。发酵24 h后,取出25 mL发酵液用15 000 r·min-1离心机离心10 min。取上清液加入25 mL pH值为6.2的磷酸缓冲液稀释后进行抑菌活性的测定。收集菌体,加入50 mL pH值为6.2的磷酸缓冲液,用超声破碎仪进行破碎。然后再用15 000 r·min-1离心机离心10 min,取上清液测定抑菌活性。按上述方法分别测定发酵24,48,72和96 h时胞外产物和胞内产物的抑菌活性。
1.2.4 热稳定性试验
将发酵上清液分别置于60,80,100,120℃下处理20 min,然后冷却至室温,与室温下的发酵上清液作比较,用生长速率法测定抑菌活性[8]。
1.2.5 pH值稳定性试验
分别将发酵上清液的p H值从1调到14,处理12 h后,将这些发酵上清液离心10 min,15 000 r·min-1,然后将 pH调回初始 pH(pH值为6),用生长速率法测定抑菌活性[9]。
1.2.6 紫外线稳定性试验
将发酵上清液置于紫外灯下照射1,6,12和24 h,与未照射紫外光的发酵上清液作比较,用生长速率法测定抑菌活性。
1.2.7 光照稳定性试验
将发酵上清液置于日光灯下照射1,6,12和24 h,与未照射的发酵上清液作比较,用生长速率法测定抑菌活性。
1.2.8 遗传稳定性试验
将a1菌株在PDA斜面上每隔2 d转接1次,连续培养8代,然后每代分别发酵,最后测定各代发酵液的抑菌活性[10]。
2 结果与讨论
2.1 抗菌物质产生部位的确定
从表1看出,枯草芽孢杆菌a1胞外产物和胞内产物均有抑菌活性,胞外产物的抗菌活性明显高于胞内产物。所以枯草芽孢杆菌a1所产的抗菌物质主要存在于胞外。胞内产物和胞外产物有可能是不同的物质,这需要在进一步实验中证实。
2.2 热稳定性
a1菌株发酵液在不同温度下处理20 min,随着温度的升高,发酵液的颜色变深,从室温时的淡黄色变成120℃时的黄褐色。从表2可以看出,a1菌株发酵液在60℃和80℃下处理20 min的抑菌活性比室温下有所下降,但仍保持有较高的抑菌活性。发酵液经过100℃处理,抑菌率有较大幅度的下降,对菌核病菌和灰霉病菌有一定的抑菌效果,在120℃处理下则完全丧失了抑菌活性。结果表明a1菌株的抗菌物质在80℃以下时稳定性较好。

表1 确定抗菌物质产生部位的试验结果

表2 热稳定性的试验结果
2.3 pH稳定性
a1菌株发酵上清液在pH<5时产生沉淀,随着酸性的增大,液体浑浊度也增大,离心取沉淀后的上清液的抑菌活性明显降低。沉淀加水后可重新溶解,且溶液经检测后有一定的抑菌活性。当发酵上清液pH>8时,上清液颜色变深,没有产生沉淀,抑菌活性也大幅度下降。在pH为6和7时,发酵上清液颜色没有变化,也没有沉淀产生,而且有较高的抑菌活性。表3结果表明,a1菌株所产活性物质在碱性条件下不稳定,但具有很强的耐酸性。
2.4 紫外线稳定性
由表4可以看出,a1菌株的发酵液在紫外光下照射6 h后,它的抑菌活性没有较大的改变。当紫外照射发酵液12 h和24 h后,活性物质对菌核病菌和灰霉病菌的抑菌率明显下降。表明a1菌株所产物质在紫外光照下不够稳定。
2.5 光照稳定性
从表5可以看出,a1菌株所产活性物质在光照条件下抑菌活性变化不大,与未光照时的抑菌活性相差无几,表明a1菌株所产活性物质在光照下较稳定。
2.6 遗传稳定性
从表6可以看出,a1菌株连续培养8代,其发酵所产物质对菌核病菌和灰霉病菌的抑菌率变化不大,到第8代仍有较高的抑菌活性,而且在实验过程中观察发现每代菌的形态特征都相同,无变化,表明a1菌株在连续传代过程中比较稳定。

表3 pH稳定性试的验结果
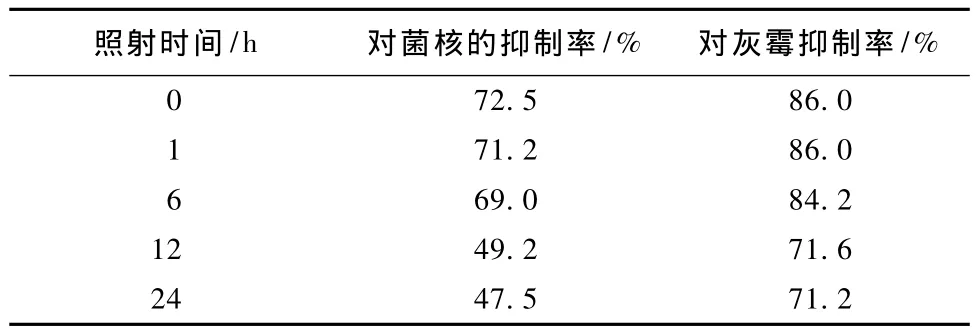
表4 紫外线稳定性的试验结果

表5 光照稳定性的试验结果

表6 遗传稳定性的试验结果
3 小结和讨论
实验结果表明,a1菌株的发酵液在酸性条件下能产生沉淀,且沉淀具有抑菌活性,这一特性为对活性物质进行分离纯化提供了重要依据,但发酵液中的活性物质是否全部转化为沉淀,还需要进一步研究。
a1菌株所产的抗菌物质能耐80℃的高温,在光照和中性条件下活性稳定,在紫外光照射和碱性条件下不稳定。在保存a1菌株的发酵液时不需要避光,在分离纯化抗菌活性物质时应注意避免在碱性条件和超过100℃的高温条件下提取。枯草芽孢杆菌a1的遗传性能相当稳定,连续传8代其所产抗真菌物质活性没有下降,这表明a1菌株具有作为发酵工业化生产菌的潜力。这些特性对以后研究该抗菌物质开发利用和工业化生产具有重要意义。
Bacillus subtili所产的抗菌物质种类的国内外报道很多,主要是一些高分子量蛋白类的抗菌物质[11]和伊枯草菌素之类的低分子量的抗菌肽[12-14]。而目前对这些抗菌物质的稳定性研究也很多,王启军等[15-16]研究的不同枯草芽孢杆菌所产的抗菌物质都是脂肽类化合物具有耐酸碱,热稳定的特性。从类芽孢杆菌菌株B69发酵液中提取出 2种子新的抗菌物质 Pelgipeptin A和Pelgipeptin B,这2种子物质在60℃时处理2 h和pH值 1~8范围内抗菌活性保持稳定[17]。Hammami[18]研究的枯草芽孢杆菌14 B所产的类蛋白抗菌物质可耐121℃高温,在pH 1到8范围内保持稳定的抗菌活性。本研究的结果与Xue-Chang Wu的结果有相似之处,都不耐碱和100℃以上的高温,因此,a1菌株所产抗菌物质有可能是Pelgipeptin A和Pelgipeptin B,但目前的试验还无法判断a1菌株所产抗菌物质的种类,也可能是还未报道过的新抗真菌化合物,下一步研究重点集中在分离纯化抗真菌活性物质及鉴定它的分子结构。
[1] 余凤玉,李振华,曾会才.抗真菌农用抗生素的研究进展[J].热带农业科学,2005,25(1):60-65.
[2] 潘月敏,代玉立,凌萍,等.不同杀菌剂对油菜菌核病菌的室内毒力测定 [J].安徽农业科学,2010,38(5):2433-2434.
[3] 王勇,张文革,何璐,等.绿色木霉·烯酰吗啉水分散片剂对番茄灰霉病的防治效果 [J].湖北农业科学,2007,46(3):396-398.
[4] 江琴琴,陈小龙,沈寅初,等.产抗灰霉病菌物质的微生物筛选和鉴定 [J].农药,2010,49(4):257-259.
[5] 江琴琴,陈小龙.1株产抗灰霉病菌物质菌株的发酵优化研究 [J].安徽农业科学,2010,38(16):8327-8329.
[6] 刘欢,安德荣,慕小倩,等.土壤中抗真菌放线菌 LH33发酵提取物活性研究 [J].西北农林科技大学学报:自然科学版,2009,37(1):145-150.
[7] 张璐,张鞍灵,李晓明,等.日本革菌发酵液抑菌活性初步研究 [J].西北林学院学报,2007,22(3):135-137.
[8] Siewert G,Sruomi J L.An inhibitor of the dephosphorylation of lipid pyrophosphate[J].Sci USA,1993,57(1):767-773.
[9] 何青芳,陈卫良,马志超,等.枯草芽孢杆菌A30菌株产生的拮抗肽的分离纯化与理化性质研究 [J].中国水稻科学,2002,16(4):361-365.
[10] 刘翠娟,段琦梅,安德荣.抗真菌拮抗放线菌的筛选及摇床发酵条件的优化 [J].微生物学杂志,2004,24(4):12-14.
[11] 林东,徐庆,刘忆舟.枯草芽孢杆菌SO113分泌蛋白的抑菌作用及抗菌蛋白的分离纯化 [J].农业生物技术学报,2001,9(1):77-80.
[12] 黄海婵,裘娟萍.枯草芽孢杆菌防治植物病害的研究进展[J].浙江农业科学,2005(3):213-219.
[13] 顾真荣,吴畏,高新华,等.枯草芽孢杆菌 G3菌株的抗菌物质及其特性 [J].植物病理学报,2004,34(2):166-172.
[14] 刘静,王军,姚建铭.枯草芽孢杆菌JA抗菌物质特性的研究及抗菌肽的分离纯化 [J].微生物学报,2004,4(44):511-514.
[15] 王启军.枯草芽孢杆菌B6-1产脂肽和聚-γ-谷氨酸及抗几种植物病原菌的研究 [D].湖北:华中农业大学,博士学位论文,2008.
[16] 钱常娣,李宝庆,赵添,等.枯草芽孢杆菌BAB-1脂肽类化合物的分离及稳定性分析 [J].中国农业科技导报,2009,11(6):69-74.
[17] Xue-Chang Wu,Xiao-Bo Shen,Rui Ding,et al.Isolationand partial characterization of antibiotics produce by Paenibacillus elgii B69 [J]. FEMS Microbiology Letter, 2010, 310:32-38.
[18] Hammami,A.Rhouma,B.Jaouadi,et al.Optimization and biochemical characterization of a bacteriocin from a newly isolated Bacillus subtilis strain14 B for biocontrol of Agrobacterium spp. Strains [J]. Letter in Applied Microbiology,2009,48(2):253-260.
