西红花酸对AGEs诱导血管内皮细胞通透性增加的抑制作用
2011-05-29王建梅周成华张雅琴吴萍萍
向 敏,王建梅,周成华,张雅琴,吴萍萍
(1.苏州卫生职业技术学院检验药学系,江苏苏州 215009;2.苏州市检验医学生物技术重点实验室,江苏苏州 215009;3.徐州医学院药理学教研室,江苏徐州 221004)
内皮细胞(endothelial cells,EC)是分布于血管内膜表面的单层细胞,为一层选择性半透膜,既保持血流通畅,又可保证血液某些成分进入内皮下间隙,提供血管细胞之所需[1]。正常的内皮细胞具有血管屏障,能舒张血管、抗血栓、抑制平滑肌细胞移行和增生的功能,受损的内皮细胞则相对应地会使血管通透性增加、血栓形成增加、血管收缩、促进平滑肌移行和增生[2]。内皮细胞功能紊乱导致血管内皮通透性增高是糖尿病(diabetic mellitus,DM)血管病变早期标志,也是 DM病变的关键环节[1]。在DM血管病变时,患者体内高水平AGEs可使血管内皮细胞通透性增加。多种信号通路,包括AGEs受体(RAGE)、氧化应激和p38MAPK可能参与了内皮细胞通透性变化的病理过程。因此,抑制内皮细胞通透性的升高是减慢DM血管病变发生、发展的重要措施[3]。
西红花酸是西红花的有效组分之一,具有多不饱和共轭烯酸结构,属于类胡萝卜素类,具有多种药理活性作用。我们前期研究发现:在糖尿病大鼠早期肠系膜血管中,血管内皮通透性增加,导致炎症细胞等浸润至血管内皮下层,促发炎症反应,加速血管病变的进程,而西红花酸能保护DM大鼠肠系膜血管,抑制病变发生进程[4]。体外实验发现,西红花酸能抑制AGEs诱导的白细胞(单核细胞/中性粒细胞)与内皮细胞的黏附作用,维护内皮细胞正常的功能[5-7]。本研究将观察西红花酸是否具有抑制AGEs诱导内皮细胞通透性增高的作用,这种抑制作用是否与其影响应激敏感通路p38MAPK有关,从内皮细胞的细胞通透性调节角度探讨西红花酸抗DM血管病变的可能机制。
1 材料与方法
1.1主要试剂西红花酸(crocetin,中国药科大学药理室钱之玉教授提供,HPLC纯度为>99%);葛根素,广东省大日生物化学药业有限公司;DEME培养基,Gibco公司产品;牛血清白蛋白(BSA),南京生兴公司;双层通透的培养皿(transwell,0.4 μm),Corning Corstart公司;辣根过氧化物酶(HRP)标记羊抗兔第二抗体,武汉博士德公司;新生牛血清,HyClone公司;TritonX-100和髓磷脂碱性蛋白(BMP),Sigma公司;罗丹明-鬼笔环肽,美国细胞骨架公司;Protein A-Agrose(sc-2001)和磷酸化p38MAPK(p-p38MAPK)单抗,Santa Cruz biotechnology,INC;闪烁液,南京医科大学同位素实验室。
1.2主要仪器荧光倒置显微镜(尼康公司Ti);全波段酶标仪(Multiskan Spectrum)和CO2培养箱(美国热电公司);液闪测定仪(Wallac Guardian 1414 liquid scientillation counter)
1.3细胞分离与培养参考文献方法[6],用0.5%胰酶消化法分离牛主动脉血管内皮细胞,以含20%新生牛血清的DMEM培养基常规培养,直到细胞融合后进行传代培养,Willebrand因子鉴定表达为阳性,确定为内皮细胞。倒置显微镜下可见内皮细胞呈“鹅卵石”状排列,实验用第3~8代细胞。
1.4AGEs制备参照文献方法[7],将 BSA(5 g·L-1)与d-葡萄糖(50 mmol·L-1)溶于PBS液(内含0.5 mmol·L-1EDTA,pH 7.4)中,充分混匀,无菌过滤,置于37℃培养箱避光孵育3个月后,用透析膜充分透析以去除未结合的d-葡萄糖,0.22 μm滤膜过滤除菌后4℃存放,临用时稀释。
1.5西红花酸对内皮细胞通透性的影响根据文献方法略加改进用HRP作示踪剂检测内皮细胞单层通透性变化[8-9]。实验分为6组,即正常对照组(control)、AGEs模型组(100 mg·L-1)、葛根素阳性对照组(1 g·L-1)、西红花酸(0.01、0.1、1 μmol·L-1)组,每组8个复孔,实验重复2次。将内皮细胞接种在双层通透的培养皿(transwell,0.4 μm)的小室中,细胞接种密度为3×105/孔,内皮细胞融合成单层时,换成无血清的DMEM培养基,加不同浓度西红花酸预孵12 h后,去除培养基,用Hank’s液洗涤2遍,再加入DMEM培养液,AGEs组和药物实验组分别加入100 mg·L-1AGEs刺激,正常对照组用100 mg·L-1BAS刺激。与内皮细胞共同培养,在不同时间取下室液60 μl与HRP显色缓冲液860 μl混合,室温暗处反应 15 min,加入 H2SO43 mol·L-1终止反应,用酶标仪在波长470 nm处测量HRP吸光度以表示内皮细胞单层通透性的变化。
1.6西红花酸对AGEs诱导内皮细胞分泌MCP-1和TNF-α的影响选用生长良好的内皮细胞悬液,调整细胞浓度为1×108·L-1,接种于96孔板中。实验分组同“1.5”,不同剂量西红花酸预孵12 h,用AGEs(100 mg·L-1)刺激一定时间,取细胞上清,用ELISA试剂盒测定MCP-1和TNF-α含量,每组8个复孔。
1.7西红花酸对AGEs诱导内皮细胞后细胞骨架蛋白(F-actin)表达变化参考文献方法进行[18]。将培养好的内皮细胞,调整浓度为1×108·L-1,加入6孔板中(含经多聚赖氨酸处理过的细胞盖片)待细胞贴壁后,去除培养基,加入含0.5%血清培养基使细胞同步化。实验分组同“1.5”。不同剂量西红花酸预孵12 h,用AGEs(100 mg·L-1)刺激一定时间后,小心取出盖片,冷PBS轻洗3遍,冷丙酮固定 15 min,0.1%TritonX-100于 4℃ 处理15min,,罗丹明-鬼笔环肽(100 nmol·L-1)室温孵育1 h,冷PBS轻洗3遍,于荧光倒置显微镜下,进行红色荧光检测。
1.8西红花酸对AGEs诱导内皮细胞中磷酸化p38MAPK表达及活性变化参考文献方法略加改进[10-11]。选用生长良好的内皮细胞悬液(1×108·L-1),接种于96孔培养板,培养至融合状态,不同浓度的西红花酸预孵12 h,再换无血清DMEM培养液,AGEs模型组和药物实验组分别加入100 mg·L-1AGEs,正常对照组用100 mg·L-1BAS刺激,作用一定时间,用Cell-based ELISA法测定磷酸化p38MAPK蛋白表达。同法将作用好的细胞裂解后,取1 ml细胞裂解液与5 μg特异性p-p38 MAPK抗体于4℃共同孵育1 h,加入20 μl Protein A-Agrose于4℃摇床孵育过夜,4 000 r·min-14℃离心5 min,小心弃上清后,加入1 ml PBS洗涤,4 000 r·min-14℃离心5 min,共4次。弃上清,沉淀下的蛋白加入激酶缓冲(含1 g·L-1MBP及2.96×1011Bq32P-ATP)25 μl,在25 ℃孵育25 min ,取25 μl点于磷酸纤维素滤纸上,室温5 min,0.5%磷酸缓冲液终止反应后,用PBS彻底冲洗,红外线烤干,加入2 ml闪烁液过夜后,采用髓磷脂碱性蛋白(MBP)作为p-p38 MAPK反应底物,液体闪烁仪上测定髓磷酸脂碱性蛋白32P的参入量。
1.9统计学处理数据均以±s表示,用SPSS 10.0软件进行统计分析,统计方法采用单因素方差分析,组间均数比较采用F检验。
2 结果
2.1西红花酸对AGEs诱导内皮细胞通透性的影响由Fig 1可见,100 mg·L-1AGEs刺激内皮细胞后,其通透性随时间的延长而逐渐增加,作用12 h时,AGEs模型组的通透性与对照组差异有显著性(P<0.01)。而用西红花酸预孵后,内皮细胞通透性虽然与正常对照组相比也有升高,但与AGEs模型组相比,通透性有一定下降(P<0.01或0.05),说明西红花酸有保护内皮细胞的作用。
2.2西红花酸对AGEs诱导内皮细胞分泌MCP-1和TNF-α的影响Tab 1可见,AGEs(100 mg·L-1)刺激内皮细胞12 h后,细胞分泌的炎症因子MCP-1和TNF-α水平较正常对照组上升了3倍左右(P<0.01),不同剂量西红花酸(0.01、0.1、1 μmol·L-1)预孵后,内皮细胞 MCP-1和 TNF-α分泌水平有明显下降(P<0.05 or 0.01vsAGEs组),提示西红花酸可抑制AGEs诱导内皮细胞的炎症反应,葛根素也可降低MCP-1和TNF-α水平。
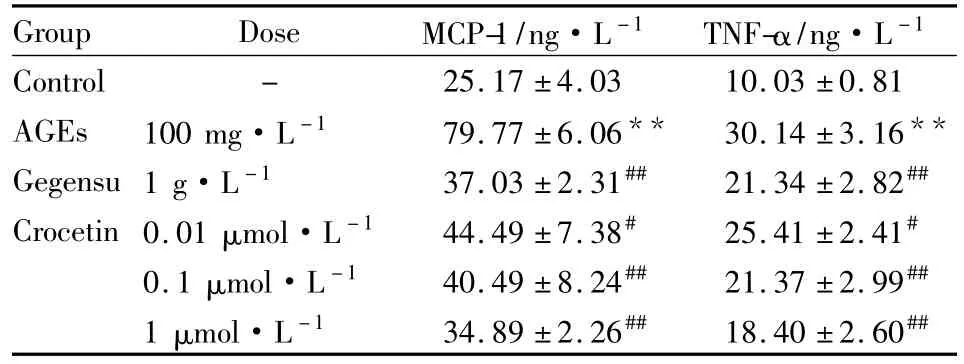
Tab 1 Effect of crocetin on level of MCP-1 and TNF-α in endothelial cells induced by AGEs(n=8)

Fig 1 Effect of crocetin on the hypermeability of endothelial cells induced by AGEs(n=8)

Fig 2 Effect of crocetin on morphological changes of F-actin in endothelial cells induced by AGEs
2.3西红花酸对AGEs诱导内皮细胞后细胞骨架蛋白F-actin表达变化F-actin是内皮细胞的主要骨架蛋白之一,主要分布在细胞周边,呈完整的线条,胞质中未见密集的F-actin纤维,显示出内皮细胞典型的鹅卵石样的轮廓,细胞间缝隙连接较紧密,说明正常状态时内皮细胞通透性较低;100 mg·L-1AGEs刺激12 h后,部分细胞外周边缘出现断裂,溶解,边界不清晰,有丝状样;而西红花酸(0.1、1 μmol·L-1)预孵后,虽然细胞膜外周边缘也呈现锯齿样变化,但较模型组有明显改善。提示西红花酸能抑制AGEs破坏内皮细胞骨架蛋白的作用,从而抑制内皮细胞通透性升高。
2.4西红花酸对AGEs诱导内皮细胞中pp38MAPK表达变化100 mg·L-1AGEs与内皮细胞孵育 5、15、30、60、120 min,ELISA 法测定磷酸化p38 MAPK表达。结果显示:随时间延长,磷酸化p38 MAPK量增多,30 min时,达到其峰值(P<0.01),是基础水平的近3左右倍,随后,其表达量迅速下降。该结果表明,AGEs诱导p38 MAPK磷酸化作用是随时间变化的(Fig 3A)。AGEs与内皮细胞共同培养30 min,使p38-MAPK激酶磷酸化的数量是对照组的约3倍左右。西红花酸(0.01、0.1、1μmol·L-1)与内皮细胞预孵12 h,可剂量依赖性降低AGEs刺激的p38 MAPK磷酸化增高作用,分别是AGEs组的87%、71%、66%。结果提示,西红花酸可抑制p38 MAPK的磷酸化作用(Fig 3B)。
2.5西红花酸对AGEs诱导内皮细胞后pp38MAPK活性的影响100 mg·L-1AGEs与内皮细胞共同培养30 min,磷酸化p38MAPK活性是对照组的约2.5倍。西红花酸(0.1、1 μmol·L-1)与内皮细胞预孵12 h,可降低 AGEs刺激的 p-p38 MAPK活性,分别是对照组的1.4和1.9倍左右(P<0.01或P<0.05),结果进一步证明,西红花酸具有抑制p38 MAPK的磷酸化作用(Fig 4)。
3 讨论
血管内皮细胞构成了组织与血液间的第一道屏障,它能直接感受血管内环境的改变,并做出相应的反应。内皮细胞功能紊乱是糖尿病血管病变的基础和关键环节[1,12]。正常的血管内皮细胞,周边清楚,细胞间连接紧密,F-actin是内皮细胞的主要骨架蛋白,分布在细胞周边,呈完整的线条和有序排列,该形态是维持血管内壁正常通透性的基础。本研究发现:AGEs可使细胞骨架蛋白F-actin失去正常的网状有序排列,并随着 AGEs刺激时间延长,内皮细胞通透性升高。用西红花酸预孵育后,内皮细胞损伤减轻,单层通透性减小,提示西红花酸具有抑制内皮细胞通透性增高的作用,这是西红花酸抗DM血管病变的可能机制之一。
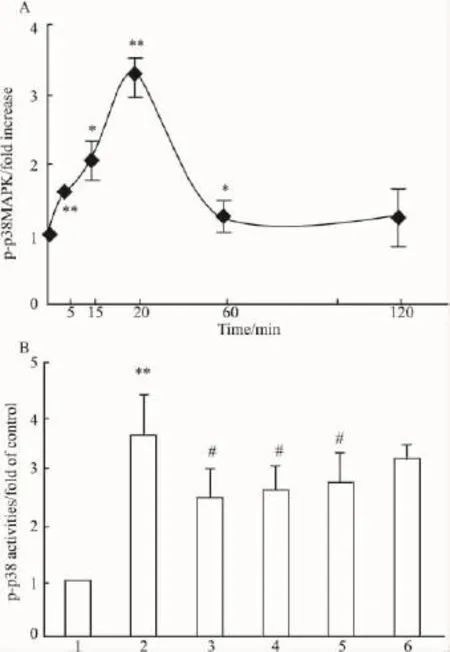
Fig 3 Cell-based ELISA for activation of p-p38MAPK
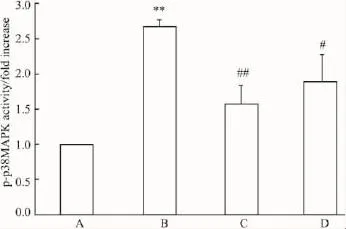
Fig 4 Effect of crocetin on p-p38MAPK in endothelial cells induced by AGEs(n=4)
AGEs是体内蛋白质和糖的醛基在体内发生非酶促反应形成的不可逆的终末产物,它是DM患者加速发生血管病变的主要原因[12-13]。我们前期研究发现糖尿病大鼠在肠系膜血管中的AGEs沉积增多[4],且显示血管通透性增高。因此,在AGEs的慢性沉积和血管通透性升高之间可能存在某种联系。有文献报道AGEs刺激内皮细胞后,F-actin纤维形态和分布发生明显的改变,内皮细胞收缩[3,14]。本研究发现,在AGEs作用下,在骨架蛋白重新分布排列的同时,伴随内皮细胞分泌炎症因子TNF-α和MCP-1增加,已知炎症因子TNF-α等还可通过抑制eNOS酶活性降低NO生物利用度,使内皮细胞舒张功能受到损伤[15]。因此,我们推测:西红花酸通过抑制TNF-α和MCP-1的分泌,抑制F-actin的破坏,干扰炎症因子的分泌与内皮细胞通透性增高之间恶性循环的过程,从而产生保护血管的作用。
丝裂原激活蛋白激酶p38 MAPK是由Han等[16]用高渗和内毒素刺激哺乳动物细胞从中分离纯化出的一种38 ku的酪氨酸磷酸化蛋白激酶,其定位于细胞质与细胞核。p38 MAPK通路可能参与了内皮细胞通透性的调节,据报道,p38MAPK磷酸化激活可促进血管内皮通透性的增加,活化的p38 MAPK作用于底物MAPK激活的蛋白激酶MK2,后者则使热休克蛋白-27(HSP-27)发生磷酸化作用。HSP-27是肌动蛋白结合蛋白,可抑制F-actin的聚合,磷酸化后的HSP-27失去了抑制作用,致使F-actin聚合形成应力纤维,内皮细胞收缩,血管通透性增加[17]。本研究发现:AGEs刺激血管内皮细胞中p38 MAPK的磷酸化作用与AGEs的刺激时间具有明显的依赖性,在AGEs刺激5 min后,细胞内磷酸化的p38 MAPK即有增加,在30 min时达到高峰,之后明显下降。表明内皮细胞中p38 MAPK的激活是一个较短暂的过程,p38 MAPK所引起的较长期生物学效应可能有赖于其所激活的下游信号分子的作用,其中包括转录因子的作用。我们又用BMP为底物,测定了磷酸化p38 MAPK激酶的活性,结果表明,内皮细胞经AGEs刺激后,磷酸化p38 MAPK活性升高。因此可以认为AGEs可使p38 MAPK磷酸化作用增强。用西红花酸预孵内皮细胞12 h后,磷酸化p38 MAPK表达下降,同时其活性也随之下降,说明西红花酸可以抑制p38 MAPK磷酸化,减轻由此所致的血管内皮细胞通透性增高,最终抑制了DM血管病变的产生和发展。
综上所述,西红花酸可能通过抑制p38 MAPK磷酸化作用,在减少炎症因子分泌同时,抑制了AGEs诱导的细胞骨架蛋白的纤维形态和分布发生过程,从而抑制了AGEs促通透性增高的作用,这是西红花酸抗DM血管病变的作用可能机制之一。但是,虽然西红花酸具有较强的抗氧化作用,显然它不是特异性p38 MAPK的抑制剂,但它又具有抑制p38 MAPK激活作用。我们推测:可能是由于西红花酸清除了ROS,随之解除了ROS激活p38 MAPK的作用,有关这方面的机制还需进一步研究。
[1]Potenza M A,Gagliardi S,Nacci C,et al.Endothelial dysfunction in diabetes:from mechanisms to therapeutic targets[J].Curr Med Chem,2009,16(1):94-112.
[2]陈 敏,蒋丽萍,洪 涛.缝隙连接蛋白在动脉粥样硬化形成和防治中的作用[J].中国药理学通报,2010,26(10):1271-4.
[2]Chen M,Jiang L P,Hong T.Connexin in formation and prevention of atherosclerosis[J].Chin Pharmacol Bull,2010,26(10):1271-4.
[3]郭晓华,黄巧冰,陈 波,等.晚期糖化终产物诱导内皮细胞通透性增高[J].生理学报,2005,57(2):205-10.
[3]Guo X H,Huang Q B,Chen B,et al.Mechanism of advanced glycation end products-induced hyperpermeability in endothelial cells[J].Acta physiol Sin,2005,57(2):205-10.
[4]向 敏,钱之玉,周成华.西红花酸对糖尿病大鼠体内晚期糖基化终产物的形成及其受体表达的影响[J].中国临床药理学与治疗学,2006,11(4):448-52.
[4]Xiang M,Qian Z Y,Zhou C H.Crocetin reduces expression of receptor for advanced glycation end products(RAGE)on endothelial cells induced by AGE[J].Chin J Clin Pharmacol Ther,2006,11(4):448-52.
[5]Xiang M,Qian Z Y,Zhou C H,et al.Crocetin inhibits leukocyte adherence to vascular endothelial cells induced by AGEs[J].J Ethnopharmacol,2006,107(1):25-31.
[6]Xiang M,Yang M,Zhou C,et al.Crocetin prevents AGEs-induced vascular endothelial cell apoptosis[J].Pharmacol Res,2006,54(4):268-74.
[7]向 敏,周成华,钱之玉.西红花酸对晚期糖基化终产物诱导牛血管内皮细胞E-选择素表达的抑制作用[J].中国临床药理学与治疗学,2010,15(7):764-9.
[7]Xiang M,Zhou C H,Qian Z Y.Inhibitory action of crocetin on the expression of E-selectin in bovine endothelial cells induced by advanced glycation end products[J].Chin J Clin Pharmacol T-her,2010,15(7):764-9.
[8]韩雅玲,张效林,康 建,等.核因子κB及Toll样受体介导脂多糖诱导内皮细胞单层通透性增高[J].中国临床康复,2004,8(6):1063-5.
[8]Han Y L,Zhang X L,Kang J,et al.Effect of nuclear factor-kappa B and toll-like receptor 4 mediate on the increase of monolayer permeability of endothelial cell induced by lipopolysaccharide[J].Chin J Clin Rehab,2004,8(6):1063-5.
[9]Wojciak-Stothard B,Potempa S,Eichholtz T,Ridley A J.Rho and Rac but not Cdc42 regulate endothelial cell permeability[J].J Cell Sci,2001,114(Pt 7):1343-55.
[10]安赤颖,李艳波.辛伐他汀对人脐静脉内皮细胞中p38MAPK表达的影响[J].哈尔滨医科大学学报,2005,39(2):160-2.
[10]An C Y,Li Y B.Effect of Simvastatin on the protein expression of p38MAPK in HUVEC[J].J Harbin Med Univer,2005,39(2):160-2.
[11]林剑国,刘云海,程晓红,等.板蓝根抑制脂多糖诱导的p38蛋白激酶活性研究[J].中华微生物学和免疫学杂志,2003,23(9):739-41.
[11]Lin J G,Liu Y H,Cheng X H,et al.Study on inhibitory effect of Radix-isatidis on endotoxin p38MAPK activity[J].Chin J Microbiol Immunol,2003,23(9):739-41.
[12]Esper R J,Vilariño J O,Machado R A,et al.Endothelial dysfunction in normal and abnormal glucose metabolism[J].Adv Cardiol,2008,45(1):17-43.
[13]Ahmed N.Advanced glycation endproducts-role in pathology of diabetic complications[J].Diab Res Clin Practice,2005,67(1):3-21.
[14]张 策,黄巧冰,赵克森,等.晚期糖基化终产物刺激下人脐静脉内皮细胞中F-actin的形态和分布变化[J].中华老年多器官疾病杂志,2004,3(1):41-4.
[14]Zhang C,Huang Q B,Zhao K S,et al.Morphological and distributional changes of filamentous actin in human umbilical vein endothelial cells under stimulation of advanced glycosylation end products[J].Chin J Multipl Organ Dis Elderly,2004,3(1):41-4.
[15]Zhang H,Park Y,Wu J,et al.Role of TNF-alpha in vascular dysfunction[J].Clin Sci(Lond),2009,116(3):219-30.
[16]Han J,Lee J D,Bibbs L,et al.A MAP kinase targed by endotoxin and hyperomolarity in mammalian cell[J].Science,1994,265(5173):808-11.
[17]Kayyall U S,Pennella C M,Trujillo C,et al.Cytoskeletal changes in hypoxic pulmonary endothelial cells are dependant on MAPK activated protein kinase MK2[J].J Biological Chem,2002,277(45):42596-602.
[18]杜 宇,何 庆.红霉素改善百草枯致损血管内皮细胞屏障功能的分子机制[J].四川大学学报(医学版),2009,40(6):1044-8.
[18]Du Y,He Q.Molecular mechanism of erythromycin in the improvement of paraquat damaged vascular endothelial cell barrier function[J].J Sichuan Univ(Med Sci Ed),2009,40(6):1044-8.
