外周组织损伤对脊髓AMPA受体突触表达的影响及其机制
2011-05-29刘燕妮索占伟许英明杨鸿斌胡晓东
刘燕妮,索占伟,杨 娴,时 蕾,曹 静,李 帅,许英明,杨鸿斌,胡晓东
(兰州大学药学院分子药理研究所,甘肃兰州 730000)
AMPA(α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid)型谷氨酸受体介导神经系统中绝大部分的快反应兴奋性突触传递。在脊髓背角,生理性痛刺激通过初级传入纤维,向脊髓释放谷氨酸,激活突触后AMPA受体,促进痛觉信息向更高级的中枢传递。而当外周组织或神经损伤之后,脊髓AMPA受体的功能会明显升高,AMPA受体介导的兴奋性突触传递发生持久性的可塑性变化,最终导致慢性病理性疼痛的形成。
资料显示:AMPA受体的功能异常,与AMPA受体在突触中的表达数目、以及AMPA受体的亚基构成(subunit composition)密切相关[1]。在成年动物,脊髓背角AMPA受体主要是由GluR1、GluR2、GluR3亚基组合形成的四聚体,其中最常见的受体由2个GluR2和2个 GluR1、或者是2个 GluR2和2个GluR3所组成。GluR2作为构成AMPA受体的关键组分,不仅能够通过细胞内的突触输送(synaptic trafficking)过程,调节AMPA受体的突触含量,而且决定着AMPA受体的一系列生理生化特征,如AMPA受体的钙通透性、内向整流特性等。已有研究提示:GluR2可能参与慢性炎性疼痛过程[2]。但外周组织损伤是否直接调节脊髓GluR2的突触表达而促进中枢敏感化的形成,至今尚不清楚。
为探讨AMPA受体在突触中的表达变化与炎性疼痛形成的关系,本研究建立完全弗氏佐剂(CFA)炎性疼痛模型,观察GluR2亚基在脊髓突触中的变化,并分析慢性炎性疼痛中的一个关键激酶——cAMP 依赖性蛋白激酶(PKA)[3]在此过程中的可能作用。
1 材料与方法
1.1动物昆明种成年小鼠(♂,20~22g),由兰州大学实验动物中心提供。
1.2试剂完全弗氏佐剂(complete Freund’s adjuvant,CFA;Sigma);PKA抑制剂H-89(Sigma);鼠抗GluR2抗体(Millipore Corporation,Temecula,CA,USA),鼠抗β-actin抗体(江苏碧云天);辣根过氧化物(HRP)标记二抗(Jackson Immunoresearch Laboratories,Baltimore,PA,USA);ECL发光试剂盒(江苏碧云天)。
1.3疼痛模型制备[4]小鼠经乙醚浅麻醉后,后足底二、三趾之间的皮下推入CFA 25 μl,对照组在相同部位注射等容量的生理盐水。造模前、后进行行为学测试。
1.4行为学测试及鞘内给药[5]采用Up-Down法测定 Von Frey纤维 (Stoelting,Wood Dale,IL,USA)诱发的缩足阈值(PWT)。鞘内给药采用经皮直接注射法,动物经乙醚浅麻醉后,用25 μl的微量进样器于L5-L6棘突间隙经皮穿刺,以进针产生空洞感并伴随动物甩尾,作为针头进入蛛网膜下腔的标志,缓慢注射药物5 μl,对照组注射同等体积的生理盐水。
1.5亚细胞结构分离根据我们前期报道的方法[5],动物经苯巴比妥钠 (30 mg·kg-1)腹腔注射麻醉后,行锥板切开术,分离L4-L5节段脊髓。在4℃细胞裂解缓冲液中制备匀浆。匀浆液经1 000×g离心10 min,取上清(S1);S1经10 000×g离心15 min,收集富含突触小体 (synaptosome)的沉淀P2;P2用含0.5%Triton X-100的细胞缓冲液裂解15 min后,32 000×g离心20 min,得到富含突触后致密质(PSD)的沉淀P3。以上操作均在4℃下进行。P3经重新悬浮后,加入4×样品缓冲液,煮沸5 min,进行Western blot检测。
1.6免疫印迹用8%SDS-PAGE电泳分离蛋白;转移到PVDF膜上;经5%脱脂奶粉室温封闭30 min后,以相应蛋白的抗体4℃孵育过夜;印迹膜经洗涤后,用HRP标记的二抗室温孵育1 h,以ECL发光试剂盒显像;以Image J软件进行图像分析。
1.7数据统计数据均以±s表示;采用One-way ANOVA、post-hoc Tukey HSD进行显著性检验。
2 结果
2.1CFA对小鼠缩足阈值的影响及其与PKA的关系行为学结果显示:注射CFA后24 h,小鼠的缩足阈值低于生理盐水对照组,提示机械性痛觉超敏的形成;此时,鞘内注射PKA抑制剂H-89,则明显提高炎性疼痛小鼠的缩足阈值,且其作用至少持续30 min(Fig 1),提示PKA在炎性疼痛中的重要作用。

Fig 1 Effect of CFA on PWT of mice and its relation with PKA
2.2CFA对脊髓背角AMPA受体GluR2亚基突触表达的影响及其与PKA的关系为探讨AMPA受体在痛觉超敏中的作用,本试验在注射CFA后24 h,分离脊髓背角,提取富含PSD的亚细胞结构,检测AMPA受体GluR2亚基的突触表达,发现炎性疼痛组动物的GluR2突触含量升高,与生理盐水对照组相比,差异有显著性(Fig 2)。而在注射CFA后24 h,鞘内给予PKA抑制剂H-89处理脊髓30 min,发现H-89能降低GluR2的突触含量(Fig 2),和CFA组动物相比较,差异有显著性。与炎性疼痛动物不同,正常小鼠鞘内注射H-89后30 min,动物的缩足阈值无变化(salinevsH-89:1.82±0.24 gvs1.72±0.15 g,P>0.05,n=4);随后的免疫印迹实验也显示:H-89对正常小鼠GluR2的突触含量无影响(Fig 3)。这些实验结果提示:外周组织损伤,可能通过激活脊髓背角PKA,提高AMPA受体GluR2亚基的突触表达,从而参与痛觉超敏的形成。
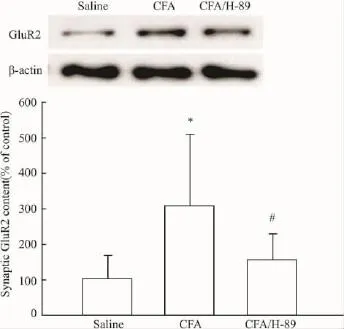
Fig 2 Effect of CFA on synaptic content of GluR2 subunits and its relation with PKA.
3 讨论
AMPA受体介导痛觉信息从外周向中枢的传递,并在病理性疼痛的形成中发挥重要作用。抑制AMPA受体的活性,能够明显缓解外周组织或神经损伤诱发的痛觉超敏,而直接激动脊髓AMPA受体甚至在正常动物中也能诱发痛觉异常[6]。近年来大量的研究证实:突触后膜上AMPA受体的数目高度可变,这种动态变化是突触传递效率发生长时程改变的重要机制,并在学习、记忆以及许多神经系统疾病中扮演关键角色。然而,对于AMPA受体在慢性炎性疼痛中的突触表达变化,至目前为止尚存在很大争议。曾经有实验通过间接地检测胞质内AMPA受体的含量[2],发现外周组织损伤可能调节脊髓背角GluR2亚基的内陷过程,影响AMPA受体的突触表达。而本实验直接提取富含突触后致密质(PSD)的亚细胞结构,测定炎性疼痛过程中GluR2的突触含量,发现CFA在诱发痛觉超敏的同时,能够明显提高脊髓GluR2的突触数目,说明痛觉超敏的形成与GluR2的突触聚集密切相关。GluR2亚基的突触表达增多,可能易化AMPA受体介导的痛觉信息的突触传递,从而导致慢性疼痛的形成。
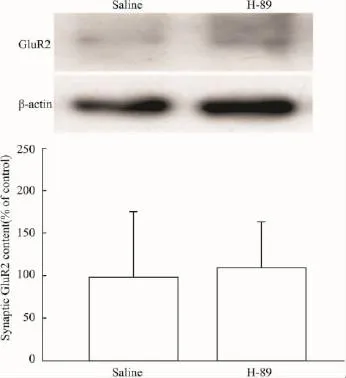
Fig 3 Intrathecal application of PKA inhibitor H-89(2.5 μg)for 30 min generated minimal effects on the synaptic contents of GluR2 subunits in spinal dorsal horn of intact mice.
大量的实验显示:AMPA受体的突触输送过程,受到PKA、PKC(蛋白激酶C)等丝氨酸/苏氨酸激酶、以及蛋白酪氨酸激酶(PTKs)的调控。在AMPA受体的GluR1亚基中,包含有PKC和PKA的磷酸化位点(分别为第831位丝氨酸和第845位丝氨酸),PKC/PKA对GluR1的催化磷酸化,能够提高GluR1在细胞膜表面及突触中的表达,增强兴奋性谷氨酸能突触传递[7-8]。而在GluR2亚基的胞质C-末端,则包含有多个酪氨酸的磷酸化位点;Src家族酪氨酸激酶(SFKs)对GluR2的磷酸化,能够调节GluR2与PDZ蛋白(如PICK1、GRIP1/2等)的结合,影响GluR2的内陷过程,从而调节GluR2的突触表达水平[9]。本文研究结果显示:抑制PKA的活性,能够明显拮抗组织损伤诱发的GluR2亚基的突触异常表达,且这一过程与炎性疼痛的缓解密切相关,提示脊髓PKA可能是促进GluR2向突触聚集的关键分子。而且我们的前期研究也显示:PKA能够激活脊髓背角Src家族酪氨酸激酶成员Fyn,参与脊髓背角痛觉信息的整合与调制[10]。因此,我们推测:PKA对GluR2突触表达的调节,可能与Src家族酪氨酸激酶有关。但其具体的机制尚有待于进一步的深入研究。
[1]Newpher T M,Ehlers M D.Glutamate receptor dynamics in dendritic microdomains[J].Neuron,2008,58(4):472-97.
[2]Park J S,Voitenko N,Petralia R S,et al.Persistent inflammation induces GluR2 internalization via NMDA receptor-triggered PKC activation in dorsal horn neurons[J].J Neurosci,2009,29(10):3206-19.
[3]Malmberg A B,Brandon E P,Idzerda R L,et al.Diminished inflammation and nociceptive pain with preservation of neuropathic pain in mice with a targeted mutation of the type I regulatory subunit of cAMP-dependent protein kinase[J].J Neurosci,1997,17(19):7462-70.
[4]杨鸿斌,杨 娴,曹 静,等.SHP2抑制剂NSC-87877对炎性疼痛的抑制作用及其机制[J].中国药理学通报,2010,21(5):981-4.
[4]Yang H B,Yang X,Cao J,et al.Inhibitory effects of SHP2 blocker NSC-87877 on inflammatory pain and its underlying mechanisms[J].Chin Pharmacol Bull,2010,26(9):1142-5.
[5]索占伟,杨 娴,曹 静,等.脊髓背角PKC在慢性炎性疼痛中的作用及其机制[J].中国药理学通报,2011,27(3):421-4.
[5]Suo Z W,Yang X,Cao J,et al.Involvement of spinal PKC in inflammatory pain and its underlying mechanisms[J].Chin Pharmacol Bull,2011,27(3):421-4.
[6]Minami T,Matsumura S,Okuda A E,et al.Characterization of the glutamatergic system for induction and maintenance of allodynia[J].Brain Res,2001,895(1-2):178-85.
[7]Fang L,Wu J,Zhang X,et al.Increased phosphorylation of the GluR1 subunit of spinal cord alpha-amino-3-hydroxy-5-methyl-4-isoxazole propionate receptor in rats following intradermal injection of capsaicin[J].Neuroscience,2003,122(1):237-45.
[8]Lu Y,Sun Y N,Wu X,et al.Role of alpha-amino-3-hydroxy-5-methyl-4-isoxazolepropionate(AMPA)receptor subunit GluR1 in spinal dorsal horn in inflammatory nociception and neuropathic nociception in rat[J].Brain Res,2008,1200:19-26.
[9]Zhang Y,Venkitaramani D V,Gladding C M,et al.The tyrosine phosphatase STEP mediates AMPA receptor endocytosis after metabotropic glutamate receptor stimulation [J].J Neurosci,2008,28(42):10561-6.
[10]Yang H B,Yang X,Cao J,et al.cAMP-dependent protein kinase activated Fyn in spinal dorsal horn to regulate NMDA receptor function during inflammatory pain[J].J Neurochem,2011,116(1):93-104.
