人肺腺癌细胞株A549中HIF-1α对survivin的表达调控
2011-05-28李伟陈余清孙艳赵成岭王效静
李伟 陈余清 孙艳 赵成岭 王效静
蚌埠医学院第一附属医院呼吸科,安徽省呼吸系病基础与临床省级重点实验室,安徽 蚌埠 233003
人肺腺癌细胞株A549中HIF-1α对survivin的表达调控
李伟 陈余清 孙艳 赵成岭 王效静
蚌埠医学院第一附属医院呼吸科,安徽省呼吸系病基础与临床省级重点实验室,安徽 蚌埠 233003
背景与目的:survivin是一种重要的抗凋亡基因,在肿瘤组织中特异性高表达,并参与调控细胞周期和细胞凋亡,其高表达与肿瘤进展、药物抵抗以及预后关系密切。但survivin在肺癌中高表达的转录调控机制研究甚少。课题组前期研究成功构建含有survivin核心启动子的荧光报告载体pGL3-SVP230-luc,并发现核心启动子区存在缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)的潜在位点。本研究拟通过免疫荧光双标记法、电泳迁移率实验(EMSA)、共转染等方法探讨缺氧条件下人肺腺癌细胞株A549中HIF-1α调控survivin转录的确切机制。方法:⑴运用免疫荧光双标记检测缺氧A549细胞中HIF-1α与survivin的表达;⑵HIF-1α表达质粒和HIF-1αsiRNA分别转染A549细胞,30 h后RT-PCR、Western blot和免疫荧光双标法检测survivin mRNA和蛋白表达;⑶pGL3-SVP230-luc(含有survivin核心启动子的荧光报告载体)与HIF-1α表达质粒和HIF-1α siRNA分别共转染A549细胞,测定萤光素酶的表达活性;⑷EMSA分析HIF-1α与survivin核心启动子结合情况;(5)流式细胞术和MTT法检测细胞凋亡和增殖。结果:⑴HIF-1α与survivin共表达于A549细胞中;⑵转染HIF-1α表达质粒组survivinmRNA和蛋白表达水平显著上调,转染HIF-1α siRNA组survivin mRNA和蛋白表达显著降低(P<0.01);⑶HIF-1α表达质粒组pGL3-SVP230-luc相对活性分别为78.84,显著高于空质粒组及对照组(P<0.01),HIF-1αsiRNA组pGL3-SVP230-luc相对活性分别为28.84,显著低于空质粒组及对照组(P均<0.01);⑷HIF-1α与survivin核心启动子区转录起始点上游-19~-16 bp序列结合转录激活survivin;⑸流式细胞术和MTT检测结果显示,HIF-1α siRNA组细胞凋亡显著增加,细胞抑制率明显升高,与对照组相比差异具有统计学意义(P均<0.01)。结论:缺氧状态下A549细胞中survivin与HIF-1α存在共表达;HIF-1α可以通过survivin核心启动子区的结合位点激活survivin转录和表达;靶向HIF-1α可以诱导细胞凋亡、抑制细胞增殖,并为survivin的靶向治疗研究提供了进一步的实验基础。
缺氧诱导因子-1α;survivin; 转录调节; 非小细胞肺癌
癌基因的激活和(或)抑癌基因失活导致细胞的增殖异常和凋亡障碍可能是肺癌发生、发展的关键。survivin基因是凋亡抑制蛋白(inhibitor of apoptosis proteins,IAPs)基因家族的关键成员,是迄今为止作用最强的凋亡抑制因子,高表达于多数恶性肿瘤组织中[1],其在肺癌的表达率达70.7%~96.0%[2-3],survivin高表达与肿瘤的恶性程度、药物抵抗以及患者预后关系密切[1]。涉及survivin在肺癌中高表达的转录调控机制研究甚少。缺氧是实体瘤中普遍存在现象,不仅会导致肿瘤细胞对放化疗抵抗,而且使肿瘤细胞更具侵袭性,其中缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)起关键作用,其在多种肿瘤中高表达[4]。转染反义HIF-1α至胰腺癌细胞株BxPc-3后,HIF-1α和survivin的表达均下调,提示HIF-1α可能调控survivin表达[5]。Chen等[6]前期的研究证实,缺氧可诱发肺腺癌细胞株A549中survivin启动子活性增强。survivin核心启动子区转录起始点上游-19~-16 bp和-144~-127 bp处存在HIF-1α潜在结合位点。构建-19~-16 bp碱基序列突变的萤光素酶报告基因载体pGL3-SVP229-luc,转染A549细胞,启动子活性下降36.6%。表明上述位点在正调控survivin表达中起重要作用。本研究将用RTPCR、共转染等方法确证HIF-1α对survivin的表达调控作用,并结合电泳迁移实验(EMSA)结果探讨HIF-1α调控survivin转录的确切机制。
1 材料和方法
1.1 细胞和试剂
人肺腺癌A549细胞由本实验室保存。pGL3-SVP-230-luc也由本实验室前期构建并保存[6]。HIF-1α的真核表达质粒由美国伊利诺斯州立大学钱峰博士后惠赠。EMSA、萤光素酶报告基因检测试剂盒购自Promega公司。PCR引物、survivin探针由上海生物工程有限公司合成。r-32P[ATP]购自北京市福瑞生物工程公司。鼠抗人HIF-1α单克隆抗体购自SantaCruz公司,兔抗人survivin单克隆抗体、DyLightTM488标记山羊抗鼠IgG以及DyLightTM594标记羊抗兔IgG均购自北京中山生物技术公司。
1.2 方法
1.2.1 细胞培养和缺氧处理
将本实验室保存A549细胞复苏后并接种于含10%灭活小牛血清新鲜DMEM培养基液中,CO2体积分数为5%,37 ℃条件下常规培养。A549细胞株用COCl2150 μmol/mL处理,模拟肿瘤内部缺氧微环境,置于常规培养箱培养24 h后收获细胞用于后续实验。
1.2.2 激光共聚焦检测A549细胞中HIF-1α和survivin蛋白的表达
双标免疫荧光法检测参照Bemardini等[7]介绍的方法进行。4%甲醛固定,PBS液反复漂洗,加入1%BSA稀释的survivin兔抗人单抗和HIF-1α鼠抗人单抗(按1∶1混匀),4 ℃温育过夜;PBS充分漂洗后加DyLightTM488标记羊抗鼠IgG(1∶30)、DyLightTM594(1∶40)标记羊抗兔IgG,滴加到切片上,甘油封片。利用激光共聚焦显微镜观察并摄像。
1.2.3 HIF-1α表达质粒和HIF-1α siRNA分别转染A549细胞,检测survivin表达
1.2.3.1 质粒的制备和纯化
制备JM109感受态细菌。50 μL感受态细胞悬液和1 μL pcDNA3.0-HIF-1α或者pGL3-SVP-230-luc振动、混匀,加入1 mL无氨苄的液体培养基,培养液均匀涂至LB/氨苄平板上,37 ℃培养16 h。用Takara Minibest Plasmid Purification kit2.0说明制备和纯化质粒。在质粒表达载体平板划菌后,挑取白色单克隆菌落,在含氨苄青LB液体培养基37 ℃过夜震荡培养后提取质粒,1%琼脂糖电泳证实质粒片段大小,并送少许菌液经上海生工测序部测序鉴定。
1.2.3.2 HIF-1α siRNA的设计、合成
按本实验既往证实针对H I F-1 α基因(NM001530)1 521~1 541碱基的有效siRNA序列设计[6],由上海生物工程有限公司合成。序列如下:正义链 5’-CUGAUGAC CAGCAACUUGAdTdT-3’, 反义 链5’-UCAAGUUGCUGGUCAUCAGdTdT-3’;同时合成荧光标记的阴性对照control siRNA:正义链5’-AGUUCAACGACCAGUAGUCdTdT-3’,反义链5’-GACUACUGGUCGUUGAdTdT-3’。根据预实验确定最佳转染浓度为5O nmol/L。将荧光标记的control siRNA和HIF-1α siRNA分别按50 nmol/L的终浓度转染A549细胞,转染后12、18和24 h用荧光显微镜观察荧光阳性细胞,检测转染效率。同时RT-PCR检测HIF-1α mRNA表达证实干扰效果。
1.2.3.3 细胞转染
106个A549细胞接种于6孔细胞培养板中,细胞融合达到70%~90%时进行转染;设立以下5组:pcDNA3.0-HIF-1α组、HIF-1α siRNA组、pcDNA3.0组、control siRNA组和control组(空白对照组)。转染程序按照LipofectamineTM2000说明书进行。工作质粒与内参质粒 pRL-TK按等摩尔浓度共转染A549。质粒的用量为每孔2 μg,内参质粒用量为每孔0.2 μg,siRNA转染浓度见上,LipofectamineTM2000用量为每孔10 μL。实验重复3次(下同)。
1.2.3.4 RT-PCR法检测survivin mRNA表达
转染3 0 h收集各组细胞,提取总RNA,并用M-MLA反转录酶反转录获得cDNA;以cDNA为模板进行PCR扩增,以β-actin为内参照。survivin基因上游引物为5’-AGGTCATCTCGGCTGTTCCTG-3’,下游引物为5’-TCATCCTCACTGCGGCTGTC-3’;β-actin基因上游引物为5’-GAGACCTTCA ACACCCCAGCC-3’;下游引物为5’-GGCCATC TCTTGCTCGAAGTC-3’。survivin和β-actin的PCR扩增产物片段的长度分别为147 bp和311 bp。反应条件:95 ℃预变性3 min;95 ℃变性50 s,55 ℃退火50 s,72 ℃延伸1 min(共32个循环);72 ℃终延伸10 min。扩增后的产物行1.5%琼脂糖凝胶电泳鉴定,溴化乙锭染色,再经凝胶成像系统成像,用Gelworks l D Advanced v4.01软件进行条带灰度分析。
1.2.3.5 Western blot检测survivin蛋白表达
分组同上。转染30 h收集各组细胞,裂解细胞抽提蛋白,取40 μg总蛋白行l0%SDSPAGE分离蛋白,分离后的蛋白转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,5%脱脂奶粉封闭2 h,加入survivin鼠抗人单克隆抗体(终质量浓度为0.5 μg/mL)4 ℃反应过夜,TBST洗膜后,加1∶4 000稀释的辣根过氧化物酶标记的二抗,用Ultra ECL发光剂检测。
1.2.3.6 激光共聚焦检测各处理组细胞HIF-1α和survivin蛋白表达
分组同上。转染30 h后加入survivin兔抗人单抗和HIF-1α鼠抗人单抗(按1∶1混匀),步骤同1.2.2。
1.2.4 HIF-1α表达质粒和HIF-1 αsiRNA和报告基因共转染A549细胞,检测报告基因萤光素酶活性
1.2.4.1 HIF-1α表达质粒和报告基因共转染
缺氧处理后的106个A549细胞接种于6孔细胞培养板中,细胞融合达到70%~90%时进行转染;设立以下3组:pGL3-SVP 230-luc转染组(阴性对照组)、pGL3-SVP 230-luc与pcDNA3.0-HIF-1α共转染组、pGL3-SVP-230-luc与pcDNA3.0共转染组。质粒和LipofectamineTM2000用量同上。操作依照说明书进行。
1.2.4.2 HIF-1α siRNA和报告基因共转染
设立以下各组: HIF-1α siRNA组、control siRNA组,单独pGL3-SVP 230-luc转染组(阴性对照组)。siRNA浓度和转染程序同上。siRNA转染入A549细胞24 h后,pGL3-SVP 230-luc再次转染该细胞。
1.2.4.3 萤光素酶活性分析
各组细胞在报告基因质粒转染30 h后采用双萤光素酶报告基因检测试剂盒检测萤光素酶活性,操作步骤参照Promega检测试剂盒说明书。
1.2.5 EMSA实验
细胞核蛋白抽提和浓度测定:核蛋白抽提参考文献[7]的方法。用B C A法测定核蛋白浓度;双链寡核苷酸探针设计如下。探针1:survivin启动子序列(转录起始区上游-26~-9 bp),正义链5’-GAGGGCGTGCGCTCCCGA-3’,反义链5’-TCGGGAGCGCACGCCCTC-3’;探针2:s u r v i v i n启动子序列(转录起始区上游-144 bp~-127 bp),正义链5’-GTCGCTGGGTGCACCGCG-3’;反义链5’-CGCGGTGCACCCAGCGAC-3’;突变探针1:正义链5’-GAGGGCAGCGCTCCCGA-3’,反义链5’-TCGGGAGCGCTGCCCTC-3’;突变探针2:正义链5’-GTCGCTGGAGCACCGCG-3’,反义链5’-CGCGGTGCTCCAGCGAC-3’。98 ℃加热探针15 min,自然冷却使其退火.用r-32P[ATP]标记探针,G25 Sephadex柱纯化探针。EMSA按Promega公司提供的试剂盒操作程序进行。
1.2.6 流式细胞术(FCM)检测早期细胞凋亡
设立以下5组:pcDNA3.0-HIF-1α组、HIF-1αsiRNA组、pcDNA3.0组、control siRNA组和control组。转染48 h后胰酶消化至单细胞悬液状态,1 500 r/min常规离心15 min(离心半径15 cm),PBS清洗,往100 μL细胞悬液中加入5 μL Annexin V/FITC和10 μL 20 μg/mL的碘化丙啶溶液,混匀后于室温避光温育15 min。流式细胞仪通过cell Quest收集并检测104个细胞进行分析。
1.2.7 MIT法观察A549细胞增殖
分组同上。转染48 h后,在每组的3个平行孔中加入四甲基偶氮唑蓝(MTT,浓度为5 mg/mL)100 μL,置37 ℃,CO2体积分数为5%的温箱中继续温育4 h,小心弃上清液,加入二甲亚砜100 μL,振荡5 min,用Bio-Rad酶标仪在570 nm处读取吸光度值(D值)。细胞增殖抑制率=(1-D实验组平均值/D对照组平均值)×100%。
1.3 统计学处理
实验数据用表示,应用SPSS 13.0统计软件进行统计分析,多组比较进行单因素方差分析,两两比较进行LSD-t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 HIF-1α和survivin蛋白在A549细胞中的表达
HIF-1α阳性表达呈绿色荧光,survivin阳性表达呈红色荧光,两者在同一位置共表达呈黄色荧光。结果发现HIF-1α和survivin在A549细胞质和细胞核同一位置存在共表达(图1)。
2.2 外源性转录因子HIF-1α及其siRNA对survivin mRNA和蛋白表达的影响
HIF-1α表达质粒的测序结果与Genbank公布的HIF-1α标准序列比对,发现同源性达到99.99%(图2)。RT-PCR结果表明,与对照干扰序列相比,HIF-1α siRNA可以下调HIF-1α mRNA水平达78.3%,具有良好的干扰效果,完全能满足后续实验的要求。pcDNA3.0-HIF-1α组和HIF-1α siRNA组survivin mRNA相对表达强度分别为0.70±0.06和0.11±0.03,与各对照组相比,差异均有统计学意义(P<0.01,图3)。Western blot结果显示,pcDNA3.0-HIF-1α组survivin蛋白表达强度为0.73±0.06,显著高于对照组(P<0.01),HIF-1α siRNA组为0.11±0.02,显著低于对照组(P<0.01,图4)。激光共聚焦检测显示,HIF-1α siRNA转染后两者表达的荧光强度明显减弱(图5)。


2.3 A549细胞中外源性转录因子HIF-1α对survivin核心启动子活性的影响
pGL3-SVP230-luc与pcDNA3.0-HIF-1α共转染A549细胞30 h后检测萤光素酶的活性,结果显示pcDNA3.0-HIF-1α组荧光素酶活性为78.8±6.4,显著高于pcDNA3.0转染组36.4±4.1和对照组32.4±2.6(P<0.01),而空质粒转染组荧光素酶活性与对照组相比,差异无统计学意义(P>0.05,图6)。

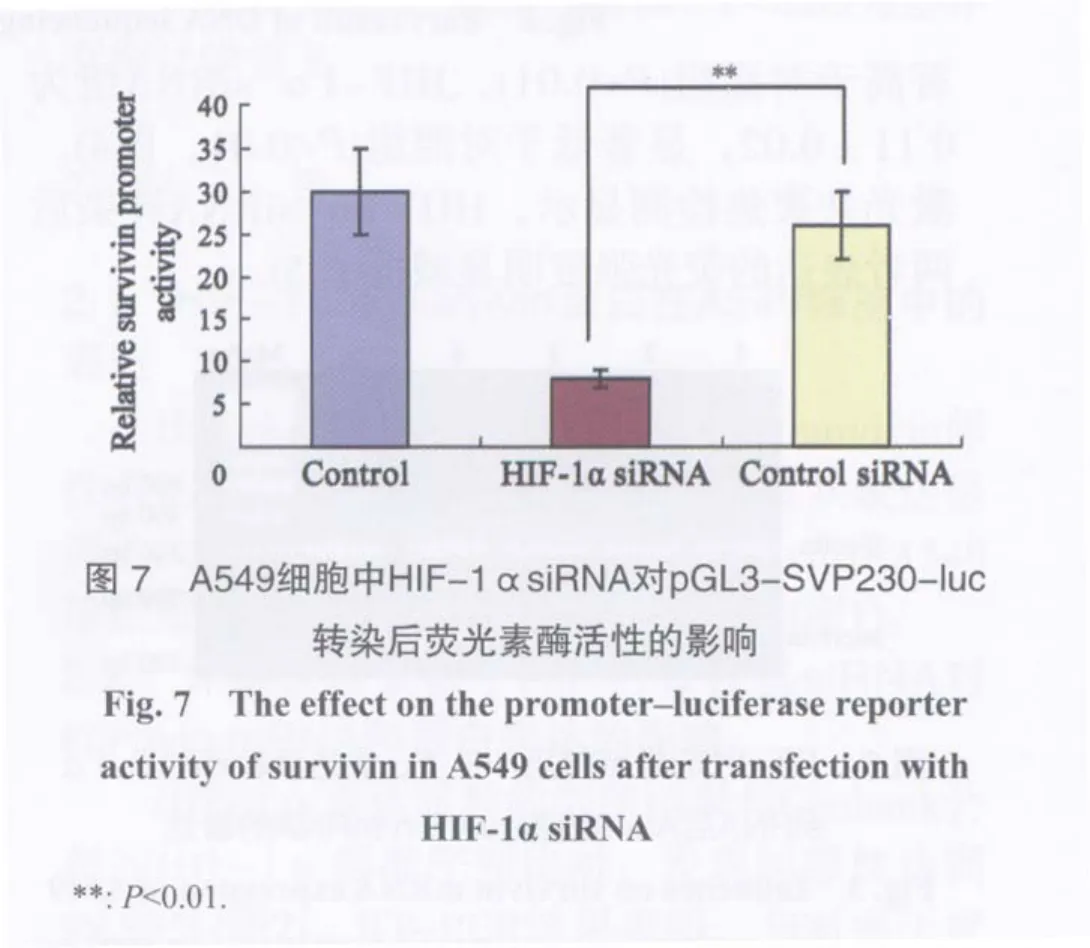
2.4 A549细胞中HIF-1α siRNA对survivin核心启动子活性的影响
HIF-1αsiRNA处理组萤光素酶的活性为8.1±1.3,显著低于control siRNA组26.1±4.1和对照组30.1±5.2(P<0.01),而control siRNA组荧光素酶活性与对照组相比,差异无统计学意义(P>0.05,图7)。

2.5 EMSA确认HIF-1α与survivin核心启动子区-19~-16 bp位点的结合
样品反应中探针1序列(转录起始点上游-26~-9 bp)与核蛋白作用,自显影后出现DNA-核蛋白结合的滞后条带;探针冷竞争反应中,100倍量的未标记探针竞争掉标记探针;突变探针冷竞争反应则观察到了结合条带;为了证实本实验所提取的核蛋白含有HIF-1α,核蛋白预先加入HIF-1α抗体处理,再加入标记探针,Super-shift反应中自显影后出现DNA-核蛋白结合条带及Super-shift结合条带(图8)。探针2序列(-144~-127 bp)与核蛋白作用,未出现DNA-核蛋白结合滞后条带。表明HIF-1α仅与-26~-9 bp片段发生结合。

2.6 转染HIF-1α及其siRNA对A549细胞凋亡的影响
pcDNA3.0-HIF-1α组和HIF-1αsiRNA组细胞凋亡情况见图9,分别为1.92±0.28和20.85±2.92,与各对照组相比,差异均有统计学意义(P<0.01)。
2.7 转染HIF-1α及其siRNA对A549细胞增殖的影响
pcDNA3.0-HIF-1α组和HIF-1αsiRNA组细胞抑制率分别为(61.3±7.6)%和(4.1±1.2)%,与各对照组相比,差异均具有统计学意义(P<0.01)。

3 讨 论
survivin是从人类基因库杂交筛选分离出的一种独特的凋亡抑制基因,定位于染色体17q25区,全长14.7 kb,由3个内含子和4个外显子组成,编码142个氨基酸[1],调控survivin表达的关键环节在转录水平[8]。本课题组前期研究证实,survivin的核心启动子区位于-203 bp~+64 bp处,该区域存在Sp1、E2F和p53等转录因子识别位点[9]。但迄今为止,对于survivin在肺癌中高表达的转录调控机制尚不清楚。
缺氧可诱发肿瘤细胞survivin启动子活性增强,HIF-1α可能在此机制中发挥重要作用[10]。乏氧环境下,HIF-1α表达显著增加,并与HIF-1β形成异二聚体,与肿瘤相关基因的缺氧反应元件(hypoxia response element,HRE)结合,影响下游基因转录活性[11]。在前列腺癌的研究中发现,survivin和HIF-1α共同高表达,并促进了前列腺癌的侵袭和增殖,肺癌中是否存在类似现象尚未见报道[12]。
本研究采用免疫荧光双标法检测缺氧处理后A549细胞中survivin和HIF-1α的表达,结果显示,survivin和HIF-1α在细胞质和细胞核同一位置存在共表达,表明HIF-1α和survivin在肺癌中存在表达的相关性。我们既往曾用免疫组化法观察120例NSCLC患者肺癌组织的survivin和HIF-1α蛋白表达水平,其表达率分别为81.60%(98/120)和58.33%(70/120),两者表达呈显著正相关[13]。与本实验结果相吻合。RT-PCR和Western blot结果显示,HIF-1α表达质粒转染A549细胞后,survivin mRNA和蛋白表达较对照组分别上调了113%和95%,证实HIF-1α对survivin表达起正调控作用,而转染HIF-1α siRNA,则显著下调了survivin表达,从反面证实上述调控作用。这与Chang等[5]在胰腺癌中的研究结果类似:反义HIF-1α降低了胰腺癌BxPc-3细胞的HIF-1α和survivin表达。
本研究在体外共转染实验中进一步探讨了HIF-1α对survivin启动子活性的影响。HIF-1α表达质粒与pGL3-SVP230-luc共转染A549细胞后survivin启动子活性显著增高,而 HIF-1α siRNA干扰HIF-1α后,启动子活性下调,上述结果从正反两方面证实了A549细胞中HIF-1α是导致survivin转录激活的重要转录因子之一。

前期的生物信息学分析表明,survivin核心启动子转录起始点上游-19~-16 bp和-144~-127 bp处存在HIF-1α潜在结合位点[9],本课题组构建包含-19~-16 bp突变序列的萤光素酶报告基因载体,转染A549细胞,启动子活性下降36.6%,而突变-144~-127 bp关键序列,survivin核心启动子活性无显著变化[6]。据此推测,HIF-1α可能与-19~-16 bp序列直接结合调控survivin转录。本研究利用EMSA技术验证上述推测。EMSA是一种体外证实目的蛋白与靶DNA直接结合的方法。我们提取A549细胞核蛋白,分别与经r-32P标记的survivin启动子序列-26~-9 bp和-144~-127 bp两处HIF-1α潜在结合位点作用。结果表明,-26~-9 bp片段与核蛋白结合。且该复合物可以与HIF-1α特异性抗体结合。突变-19~-16 bp序列的部分碱基后,序列不能竞争survivin启动子序列-26~-9 bp与核蛋白的结合。因此survivin核心启动子-19~-16 bp区是HIF-1α的结合位点。而-144~-127 bp序列没有与核蛋白形成复合物条带,提示-144~-127 bp处可能不存在HIF-1α结合位点,这与Peng等[14]在乳腺癌细胞中的研究不完全吻合。张晓洁等[15]在研究转录因子Sp1对survivin转录调控的分子机制时亦遇到了类似现象,推测造成这种差异的部分原因可能与转录调控存在细胞类型特异性和刺激的依赖性有关。此外,基因的调控是由多条相互作用的信号通路构成的网络来实现的。缺氧的A549细胞中,HIF-1α与notch1信号途径协调调控survivin转录[16]。HIF-1α对survivin的调控是否还与其他上游信号通路发生交互作用,及有无HIF-1α与其余反式作用因子形成转录复合物的可能,尚需深入探讨。
本研究还发现,HIF-1α siRNA转染A549细胞后,不仅有效沉默靶基因survivin,而且抑制A549细胞增殖,促进细胞凋亡,提示干预HIF-1α可成为治疗survivin高表达肺癌的一种新手段。
[1]ALTIERI D C. Survivin, versatile modulation of cell division and apoptosis in cancer[J]. Oncogene, 2003, 22: 8581-8589.
[2]FALLENI M, PELLEGRINI C, MARCHETTI A, et al.Survivin gene expression in early stage non-small cell lung cancer[J]. J Pathol, 2003, 200(5): 620-626.
[3]陈余清, 李殿明, 蔡映云, 等. 纤支镜活检和痰液标本Survivin基因检测对肺癌诊断的意义[J]. 中华结核和呼吸杂志, 2005, 28(4): 225-229.
[4]CSIKI I, YANAGISAWA K, HARUKI N. Thioredoxin-1 modulates transcription of cyclooxygenase-2 via hypoxiainducible factor-1 in non-small cell lung cancer[J].Cancer Res, 2006, 66(1): 143-150.
[5]CHANG Q, QIN R, HUANG T, et al. Effect of antisense hypoxia-inducible factor 1 alpha on progression, metastasis,and chemosensitivity of pancreatic cancer[J]. Am J Pancreas, 2006, 32(3): 297-305.
[6]CHEN Y Q, ZHAO C L, LI W. Effect of hypoxia-inducible factor-1α on transcription of survivin in non-small cell lung cancer[J]. J Exp Clin Cancer Res, 2009, 26(28): 2.
[7]BERNARDINI G, RIBATTI D, SPINETTI G, et al. Analysis of the role of chemokines in angiogenesis[J]. J Immunol Methods, 2003, 273(1-2): 83-101.
[8]WU J, LING X, PAN D, et al. Molecular mechanism of inhibition of survivin transcription by the GC-rich sequenceselective DNA binding antitumor agent, hedamycin: evidence of survivin down-regulation associated with drug sensitivity[J]. J Biol Chem, 2005, 280(10): 9745-9751.
[9]陈余清, 陈斌, 李伟. 肺腺癌细胞A549中人survivin基因核心启动子位置与功能初探[J]. 肿瘤学杂志, 2008,14(11): 867-871.
[10]YANG L, CAO Z, LI F, et al. Tumor-specific gene expression using the survivin promoter is further increased by hypoxia[J]. Gene Ther, 2004, 11(15): 1215-1223.
[11]BERRA E, RICHARD D E, GOTHIÉ E, et al. HIF-1-dependent transcriptional activity is required for oxygenmediated HIF-1alpha degradation[J]. FEBS Lett, 2001,491(1-2): 85-90.
[12]YUN Y J, LI SH, CHO Y S, et al. Survivin mediates prostate cell protection by HIF-1alpha against zinc toxicity[J].2010, 70(11): 1179-1188.
[13]陈余清, 赵成岭, 李伟. 非小细胞肺癌中survivin和HIF-1α的表达及其相关性研究[J]. 蚌埠医学院学报, 2008,33(6): 634-636.
[14]PENG X H, KNRNA P, CAO X H, et al. Cross-talk between epidermal growth factor receptor and hypoxia-inducible factor-1a signal pathways increases resistance to apoptosis by up-regulating survivin gene expression[J]. Am J Biol Chem, 2006, 281: 25903-25914.
[15]张晓洁, 陈余清, 李伟. Sp1在人肺癌细胞中对survivin表达的调控[J]. 中国肿瘤, 2009, 18(4): 319-321.
[16]CHEN Y Q, LI D M, LIU H L, et al. Notch-1 signaling facilitates survivin expression in human non-small cell lung cancer cells[J]. Cancer Biol Ther, 2011, 11(1): 1-8.
Regulation ofsurvivinexpression by hypoxia–inducible factor-1α in non-small cell lung cancer
LI Wei, CHEN Yu-qing, SUN Yan, ZHAO Cheng-ling, WANG Xiao-jing(Department of Respiratory Disease, First Affiliated Hospital of Bengbu Medical College, Provincial Key Laboratory of Respiratory disease in Anhui, Bengbu Anhui 233004, China)
CHEN Yu-qing E-mail:bbmccyq@126.com
Background and purpose:Survivingene is a unique member of the inhibitor of apoptosis protein(IAP) family. It plays an important role, not only in regulating mitosis but also in inhibiting apoptosis. It is highly expressed in almost all types of human tumors and fetal tissues but rarely detectable in normal adult tissues. High levels ofsurvivinexpression have been associated with tumor progression, resistance to radiation and drug treatments and poor survival rates in cancer patients. The current literature contains few reports on the transcriptional regulation ofsurvivinexpression in lung cancer. Previous studies have found that there are also 2 putative binding sites for hypoxiainducible factor-1α(HIF-1α) in the core promoter region ofsurvivingene.Survivinpromoter-luciferase reporter vectors pGL3-SVP230-luc have been constructed early. The purpose of this study was to investigate the mechanism of (HIF-1α)on transcriptional regulation ofsurvivinin A549 cells by hypoxia.Methods:⑴Double labeling immunof l uorescence method was used to detect co-expression of survivin/HIF-1α protein; ⑵RT-polymerase chain reaction (RT-PCR)and Western blot was used to examine the level of survivin mRNA and protein in A549 cells transfected by HIF-1α expression plasmid and HIF-1α siRNA; ⑶Luciferase activity was detected in A549 cells following cotransfection with pGL3-SVP230-luc as well as HIF-1α expression plasmid or HIF-1α siRNA to value the transcriptional activity ofsurvivin. ⑷Electrophoretic mobility shift assay (EMSA) was performed to test the nuclear extract of the A549 cells binding to the r-32P labeled probes containing survivin promoter squences.Results:⑴Survivin/HIF-1α proteins coexpressed in A549 cell; ⑵Compared with control groups, the level of survivin mRNA and protein is markedly increased in A549 cells transfected with HIF-1α expression plasmid, but decreased in the HIF-1α siRNA group(P<0.01); ⑶The relative activity of pGL3-SVP230-luc in A549 cells transfected with HIF-1α expression plasmid was 78.84, which was significantly higher than that of both the pcDNA3.0 and the negative control group in the A549 cells (P<0.01),but was significantly lower in the HIF-1α siRNA group (P<0.01); ⑷DNA-neucleoprotein bands were observed when A549 nuclear extracts incubating with the r-32P labeled -18 bp probe (nucleotides -26 to -9) ofsurvivincore promoter in EMSA assay. The specific bands were competed away by the cold 18 bp probe, but not the mutated cold probe in competition assay. Binding bands exhibited in Super-shift reaction. ⑸The proliferation of A549 cells was inhibited after transfection with HIF-1α siRNA. Cell apoptosis was significantly increased in HIF-1α siRNA group compared to negative control group (P<0.01).Conclusion:The binding of HIF-1α to thesurvivincore promoter (nucleotides-19 to -16 bp in its 5’ fl anking region) increases transcription and expression of thesurvivingene. These observations have significant implications for understanding the part molecular mechanism ofsurvivintranscriptional regulation in lung cancer.
HIF-1α;survivin; Transcriptional regulation; NSCLC
10.3969/j.issn.1007-3969.2011.06.002
R734.2
A
1007-3639(2011)06-0427-08
国家自然科学基金资助项目(No: 30772532);安徽省自然科学基金资助项目(No: 070413094)。
陈余清 E-mail:bbmccyq@126.com
2011-01-20
2011-05-15)
