羧甲基壳聚糖季铵盐作为基因载体及动物体内分布研究
2011-05-30李晓昱梁晓飞朱明洁孙彦明段友容
李晓昱 梁晓飞 朱明洁 孙彦明 段友容
上海交通大学医学院附属仁济医院肿瘤研究所,上海交通大学肿瘤研究所, 上海 200032
基因疗法是治疗肿瘤的新手段[1-2]。但目前面临的主要障碍是缺乏合适的基因治疗载体[3-4]。由于病毒性基因载体存在导向性差、携带能力低、免疫原性和潜在致瘤性等缺点[5]。因此,针对其缺点研制非病毒载体近来成为研究的热点,主要包括真核细胞表达质粒载体、阳离子聚合物[6-7]、阳离子脂质体[8]和聚合物嵌段共聚物等。
壳聚糖是一种天然无毒的多糖,具有良好的生物降解性和生物相容性,并通过吸附DNA保护其免受酶的降解[2]。壳聚糖骨架上丰富的氨基和羟基使其易于化学修饰,有利于进一步提高递送基因的效率[9]。已有许多体内外实验证实,壳聚糖及其衍生物是非病毒基因载体的合适材料[10]。含有长链烷基的亲水性羧甲基壳聚糖季铵盐具备了更好的溶解性和乳化性。这些性状的改变,使其更加适合作为基因转染材料。
本研究在模拟普通的阳离子脂质体基因转染系统的基础上,将脂质体技术与纳米聚合物胶束技术相结合,构建新型阳离子高分子脂质体(CPL)系统,并将其作为基因载体,探讨其基因转染效率及动物体内分布,争取最大限度地提高载体的基因转染效率。其中CPL采用以壳聚糖季铵盐为主体,选取长链不同烷基数目的壳聚糖季铵盐,探讨不同结构的壳聚糖季铵盐对转染效率的影响。本研究通过检测CPL纳米粒在3种不同荷瘤裸鼠体内的分布,为非病毒载体的基因转染和基因治疗提供有科学价值的实验数据。
1 材料和方法
1.1 主要材料
壳聚糖,具有99%脱乙酰度和相对分子质量约为5×104和1×105,国药集团化学试剂有限公司提供。十八烷基二甲基氯化铵甘油酯(QA)由本实验室制备。质粒DNA(pEGFP-C1质粒和pGL3-对照载体)由本实验室保存,提取自培养的大肠埃希菌,质粒抽提试剂盒购自Macherey-Nagel公司。琼脂糖凝胶(0.8%)电泳分析表明,其以超螺旋质粒的形式为主。脂质体转染试剂Lipofectamine 2000购自Invitrogen公司。3-(4,5二甲基-2-噻唑)-2,5-diphenyltetrazolium溴(MTT)购自Amresco公司。6~7周龄BALB/c裸鼠由上海市第一人民医院实验室提供。其他所有的培养液和细胞培养中使用试剂均购自Hyclone公司。其他化学品均购自国药集团化学试剂有限公司,并未进一步的纯化。
1.2 CPL纳米粒的制备与表征
1.2.1 CPL的制备
根据长链烷基数目不同,分别选取十二烷基二甲基氯化铵甘油酯、十四烷基二甲基氯化铵甘油酯、十六烷基二甲基氯化铵甘油酯、十八烷基二甲基氯化铵甘油酯为原料,根据文献[11-13]的方法,制备十二烷基-羧甲基壳聚糖季铵盐(DQCMC)、十四烷基-羧甲基壳聚糖季铵盐(TQCMC)、十六烷基-羧甲基壳聚糖季铵盐(CQCMC)、十八烷基-羧甲基壳聚糖季铵盐(OQCMC)嵌段共聚物,相对分子质量为2×104g/mol,季铵盐的接枝率是105.0%。
1.2.2 CPL纳米粒的制备
采用薄膜分散法制备CPL的过程如下:按照质量比5∶4的比例,精确称取壳聚糖季铵盐和胆固醇10 mg和8 mg,加入到50 mL茄形瓶中,溶于2 mL氯仿中,然后在旋转蒸发仪上进行旋蒸,同时向旋转蒸发仪中通入适当流速的氮气流加以保护。当茄形瓶中形成一层透明均匀的脂质膜后,继续旋蒸15 min,稍微干燥后, 向茄形瓶中加入2 mL去离子水,将脂质膜水化,然后用超声波清洗器以99 w的功率进行超声分散,直至形成半透明乳液,即得到阳离子高分子脂质体溶液。
1.2.3 DNA/CPL纳米粒的制备
DNA和CPL纳米粒分别用Opti-MEM 100 μL稀释。室温下静置10 min,漩涡震荡3~5 s后,继续静置20 min,使DNA与纳米粒紧密吸附在一起。
1.2.4 CPL纳米粒的表征
利用动态光散射粒度分析仪(NICOMP 380 ZLS Zeta Potential/Particle Sizer, PSS Nicomp, and Santa Barbara, CA,USA)测定纳米粒粒径分布。所有的测量均在25℃时进行,测量角度为90°。
利用透射电子显微镜(TEM,HITACHI H-7650,Japan)观察纳米粒的形貌。用镊子小心取出碳膜铜网,将膜面朝上(在灯光下观察显示有光泽的面,即膜面),轻轻平放在白色滤纸上;然后滴2~3滴该混合液体到碳膜铜网上,至网上形成饱满水滴而不流下为宜。静置2~3 min后用滤纸在网下吸去多余水分,室温干燥5 min。磷钨酸染色10~20 min后,透射电子显微镜下观察。
1.3 TQCMC纳米粒细胞毒性实验
以1×104细胞/孔的密度将L929细胞接种到96孔板中,在37 ℃,CO2体积分数为5%条件下温育24 h后,分别加入20 μL终浓度分别为1、10、20、50、100 μg/mL的TQCMC,DNA/TQCMC,LipofectamineTM2000,DNA LipofectamineTM2000培养24 h后,每孔加入5 mg/mL MTT溶液20 μL,37 ℃继续温育4 h,终止培养。小心吸取孔内培养上清液后,每孔加入150 μL DMSO,温育30 min。选择490 nm波长,在酶联免疫监测仪(Bio-RAD Model 550)上测定各孔吸光值。细胞活性按下列公式计算。
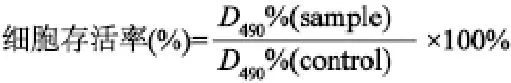
1.4 CPL纳米粒体外转染实验
转染前24小时将5×104个细胞接种到24孔板中,在37 ℃,CO2体积分数为5%条件下温育18~24 h后至细胞融合度为70%~80%。转染前将完全培养基吸去,用PBS洗涤2次,加入500 μL无血清培养基。分别将0.8 μg EGFP或者PGL3质粒DNA和不同质量比的TQCMC纳米粒溶解与100 μL的opti-MEM培养液中,静置5 min。再将两者轻柔混合,室温静置20 min。将该混合物加入培养孔中温育3 h后,置换无血清培养基为完全培养基。继续培养48 h后,流式细胞仪(Beckman Coulter Epics XL)检测或按照荧光素酶报告基因检测试剂盒(碧云天)所 提供的说明书在promega-20/20化学发光仪上检测光子的强度。用BCA蛋白浓度测定试剂盒(碧云天)检测出总蛋白的浓度,从而将结果统一标准化成RLU/(mg·mL-1)蛋白(每毫克蛋白所对应的相对光子数)。
1.5 荷瘤裸鼠模型的构建
分别取对数生长期人乳腺癌MDA-MB-231细胞、人卵巢癌HO8901细胞、人前列腺癌PC-3细胞于每只裸鼠(共54只)右后下肢皮下接种5×106/0.2 mL。确保皮丘饱满无漏液,接种后每天观察注射点有无红肿破溃及裸鼠的一般情况。接种后14~20 d左右,接种点无红肿、破溃。裸鼠形成单一皮下移植瘤,直径约1.0 cm,即为模型构建成功。
1.6 TQCMC纳米粒在裸鼠体内分布
分别将荷人乳腺癌MDA-MB-231、人卵巢癌HO8901、人前列腺癌PC-3裸鼠18只,称重并随机分为3组:DNA/CPL组(简称CPL组,DNA与CPL质量比为1∶4)、DNA/LipofectamineTM2000(简称LipofectamineTM2000组,DNA与LipofectamineTM2000质量比为1∶1)、质粒DNA组(简称质粒组)。每组6只,每只尾静脉分别注射相应的试剂200 μL(含质粒DNA 40 mg溶于MEM培养液中),于注射后48 h将3组裸鼠处死。每只裸鼠均取出肝、脾、肾、心、肺和肿瘤,用滤纸吸净组织所带血液,称取组织的重量后放入EP管中。均浆组织后立即测定各组织的荧光素酶强度(RLU值),并用BCA蛋白浓度测定试剂盒检测出总蛋白的浓度,从而将结果统一为RLU/(mg·mL-1)蛋白(每毫克蛋白所对应的相对光子数)。
1.7 统计学处理
采用SPSS 10.0统计学软件进行统计分析,数据用表示,各组间差异用t检验或方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 CPL的形态、粒径大小
经过透射电镜观察,CPL纳米粒大小均匀,形态规整。动态光散射粒度分析仪检测得出,DQCMC、TQCMC、CQCMC和OQCMC的粒径分别为114.5、120.5、125.1和170.1 nm。由此可知CPL的粒径均在100~200 nm之间,并且随着长链烷基数目的增加,纳米粒粒径逐渐增大。

2.2 CPL的体外转染实验结果
以荧光素酶载体pGL3-control为报告基因来观察不同CPL对PC-3和293T细胞的基因转染的情况。由图1可见,CPL作为一种良好的基因载体,具有较高的转染强度。其中尤以DQCMC和TQCMC转染效果最佳,对于PC-3细胞达到106RLU/(mg·mL-1),对于293T细胞达到109RLU/(mg·mL-1)。但是由于TQCMC较DQCMC在制备过程中产率更大,更易获得,因此以下实验均选取TQCMC为实验对象。
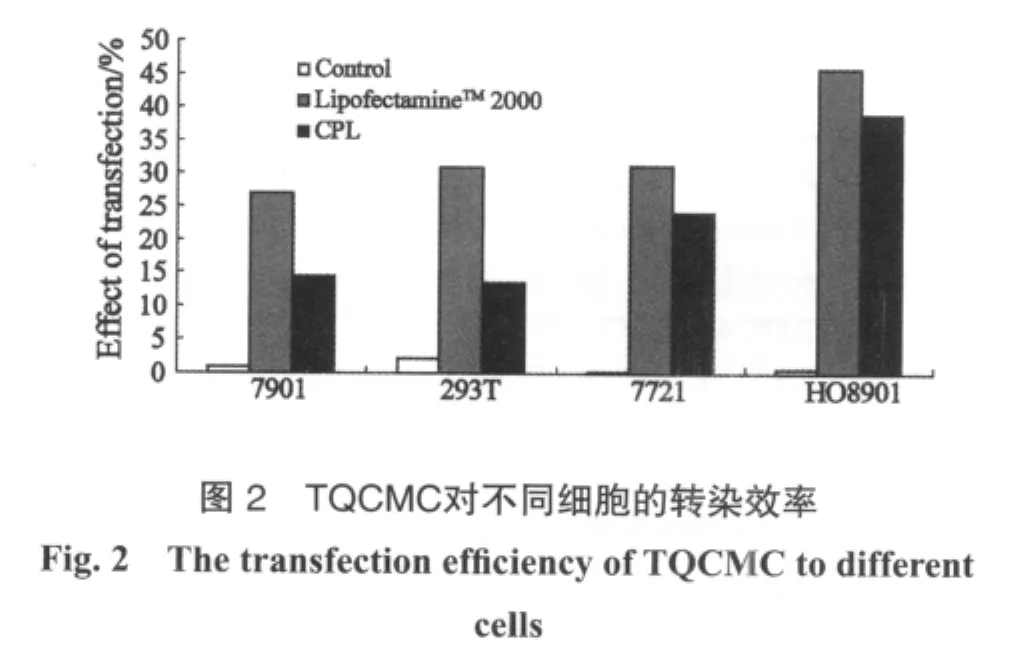
按照D N A与T Q C M C质量比1∶4的比例,以LipofectamineTM2000为阳性对照,以EGFP质粒DNA为阴性对照,分别进行TQCMC纳米粒对人胃腺癌细胞SGC7901、293T、人肝癌细胞SMMC-7721和人卵巢癌细胞HO8901进行体外转染实验。经过流式细胞仪检测发现(图2),TQCMC纳米粒的转染效率虽然较LipofectamineTM2000略差,但在HO8901细胞中转染效率相对较高,可作为一种有效的基因转染载体。
2.3 TQCMC纳米粒细胞毒性实验结果
纳米粒与L929细胞作用4 h后,根据MTT试验计算生存率,当浓度为100 μg/mL时,TQCMC纳米粒的生存率为76.15%,而LipofectamineTM2000已降至17.95%。与DNA复合后,纳米粒的生存率略有下降,但仍较LipofectamineTM2000细胞毒性小(图3)。MTT试验结果与显微镜下形态学观察基本吻合。

2.4 TQCMC纳米载体在裸鼠体内的分布
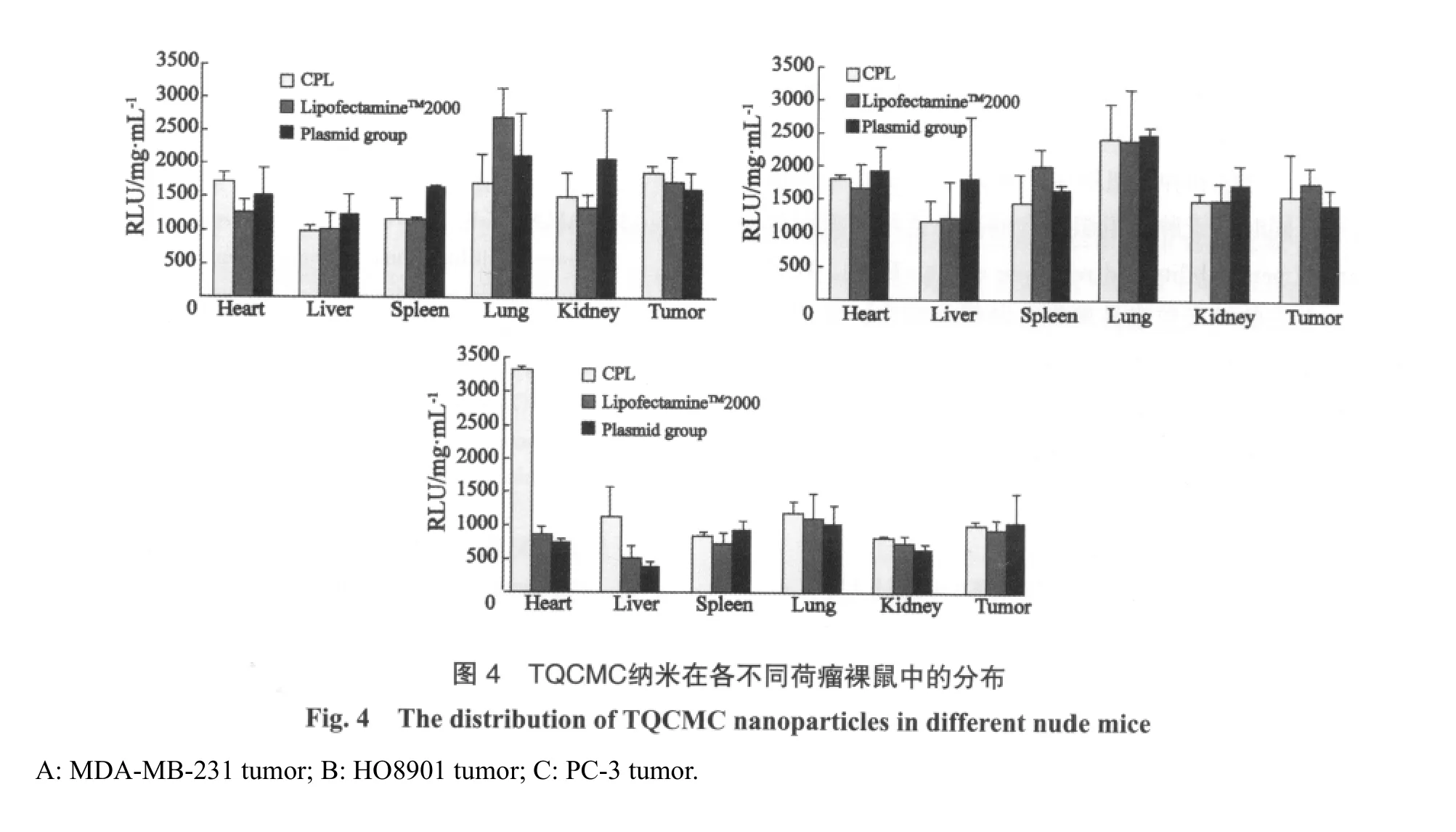
与LipofectamineTM2000相比,在荷人乳腺癌MDAMB-231裸鼠体内TQCMC纳米粒主要分布在心脏、肾脏和肿瘤组织中(图4A)。TQCMC纳米载体在荷人卵巢癌HO8901裸鼠体内主要集中在肺脏、心脏、肾脏和肿瘤组织中(图4B)。TQCMC纳米载体在荷人前列腺癌PC-3裸鼠体内分布于心脏、肝脏、肺脏和肿瘤组织中(图4C)。但有一点值得注意,无论是阳性对照LipofectamineTM2000组还是实验组CPL组,与阴性对照质粒组的体内分布差异很小。
3 讨 论
目前很多壳聚糖的衍生物就是针对基因载体的要求进行制备的,壳聚糖季铵盐就是其中之一。壳聚糖季铵盐的种类有很多。高分子脂质体水溶液中不易发生融合,稳定性好,同时含有氨基和羧基等官能团,容易进行多功能化组装[14]。TQCMC替代磷脂,成功制备了表面带正电并含有氨基等官能团的阳离子高分子脂质体TQCMC。以TQCMC为主体所构成的阳离子高分子脂质体所采用的原料壳聚糖和季铵盐等,较易得到、价格低廉。相对于价格昂贵的LipofectamineTM2000,CPL成本的降低使其在各个领域大规模的应用成为可能。
影响转染效率的因素有很多,如培养基pH值、转染时间、细胞种类、纳米粒粒径等[15]。本实验所制备的纳米粒均在100~200 nm之间,且随着长链烷基数目的增加粒径逐渐增大。粒径再此区间的纳米粒多可通 过胞吞途径进入细胞,增强转染效果。
基因载体的生物安全性一直以来备受关注。由MTT实验可以看出,与LipofectamineTM2000相比,TQCMC的生物毒性明显下降,其安全浓度有了显著提高,为其在体内广泛应用打下了基础。为了验证TQCMC转染效率的广适性,本研究针对4种不同的细胞进行转染实验。与LipofectamineTM2000相比,TQCMC的转染效率仍有一定差距;但对于人卵巢癌HO8901细胞来说,TQCMC纳米粒可以达到38.9%。由于纳米颗粒表面含有氨基等官能团,因此很容易采用多种方法增强载体的基因转染效率。如使用靶向试剂对其进行表面修饰而制备具有组织、细胞膜或细胞核靶向功能的纳米基因载体系统;使用跨膜肽的修饰则可提高纳米粒的跨细胞膜功能;也可将具有质子海绵效应的PEI复合到高分子脂质体当中。
能否在体内有效递送基因是制约基因治疗的瓶颈。虽然近年来许多非病毒载体发展迅猛,体外转染效率有了很大提高,但生物安全性和体内基因表达等问题大大阻碍了非病毒载体在临床上的应用。由TQCMC纳米粒的裸鼠体内分布实验表明,对于不同肿瘤模型的裸鼠,TQCMC纳米粒的分布有所区别,但总体而言,主要分布在肝脏,肾脏和肿瘤组织中,体现了TQCMC纳米的代谢途径。同时由于肿瘤组织特有的高通透性和滞留效应(enhanced permeability and retention effect,EPR),粒径在150 nm左右的纳米粒容易聚集在肿瘤组织内,实现被动靶向。但是TQCMC纳米粒与裸质粒DNA组相比,其组织内的富集并不高。这也说明了体内环境的复杂性。设计并制备安全无毒,且能够在体内高效递送基因的非病毒载体还有很多需要解决的问题。
[1]OZBAS-TURAN S, ARAL C, KABASAKAL L, et al.Coencapsulation of two plasmids in chitosan microspheres as a nonviral gene delivery vehicle[J].J Pharm Pharm Sci,2003, 6(1): 27-32.
[2]MANSOURI S, LAVIGNE P, CORSI K, et al.Chitosan-DNA nanoparticles as non-viral vectors in gene therapy: strategies to improve transfection efficacy[J].Eur J Pharm Biopharm,2004, 57(1): 1-8.
[3]PARK J H, CHO Y W, CHUNG H, et al.Synthesis and characterization of sugar-bearing chitosan derivatives: aqueous solubility and biodegradability[J].Biomacromolecules,2003, 4(4): 1087-1091.
[4]CANINE B F, HATEFI A.Development of recombinant cationic polymers for gene therapy research[J].Adv Drug Deliv Rev, 2010, 62(15): 1524-1529.
[5]HODGSON C P.The vector void in gene therapy[J].Biotechnology, 1995, 13(3): 222-225.
[6]ZENG X, SUN Y X, QU W, et al.Biotinylated transferrin/avidin/biotinylated disulfide containing PEI bioconjugates mediated p53 gene delivery system for tumor targeted transfection[J].Biomaterials, 2010, 31(17): 4771-4780.
[7]NOUNOU M I, EMMANOUIL K, CHUNG S, et al.Novel reducible linear L-lysine-modified copolymers as efficient nonviral vectors[J].J Control Release, 2010, 143(3): 326-334.
[8]WECHUCK J B, OZUER A, GOINS W F, et al.Effect of temperature, medium composition and cell passage on production of herpes-based viral vectors[J].J Biotech Bioengin, 2002, 79(1): 112-119.
[9]ZHAO X, YIN L C, DING J Y, et al.Thiolated trimethyl chitosan nanocomplexes as gene carriers with high in vitro andin vivotransfection efficiency[J].J Control Release, 2010,144: 46-54.
[10]BORCHARD G.Chitosans for gene delivery[J].Adv Drug Deliv Rev, 2001, 52: 145-150.
[11]梁晓飞, 王汉杰, 田惠, 等.新型载药壳聚糖季铵盐的合成、结构和性能[J].物理化学学报, 2008, 24(2): 223-229.
[12]LIANG X F, WANG H J, JIANG X G, et al.Development of monodispersed and functional magnetic nanospheres via simple liposome method[J].J Nano Res, 2010, 12(5):1723-1732.
[13]LIANG X F, WANG H J, LUO H, et al.Characterization of novel multifunctional cationic polymeric liposomes formed from octadecyl quaternized carboxymethyl chitosan/cholesterol and drug encapsulation[J].Langmuir, 2008, 24(14), 7147-7153.
[14]MORGAN D M, LARVIN V L, PEARSON J D.Biochemical characterization of polycation-induced cytotoxicity to human vascular endothelial cells[J].J Cell Sci, 1998, 94: 553-559.
[15]DENNIS C, JAMESA H.Polymeric liposomes as stable gene carriers[J].Eur Patent, 1985, WO8504326.
