三苯氧胺诱导人乳腺癌MCF-7细胞株耐药及自噬的关系研究
2011-05-28马小俞刘哲斌喻三见李爽侯意枫邵志敏
马小俞 刘哲斌 喻三见 李爽 侯意枫 邵志敏
1.复旦大学附属肿瘤医院乳腺外科,复旦大学上海医学院肿瘤学系,上海 200032;2.复旦大学生物医学研究院,上海 200032
三苯氧胺诱导人乳腺癌MCF-7细胞株耐药及自噬的关系研究
马小俞1,2刘哲斌1喻三见1李爽1侯意枫1邵志敏1
1.复旦大学附属肿瘤医院乳腺外科,复旦大学上海医学院肿瘤学系,上海 200032;2.复旦大学生物医学研究院,上海 200032
背景与目的:三苯氧胺(tamoxifen)作为第一代选择性雌激素受体调节剂(selective estrogen receptor modulator,SERM)被广泛地应用于激素敏感型乳腺癌的内分泌一线治疗。三苯氧胺耐药的发生严重限制了临床治疗,是乳腺癌患者用药面临的重大难题,明确其耐药机制对乳腺癌的治疗有重要临床意义。本研究通过体外诱导人乳腺癌细胞MCF-7三苯氧胺耐药,探讨细胞产生三苯氧胺耐药时自噬水平的变化与MAPK家族蛋白细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)蛋白表达量及磷酸化水平的变化。方法:浓度递增筛选法诱导MCF-7细胞耐药,透射电镜观察MCF-7细胞与耐药细胞内的自噬泡数量,CCK8法检测细胞增殖状态,应用Western blot检测LC3Ⅱ、ERK1/2、Phospho-ERK1/2蛋白的表达情况。结果:诱导的三苯氧胺耐药细胞株TR5达到5 μmol/L的耐药浓度。TR5细胞内的自噬泡数量与LC3Ⅱ表达量明显高于MCF-7细胞。ERK蛋白在两种细胞中的表达量差异无统计学意义,但其在TR5中的磷酸化水平比MCF-7细胞高。结论:MCF-7三苯氧胺耐药细胞有较高的自噬水平,MAPK信号通路参与了三苯氧胺耐药。
乳腺癌; 三苯氧胺; MCF-7细胞; 自噬
三苯氧胺(tamoxifen)从20世纪70年代开始广泛地应用于激素敏感型乳腺癌的内分泌一线治疗[1]。三苯氧胺通过和雌激素受体(estrogen receptor,ER)竞争性结合,募集共阻遏因子,减少各种靶基因的转录,从而达到细胞周期停滞,以致细胞凋亡的作用[1-2]。
尽管在ER和(或)孕激素受体(progestogen,PR)阳性的初治乳腺癌患者中,三苯氧胺的有效率可达70%(30%的患者先天耐药),但最终50%左右的患者对其产生耐药(即获得性耐药)[3-4]。究其原因可能与以下几方面有关:⑴ER和表皮生长因子受体(EGFR和Her-2)及类胰岛素生长因子Ⅰ型受体(IGF-1R)之间的交互作用(cross-talk);⑵雌激素受体β亚型的存在(ERβ);⑶ER编码基因的突变或异常磷酸化;⑷Src-Cas-EGFR-STAT5b信号通路的异常活化[5-6]。但是获得性耐药的分子机制尚不明确。本研究通过体外诱导人乳腺癌细胞MCF-7三苯氧胺耐药,比较耐药株与非耐药株细胞的自噬水平与丝裂原活化蛋白激酶(mitogenactivated protein kinase,MAPK)家族蛋白细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)的表达水平及磷酸化水平,探讨了细胞产生三苯氧胺耐药时自噬水平的变化与ERK蛋白表达量与其磷酸化水平的变化。
1 材料和方法
1.1 实验材料
1.1.1 细胞系
人乳腺癌细胞系MCF-7购于中国科学院上海生命科学研究院生命化学与细胞生物学研究所。
1.1.2 主要试剂
三苯氧胺购于美国Sigma公司,用无水乙醇溶解,配制母液浓度10-2mol/L,-20 ℃保存。雌二醇(E2)购于美国Sigma公司,用无水乙醇溶解,配制母液浓度10-6mol/L,-20 ℃保存。胎牛血清(FBS)购于奥地利PAA公司,DMEM高糖培养基购于美国Hyclone公司,活性炭处理去雌激素胎牛血清(CCFBS)购于以色列BioInd公司,CCK8细胞活性测定试剂盒购于日本同仁化学公司,蛋白定量试剂盒购于申能博彩生物科技有限公司,LC3B抗体购于美国Genetex公司,ERK1/2抗体、兔抗Phospho-ERK1/2抗体购于美国Cell Signaling Technology公司,哺乳动物蛋白抽提试剂、鼠抗GAPDH鼠单克隆抗体、辣根过氧化酶偶联的羊抗兔IgG、辣根过氧化酶偶联的羊抗鼠IgG购于北京康为世纪公司,HRP和AP化学发光检测底物购于美国Millipore公司。
1.2 方法
1.2.1 细胞培养
细胞在含10% FBS的DMEM高糖培养基中,培养条件为37 ℃、CO2体积分数为5%、饱和湿度,待细胞达到80%生长面积时,0.25%胰酶消化,每2天更换1次培养液。
1.2.2 细胞透射电镜观察
2.2.2 原料秸秆规模化利用不足 为了促进企业增加对秸秆资源的利用,扩大生产规模,就必须让其有利可图。目前大多数企业受秸秆收集难度大、运输成本高和生产技术技术的制约,使得对秸秆综合利用率和生产规模较低,从而秸秆资源大量的过剩。而农民因顾及时间、人力、机器使用成本,也会影响到对秸秆进行打捆,获得收入。
细胞传代贴壁后,换成含CCFBS的DMEM高糖培养液培养48 h,然后加入10-9mol/L E2培养12 h,在培养液里滴加2~3滴固定液(2.5%戊二醛),用细胞刮轻轻的刮下贴壁细胞,将细胞连同培养液放入尖头离心管中离心5 min,3 000 r/min,离心半径16 cm,去上清液,沿管壁轻轻滴入2.5%戊二醛,微波中档固定5~10 s后,置4 ℃下固定1 h,用带钩的解剖针勾出细胞团块,切成1 mm3大小的组织块。
组织块具体处理过程如下:取材→前固定(2.5%戊二醛,4 ℃冰箱,2 h以上)→漂洗(0.1 mol/L磷酸缓冲液,3次,每次15 min)→后固定(1%锇酸2 h) →漂洗(0.1 mol/L磷酸缓冲液,3次,每次15 min)→脱水(50%乙醇,3次,每次15 min)→块染(70%乙醇含3%醋酸铀过夜)→梯度脱水(90%乙醇,90%乙醇∶90%丙酮=1∶1,90%丙酮各15 min)→室温100%丙酮酮脱水(3次,每次15 min)→包埋(纯丙酮∶包埋液=1∶1,室温过夜;纯包埋液37 ℃ 烘箱 3 h)→固化(45 ℃ 烘箱6 h,60 ℃ 烘箱24 h)。
用LKB-1型超薄切片机切片,每个样品大概50~60 nm的厚度,然后用枸橼酸铅进行片染色,最后用日本电子JEM-1200EX透射电镜观察并拍片。
1.2.3 CCK-8细胞增殖率测定
制备细胞悬液,血细胞计数板细胞计数。悬浮细胞密度为6 000/mL,加入96孔板,每孔板加200 μL,待细胞贴壁后,吸出培养液,PBS洗1次,加入含10% CCFBS的DMEM高糖培养基培养48 h,再加用10% CCFBS的DMEM高糖培养基(含10-9mol/L E2)稀释不同浓度(分别为0、10-7、10-6和10-5mol/L)的三苯氧胺溶液,每一浓度做3个复孔,对照孔加入等体积的培养基。加入后37 ℃培养箱培养,48 h后每孔加入10 μL CCK-8,继续培养4 h,酶标仪测定450 nm光吸光度值(D),计算出增殖率,绘制曲线。细胞增殖率计算方式如下:

1.2.4 Western blot方法检测蛋白表达
细胞传代贴壁后,换成含10% CCFBS的DMEM高糖培养基培养48 h,再分别加入含10-9mol/L E2和10-9mol/L E2+10-5mol/L三苯氧胺培养液,培养12 h后吸出培养液,PBS洗2次,用哺乳动物蛋白抽提试剂裂解细胞,将内容物移入离心管,4 ℃、10 000 r/min离心15 min,上清置-20 ℃保存备用。用蛋白定量试剂盒测定蛋白质浓度。
1.2.5 统计学处理
采用Graphpad 5.0软件、SPSS 13.0软件和Image J软件进行数据分析作图。每次实验随机独立重复3次,所有作图和数据表中数据由表示,P<0.05为差异有统计学意义。
2 结 果
2.1 浓度递增筛选法体外诱导三苯氧胺耐药株TR5
细胞传代贴壁后,用10% FBS的DMEM高糖培养液稀释的浓度为1 μmol/L三苯氧胺溶液持续培养,在这过程中有死亡细胞悬浮在培养基,待细胞达到80%左右生长面积时,消化传代,待贴壁后,加入含同样浓度三苯氧胺的培养基培养,直到细胞再次达到80%左右生长面积时几乎无死亡细胞悬浮,此时可认为细胞适应了这个浓度,有持续的活性并且能稳定的增殖,这样得到了耐药株细胞TR1。冷冻保存一部分,然后对TR1继续提高浓度到2 μmol/L三苯氧胺诱导,同样直到细胞适应这个浓度,此时的细胞为TR2。以此类推,诱导出了耐药细胞TR3、TR4和TR5 (图1)。在上述筛选过程中,三苯氧胺每提高一个浓度时,都约有20%细胞死亡,TR5细胞株是耐药能力最强。
在光学显微镜下观察,我们发现TR5细胞在形态上与MCF-7细胞有所差异,TR5细胞有较多的分支且分支较长(图1)。

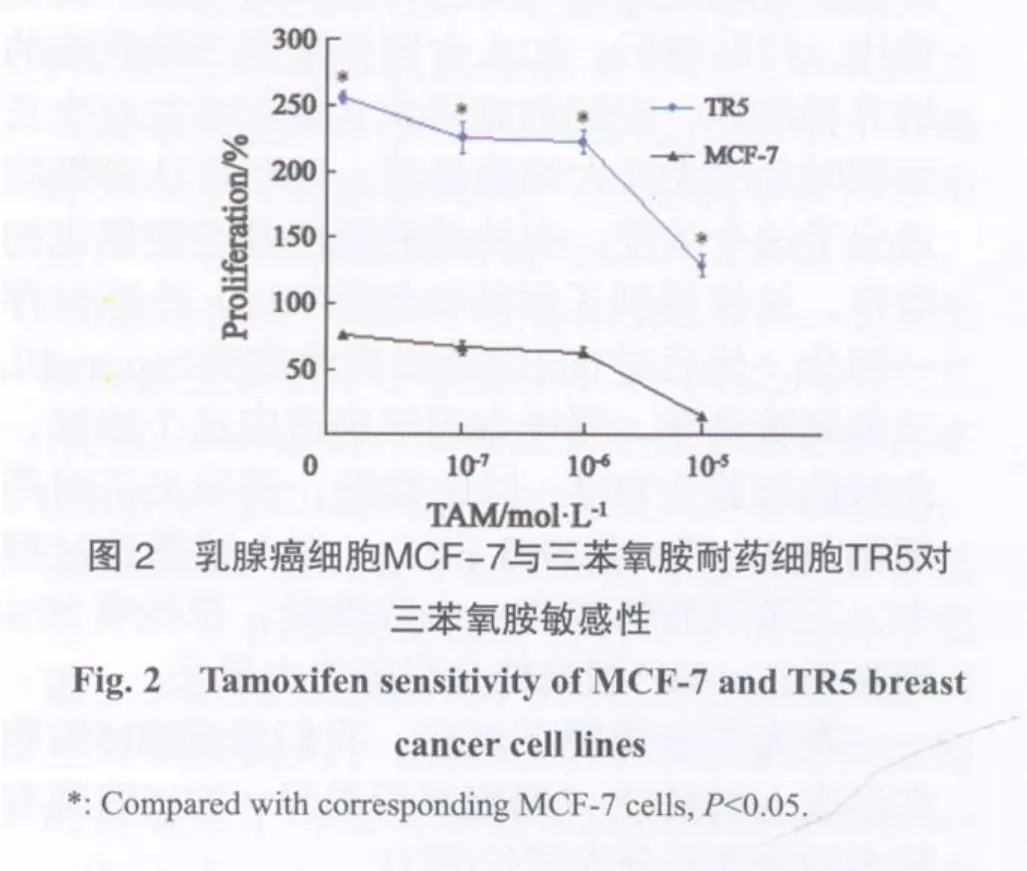
2.2 乳腺癌细胞MCF-7与三苯氧胺耐药细胞TR5对三苯氧胺敏感性
在4种不同浓度的三苯氧胺作用48 h后,结果显示随着三苯氧胺浓度的升高,MCF-7与TR5细胞增殖率均降低,在对照组不加三苯氧胺的情况下,MCF-7的增殖率为76.3%,而TR5达到了260%,是MCF-7细胞的3.4倍,三苯氧胺浓度分别在10-7和10-6mol/L浓度时,TR5的增殖率是MCF-7的3.4和3.5倍。在相对较高浓度10-5mol/L的三苯氧胺处理时,TR5细胞的增殖率达到了MCF-7的8.8倍(图2)。三苯氧胺的浓度越高,耐药细胞TR5与非耐药MCF-7细胞对三苯氧胺敏感性差异越大。以上两组细胞在同一浓度三苯氧胺处理时,增殖率差异均有统计学意义(P<0.05)。
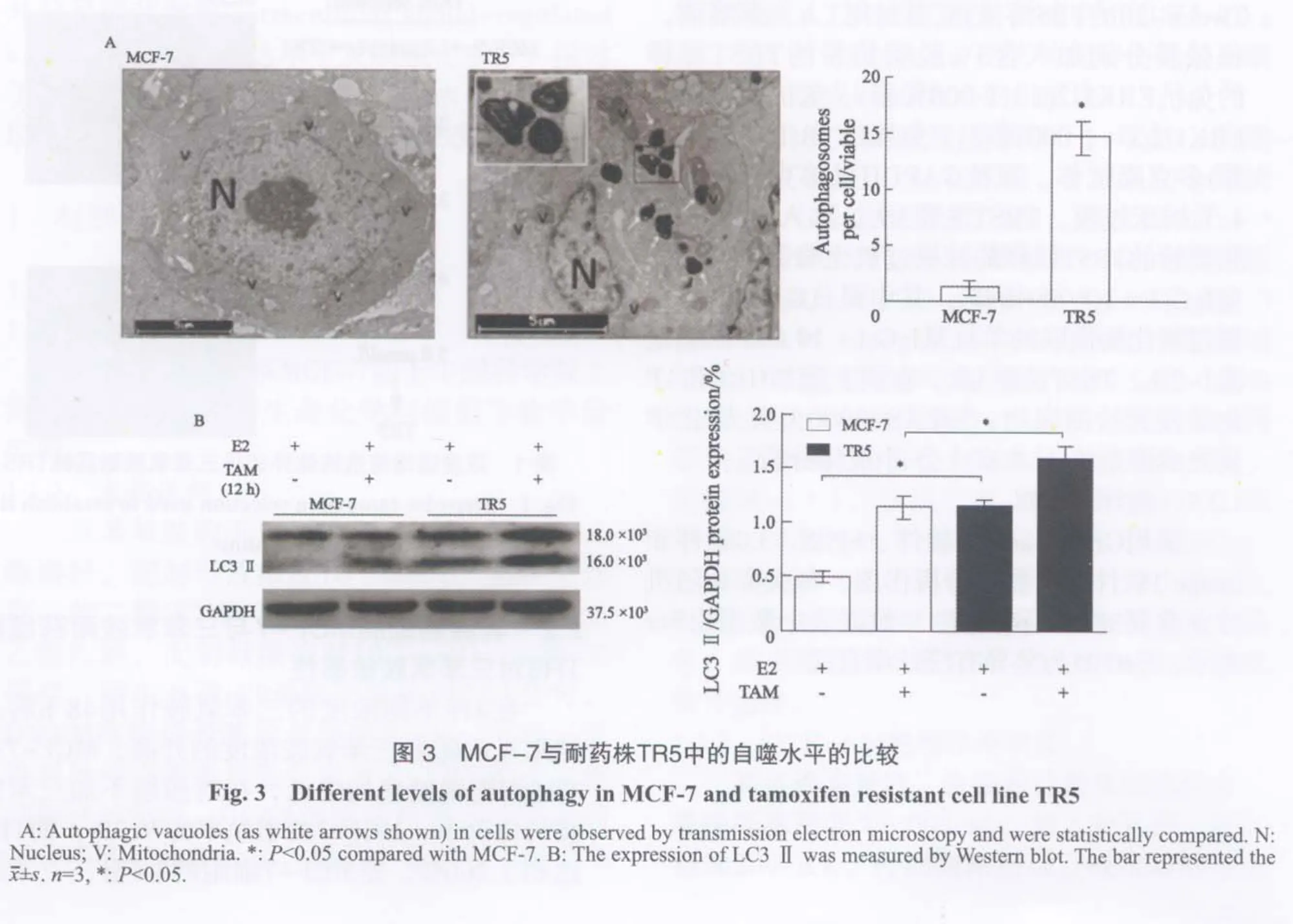
2.3 MCF-7与耐药株TR5中自噬水平的比较
透射电镜观察到在TR5细胞中有较多自噬泡(白色箭头所指),而在MCF-7细胞中几乎未看到自噬泡,其中N是细胞核,V是线粒体(图3A)。数据统计结果显示,耐药株TR5细胞中平均每个细胞中自噬泡数量可达15个左右,而平均每个非耐药株细胞MCF-7中只有1~2个自噬泡(图3A)。
Western blot检测LC3 Ⅱ蛋白表达,结果显示加入三苯氧胺后,MCF-7与TR5自噬蛋白水平均升高,耐药细胞TR5在E2与E2+三苯氧胺组中的LC3 Ⅱ表达量均显著高于MCF-7(图3B)。
2.4 人乳腺癌MCF-7与耐药细胞TR5的ERK1/2蛋白表达及磷酸化水平
加入三苯氧胺后,两种细胞的ERK1/2蛋白表达水平未见变化,但Phospho-ERK1/2蛋白表达水平均上升,即ERK1/2蛋白磷酸化水平升高。在E2组,TR5细胞中的Phospho-ERK1/2达到了MCF-7细胞的9倍;加入了TAM后,TR5中Phospho-ERK蛋白水平也明显高于MCF-7细胞(图 4)。

3 讨 论
本研究用浓度递增筛选法体外诱导出三苯氧胺耐药细胞,类似的方法也被用来建立耐4-羟基三苯氧胺MCF-7耐药株[7-8]。自噬对肿瘤细胞具有促进和抑制的双重作用,一方面自噬在抵御环境变化对细胞造成损伤的过程中起着重要的保护作用[9-10],另一方面在某些情况下,例如细胞的凋亡机制有所缺陷时,自噬也可以促进细胞死亡[10]。在筛选过程中,发现细胞把自噬作为一种保护自身的机制得以存活,并且直到适应了三苯氧胺浓度后才能进行增殖。阻断自噬可成为克服乳腺癌细胞对三苯氧胺耐药的一种新策略。
丝裂原活化蛋白激酶通路之一的ERK/MAPK信号转导通路的异常活化能够导致细胞丧失凋亡和分化的能力,促使细胞恶性转化,异常增殖,产生肿瘤,并能进一步促进肿瘤细胞的增殖[11]。
有研究报道,乳腺癌患者中产生三苯氧胺耐药与MAPK家族蛋白的表达有关[12-13]。本研究发现耐药株细胞中,MAPK家族蛋白ERK磷酸化水平明显高于非耐药株细胞。ERK信号转导通路的持续激活可促进细胞周期素D1的表达及其与细胞周期依赖性激酶4(cyclin dependent kinase 4,CDK4)结合,导致细胞由G1期向S期转化,从而促进细胞增殖[14],这与本研究结果耐药细胞增殖率明显高于非耐药细胞是相符的,同时也说明MAPK信号通路参与了细胞耐药的产生。抑制ERK蛋白磷酸化使其失活可成为阻碍细胞产生耐药的一种新方法,并且参与ERK信号通道的各级分子都有可能成为治疗乳腺癌的潜在靶分子,这不仅为乳腺癌的内分泌治疗提供潜在的作用靶点,而且为新的内分泌治疗模式提供了一定的理论基础。
[1]JORDAN V C, O’MALLEY B W. Selective estrogen-receptor modulators and antihormonal resistance in breast cancer[J]. J Clin Oncol, 2007, 25: 5815-5824.
[2]CARROLL J S, BROWN M. Estrogen receptor target gene:an evolving concept [J]. Mol Endocrinol, 2006, 20: 1707-1714.
[3]CAMPBELL F C, BLAMEY R W, ELSTON C W, et al.Quantitative oestradiol receptor values in primary breast cancer and response of metastases to endocrine therapy [J].Lancet, 1981, 2: 1317-1319.
[4]JAIYESIMI I A, BUZDAR A U, DECKER D A, et al. Use of tamoxifen for breast cancer: twenty-eight years later [J]. J Clin Oncol, 1995, 13: 513-529.
[5]MASSARWEH S, SCHIFF R. Resistance to endocrine therapy in breast cancer: exploiting estrogen receptor/growth factor signaling crosstalk [J]. Endocr Relat Caner, 2006, 13: S3-S13.
[6]RIGGINS R B, SCHRECENGOST R S, GUERRERO M S, et al. Pathways to tamoxifen resistance [J]. Cancer Lett, 2007,256: 1-24.
[7]SCHOENLEIN P V, PERIYASAMY-THANDAVAN S,SAMADDAR J S, et al. Autophagy facilitates the progression of ERalpha-positive breast cancer cells to antiestrogen resistance [J]. Autophagy, 2009, 5: 400-403.
[8]GADDY V T, DUPLANTIER J, THANDAVAN S P,et al. A role for macroautophagy in protection against 4-hydroxytamoxifen-induced cell death and the development of antiestrogen resistance [J]. Mol Cancer Ther, 2008, 7:2977-2987.
[9]FERRARO E, CECCONI F. Autophagic and apoptotic response to stress signals in mammalian cells [J]. Arch Biochem Biophys, 2007, 462: 210-219.
[10]YOSHIMORI T. Autophagy: paying charon’s toll [J]. Cell,2007, 128: 833-836.
[11]ADEYINKA A, NUI Y, CHERLET T, et al. Activated mitogen-activated protein kinase expression during human breast tumorigenesis and breast cancer progression [J].Clin Cancer Res, 2002, 8: 1747-1753.
[12]CUI Y, PARRA I, ZHANG M, et al. Elevated expression of mitogenactivated protein kinase phosphatase 3 in breast tumors: Amechanism of tamoxifen resistance [J]. Cancer Res, 2006, 66: 5950-5959.
[13]GUTIERREZ M C, DETRE S, JOHNSTON S, et al. Molecular changes in tamoxifen-resistant breast cancer: relationship between estrogen receptor, HER-2, and p38 mitogenactivated protein kinase [J]. J Clin Oncol, 2005, 23: 2469-2476.
[14]FIDDES R J, JANES P W, SIVERTSEN S P, et al. Inhibition of the MAP kinase cascade blocks heregulin-induced cell cycle progression in T-47D human breast cancer cells [J].Oncogene, 1998, 16: 2803-2813.
Studies on resistant induction of breast cancer cell MCF-7 to tamoxifenin vitro
MA Xiao-yu,LIU Zhe-bin, YU San-jian, LI Shuang, HOU Yi-feng, SHAO Zhi-min(Department of Breast Surgery, Cancer Hospital, Fudan University; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
HOU Yi-feng E-mail:yifenghoupitt@yahoo.com
Background and purpose:Tamoxifen (TAM), the pioneering selective estrogen receptor modulator (SERM), which blocks estrogen action by binding to the ER in breast cancers, has been used ubiquitously for endocrine therapy for the hormone-sensitive breast cancer. Intrinsic and acquired resistance to TAM limits the clinical use of TAM to a narrow therapeutic window and they are big challenges to the drug therapy for breast cancer patients.Better understanding of the TAM resistant mechanisms is therefore of considerable clinical significance. In our study,we induced breast cancer cell MCF-7 resistant to TAMin vitroand tried to explore the changes of autophagic levels and the expression of ERK (extracellular signal-regulated kinase, one of MAPK family proteins) and Phospho-ERK1/2 in TAM resistant cells compared with MCF-7 cells.Methods:Stepwise TAM selection was used to establish the TAM resistant TR5 subline. Autophagic vacuoles in cells were observed by means of transmission electron microscopy. The growth of the two cell lines were measured by CCK8, and the expression of LC3 Ⅱ, ERK1/2 and Phospho-ERK1/2 were measured by Western blot.Results:The TAM resistant cell line TR5 we established can be resistant to 5 μmol/L TAM. The number of autophagic vacuoles and the expression of LC3 Ⅱ protein in TR5 were obviously higher than that in MCF-7. There was no significant difference in the protein expression level of ERK1/2 between MCF-7 and TR5 cells, but the level of Phospho-ERK1/2 was markedly higher in TR5 cells than that in MCF-7 cells.Conclusion:TAM resistant MCF-7 cells have relatively high autophagic level and MAPK pathway is involved in facilitating TAM resistance.
book=422,ebook=298
Breast cancer; Tamoxifen; MCF-7; Autophagy
10.3969/j.issn.1007-3969.2011.06.001
R737.9
A
1007-3639(2011)06-0421-06
上海市科委浦江人才计划(No:09PJ1402700);国家自然科学基金(No:81072165)。
侯意枫 E-mail:yifenghoupitt@yahoo.com
2011-03-24
2011-05-20)
