固载salen Co的制备及其催化环氧氯丙烷拆分
2011-05-28蒋成君
蒋成君
(浙江科技学院生物与化学工程学院,杭州310023)
手性salen Co催化水解动力学拆分末端环氧化合物在工业上有广泛的应用[1-4],均相salen Co催化剂以分子或离子形式起作用,具有高活性和高选择性。但是均相salen催化剂在反应中极易失活[5-6],且存在催化剂分离与重复利用难等问题[7]。从分离的角度来看,手性salen催化剂的非均相化变得尤为重要,近年来人们合成了各种多相salen Co催化剂[8]。1999年,Jocobsen小组[9]将手性配体连接到衍生化的PS聚合物上,2006年,郑晓来等[10]通过活性自由基聚合合成聚苯乙烯负载的salen Co催化剂。最近,李灿等[11]在负载salen催化剂方面做了重要而系统的工作,巧妙地将salen Co催化剂封装在SBA-16的纳米笼中,从而大大提高了水解动力学拆分环氧化合物的活性,在底物与催化剂之比为4 000的条件下,反应12 h,环氧化合物的ee值达到96%,二醇的ee值达到98%。但是这些催化剂制备过程复杂,其工业应用受到一定限制。
壳聚糖(图1)是甲壳素脱乙酰化的产物,无毒、无害、易于降解,其本身具有分子载体的优势,不溶于普通溶剂,易于回收再利用,最近几年得到了广泛的应用[12]。
图1 壳聚糖的结构Fig.1 Structure of chitosan
本研究设计了壳聚糖固载salen Co(Ⅲ)(CF3COO)的合成路线(图2),合成含阴离子CF3COO-配体的催化剂,期望在手性二胺桥、刚性环和双金属的共同作用下,催化剂能表现出良好的催化活性和对应选择性。
采用核磁共振(NMR)、傅里叶变换红外光谱(FTIR)、等离子发射光谱(ICP)和元素分析等手段,对配体和催化剂进行表征,并将催化剂应用于环氧氯丙烷的水解动力学拆分。
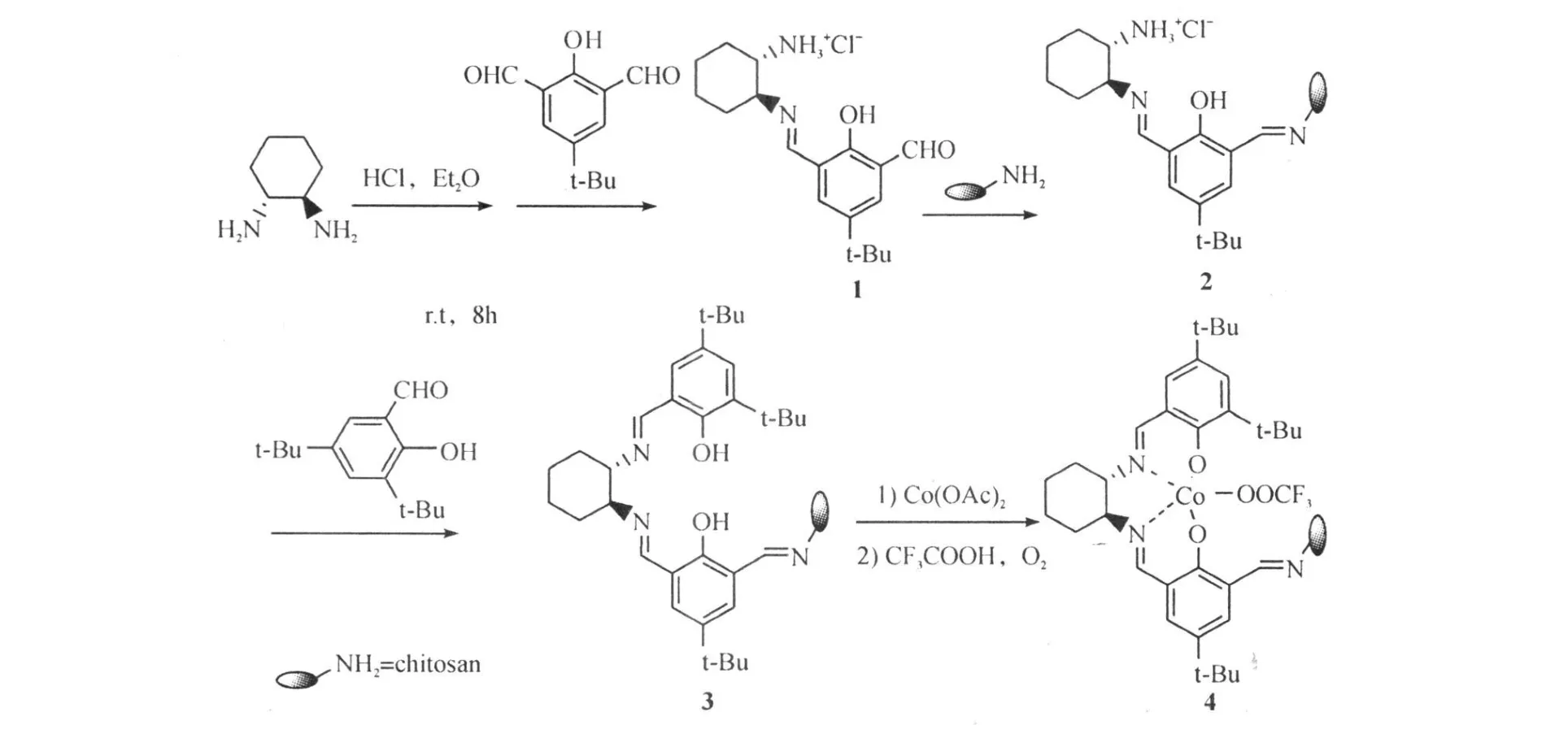
图2 壳聚糖固载salen Co(Ⅲ)(CF3 COO)的合成路线Fig.2 Synthesis of chitosan supported salen Co(Ⅲ)(CF3 COO)complexes
1 实验部分
1.1 试剂与仪器
(R,R)-1,2-环己二胺购于Adrich;壳聚糖(脱乙酰度≥98.0%);2,6-二甲酰基-4-叔丁基苯酚(自制);实验所用其他试剂均为分析纯,溶剂在使用前均按常规方法精制。
SICT GC-920气相色谱仪;GAMMA DEXTM225手性毛细管柱;DXX-500核磁共振仪;Nicolet傅立叶红外光谱仪,美国热电IRIS IntrepidⅡXSP等离子体发射光谱仪,Flash EA-1112元素分析仪。
1.2 手性salen Co催化剂的合成
1.2.1 2 ,6-二甲酰基-4-叔丁基苯酚的合成
在500 mL带有机械搅拌装置的三口烧瓶中加入60.00 g(0.42 mol)的P2O5,滴加40 mL 87%的H3PO4,待H3PO4滴加完毕,在100℃下反应3.5 h后再加热至120℃反应1 h。加入11.80 g(0.08 mol)对叔丁基苯酚和16.60 g(0.12 mol)六次甲基四胺,反应5 h,冷却至室温后,加入200 mL水,水蒸汽蒸馏,冷凝管中有淡黄色固体析出,用乙醚溶解后蒸干,用石油醚重结晶,得到淡黄色的晶体12.35 g,温度100~102℃(文献值[13]95~96℃)。元素分析,C12 H 14 O3,计算值(%):C,69.90;H,6.79。实测值(%):C,69.80;H,6.74。1HNMR(CDCl3,TMS,δ):1.32(9H,s, —CH 3),7.96(2H,s,Ar-H),10.21(2H,s,—CHO),11.41(1H,s,—OH)。
1.2.2 化合物1的合成
在500 mL三口烧瓶中加入200 mL甲醇,边搅拌边加入15.10 g(0.1 mol)(R,R)-1,2-环己二胺单盐酸盐。待环己二胺盐酸盐完全溶解在甲醇溶液中,再加入20.60 g(0.1 mol)2,6-二甲酰基-4-叔丁基苯酚。室温下搅拌反应16 h,减压抽滤,滤饼用200 mL水、300 mL乙醚洗涤,干燥,得到黄色晶体33.80 g。元素分析,C18H27ClN2O2,计算值(%):C,63.80;H,8.03。实测值(%):C,63.80;H,8.00。IR(KBr):ν=3 423,2 923,2 865,2 553,1 687(s,CN),1 659,1 599,1 454,1 229,1 034。1HNMR(CDCl3,TMS,:1.34(9H,s, —CH 3),1.39(4H,m,—CH2),1.63(2H,m, —CH 2),2.02(2H,m,—CH 2),3.5(H,m,—CH),3.7(H,m,—CH),6.01(1H,s,—OH),7.10(3H,s,NH 3),7.70(H,s,Ar—H),7.76(H,s,Ar—H),8.10(H,s,—CH),10.22(H,s,—CHO)。
1.2.3 配体3的合成
将上述33.80 g(0.1 mol)化合物1加入到200 mL乙醇中,搅拌让其完全溶解,加入30 mL三乙胺,10.00 g壳聚糖,回流6 h后,抽滤,滤饼用氯仿、甲醇洗涤,干燥,得到黄色片状固体,将23.40 g(0.1 mol)3,5-二叔丁基水杨醛溶于200 mL乙醇中,加入上述黄色片状固体,在乙醇溶液中回流8 h,待溶液冷却后抽滤,得黄色片状固体10.51 g。元素分析,(C41 H 57 N3O7)n,计算值(%):C,69.00;H,7.99。实测值(%):C,69.10;H,8.00。IR(KBr):ν=3 366,2 918,2 870,1 642(s,CN),1 599,1 421,1 379,1 325,1 153,1 075(s,chitosan backbone),1 032,897。
1.2.4 以三氟醋酸为轴向阴离子的催化剂的合成
称取0.20 g配体与0.25 g Co(OAc)2◦4H 2O在乙醇溶液中回流8 h,抽滤得棕褐色片状固体。将得到的棕褐色片状固体与1 mL三氟醋酸,在二氯甲烷中通氧气状态下反应4 h,抽滤,干燥得到黑色片状固体0.22 g,ICP测定的钴含量为13.1%,IR(KBr):ν=3 401,3 358,2 929,2 868,1 634,1 563,1 408,1 073,896,654。
1.3 水解动力学拆分环氧氯丙烷
在250 mL三口圆底烧瓶中加入0.000 5 mol催化剂(以ICP测定的钴含量计算),然后加入18.30 g(0.2 mol)外消旋环氧化合物和100 mL四氢呋喃,20℃下将2 mL(0.11 mol)的水滴加到反应混合物中,间隔一定时间取样,气相色谱分析,柱温50℃,检测器温度130℃,气化室温度130℃。
2 结果与讨论
2.1 水解动力学拆分环氧氯丙烷
salen Co(Ⅲ)(CF3COO)与salen Co(Ⅲ)OAc比较的结果如图3所示。
从图3可以看出,在20℃,催化剂用量为0.25 mol%,水用量为环氧氯丙烷0.55倍条件下,salen Co(Ⅲ)(CF3COO)显示了较优越的催化效果。CS-salen Co(Ⅲ)(CF3COO)催化水解动力学拆分反应2 h,环氧氯丙烷ee值达到78.0%,反应8 h,CS-salen Co(Ⅲ)(CF3COO)催化的反应,环氧氯丙烷 ee值达到 99.8%。这说明CS-(salen)Co(Ⅲ)(CF3COO)在催化此类反应时活性并没有降低。据分析是因为壳聚糖本身所具有的手性的、链状的结构促使反应按一定的取向进行[14-16]。
2.2 催化剂的循环使用
回收后催化剂的催化效果直接决定了催化剂的品质。通常水解动力学拆分用催化剂salen Co(Ⅲ)(OAc)的回收主要有以下2种方法:一是待反应完全后,还原三价的钴,高真空室温蒸馏收集产物(S)-环氧氯丙烷,然后再减压蒸馏收集3-氯-1,2-丙二醇,将剩余的催化剂回收;二是待反应完全后,还原三价的钴,高真空室温蒸馏收集产物(S)-环氧氯丙烷,然后加水萃取,得到3-氯-1,2-丙二醇和回收的催化剂。不同于传统的均相salen Co(Ⅲ)(OAc)催化剂,壳聚糖固载的CS-salen Co(Ⅲ)(CF3COO)可以通过简单的过滤得到,催化剂的回收率为95%。回收后的催化剂依然可用上述反应条件参与催化。
考察了催化剂在回收后直接使用及再生使用两种情况。
2.2.1 催化剂在回收后直接使用
取反应温度20℃,水的用量为环氧氯丙烷的0.55倍,催化剂用量为外消旋环氧氯丙烷的0.25 mol%进行反应,与回收前salen催化剂比较,实验结果如图4所示。
由图4可以看出,第一次使用时,反应10 h,可获得ee值为99.8%的环氧氯丙烷,第二次使用时可获得ee值为95.0%的环氧氯丙烷,当第四次使用时仅仅可获得ee值为88.2%的环氧氯丙烷,催化剂在使用过程中活性不断下降。
2.2.2 催化剂在回收后经过再生再重复使用
再生的方法即是重新络合酸,取反应温度20℃,水的用量为环氧氯丙烷的0.55倍,催化剂用量为外消旋环氧氯丙烷的0.25 mol%进行反应,与回收前salen催化剂比较,实验结果如图5所示。
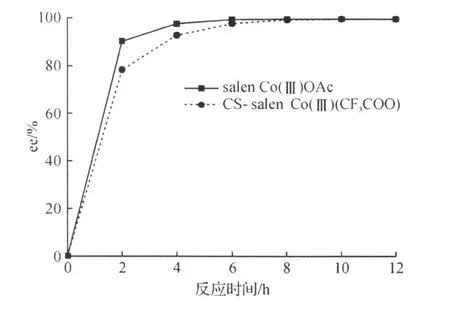
图3 不同催化剂催化水解动力学拆分环氧氯丙烷Fig.3 HKRof ECH catalyzed by different catalysts
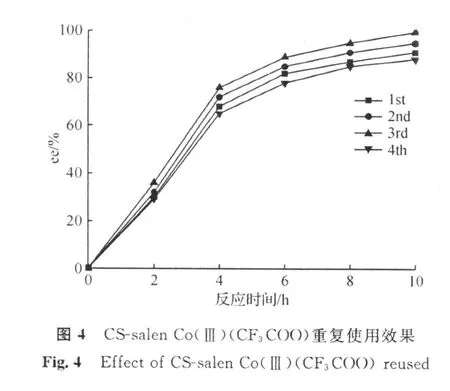
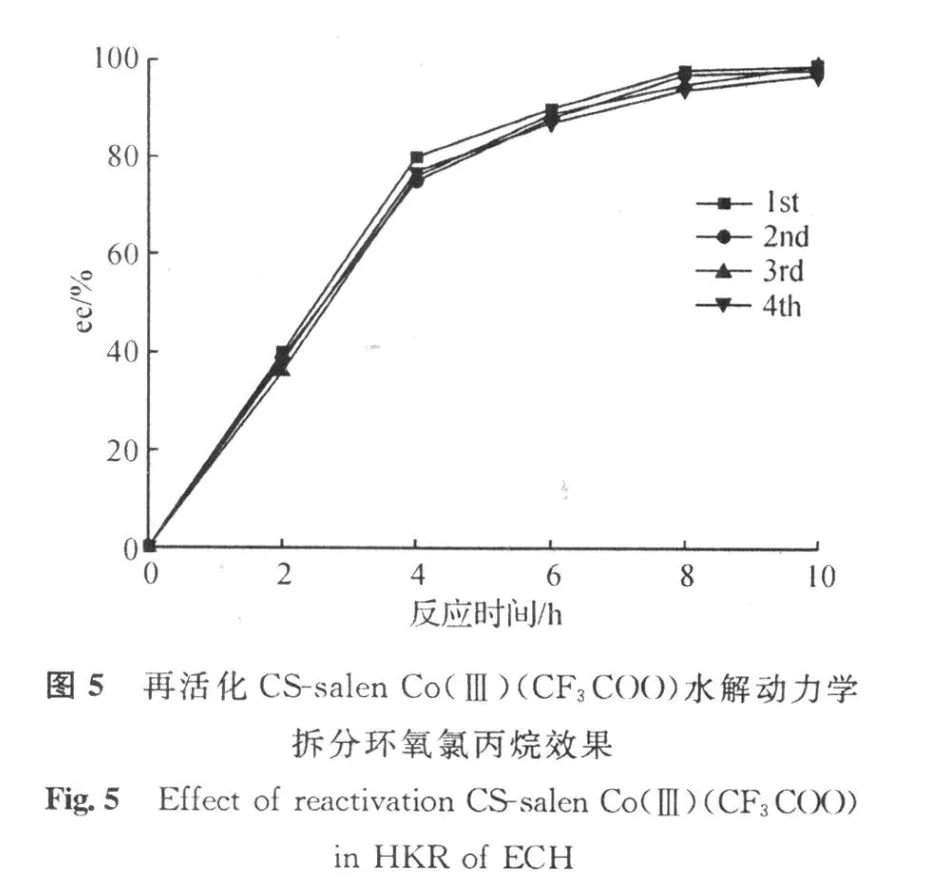
由图5可以看出,回收的催化剂经过活化,反应10 h,均可获得高光学纯的环氧氯丙烷。通过回收催化剂的催化效果比较,可以看出,催化剂回收后如果不经过再生,则催化剂的选择性略有降低,而再生后的催化效果依然明显,产物(S)-环氧氯丙烷的ee值依然能够达到97%以上。通过催化剂活化后催化剂的活性略有下降的现象推出催化剂失活的原因可能是在反应过程中络合Lewis酸的结构被破坏。
3 结 语
为了解决催化剂在反应后不易回收的难题,本研究合成了壳聚糖固载的手性CS-salen Co(Ⅲ)(CF3COO)催化剂,并催化环氧氯丙烷的水解动力学拆分。得到如下结论:CS-salen Co(Ⅲ)(CF3COO)都有很好的催化活性,反应温度20℃,水的用量为环氧氯丙烷的0.55倍,催化剂用量为外消旋环氧氯丙烷的0.25 mol%,反应8 h,手性环氧氯丙烷的ee值达到99.8%。反应完后催化剂可以通过过滤得以简单方便地分离,回收的催化剂如果不经活化,则其选择性有所降低,而再生后的催化剂效果依然明显,产物手性环氧氯丙烷的ee值在相同反应条件下仍可达到97%以上,工业上有一定的应用前景。
[1] LARROW J F,HEMBERGER K E,JASMIN S,et al.Commercialization of the hydrolytic kinetic resolution of racemic epoxides:Toward the economical large-scale production of enantiopure epichlorohydrin[J].Tetrahedron:Asymmetry,2003,14(22):3589-3592.
[2] BLASER H U,SCHIM IDT E.Asymmetric catalysis on industrial scale:Challenges,approaches and solutions[M].Wiley-VCH:Weinheim,2004:165.
[3] SCHAUS S E,LARROW J F,JACOBSEN E N.Practical synthesis of enantiopure cyclic 1,2-amino alcohols via catalytic asymmetric ring opening of meso epoxides[J].JOrg Chem,1997,62(12):4197-4199.
[4] BALEIZAO C,GARCIA H.Chiral salen complexes:An overview to recoverable and reusable homogeneous and heterogeneous catalysts[J].Chem Rev,2006,106(9):3987-4043.
[5] BELSER T,JACOBSEN E N.Cooperativecatalysis in the hydrolytic kinetic resolution of epoxides by chiral[salen Co(Ⅲ)]complexes immobilized on gold colloids[J].Adv Synth catal,2008,350(7/8):967-971.
[6] BEIGI M,ROLLER S,HAAG R,et al.Polyglycerol-supported Co-and Mn-salen complexes as efficient and recyclable homogeneous catalysts for the hydrolytic kinetic resolution of terminal ekoxides and asymmetric olefin epoxidation[J].Eur J Org Chem,2008(12):2135-2141.
[7] 李煜,陈志荣,尹红.水解动力学拆分合成手性环氧氯丙烷用催化剂研究[J].工业催化,2006,14(4):42-46.
[8] 蒋成君,陈志荣.手性(salen)Co配合物的合成及其在水解动力学拆分中的应用[J].化学进展,2008,20(9):1294-1305.
[9] ANNIS D A,JACOBSEN E N.Polymer-supported chiral Co(salen)complexes:Synthetic applications and mechanistic investigations in the hydrolytic kinetic resolution of terminal epoxides[J].JAm Chem Soc,1999,121(17):4147-4154.
[10] ZHENG X L,JONESC W,WECK M.Poly(styrene)-supported Co-salen complexes as efficient recyclable catalysts for the hydrolytic kinetic resolution of epichlorohydrin[J].Chem Eur J,2005,12(2):576-583.
[11] YANG H Q,ZHANG L,ZHONG L,et al.Enhanced cooperative activation effect in the hydrolytic kinetic resolution of epoxides on[Co(salen)]catalysts confined in nanocages[J].Angew Chem Int Ed,2007,46(36):6861-6865.
[12] JIANG C J,XU M Q.Kinetics of heterogeneous deacetylation ofβ-Chitin[J].Chem Eng Techno,2006,29(4):511-516.
[13] 陈展虹.2,6-二甲酰基-4-叔丁基苯酚的合成[J].新疆教育学院学报,1998(1):65-66.
[14] READY J M,JACOBSEN E N.Highly active oligomeric(salen)Co catalysts for asymmetric epoxide ring opening reactions[J].J Am Chem Soc,2001,123(11):2687-2688.
[15] READY J M,JACOBSEN E N.A practical oligomeric(salen)Co catalyst for asymmetric epoxide ring opening reactions[J].Angew Chem Int Ed,2002,41(8):1374-1377.
[16] WHITE D E,JACOBSEN E N.New oligomeric catalyst for the hydrolytic kinetic resolution of terminal epoxides under solvent-free conditions[J].Tetrahedron Asymmetry,2003,14(22):3633-3638.
