甲基磺酸乙酯对烤烟种子发芽率的处理效应
2011-05-25王军伟蒋彩虹宋志美王元英刘贯山
王军伟,蒋彩虹,宋志美,张 丽,王 鲁,王元英,刘贯山*
(1.中国农业科学院烟草研究所,农业部烟草类作物质量控制重点开放实验室,青岛 266101;2.中国农业科学院研究生院,北京 100081)
诱变育种是人为利用物理或化学因素来处理种子、植株、组织、细胞或花粉使其基因型产生遗传变异,从中选择培育新品种的方法[1]。物理诱变应用较多的是辐射诱变,即用 γ射线、β射线、χ射线、中子等物理因素诱发变异。其诱因是高能射线造成基因突变、染色体结构变异。化学诱变是用化学诱变剂如甲基磺酸乙酯(Ethyl Methane Sulfonate, EMS)、硫酸二乙酯等烷化剂或碱基类似物等处理植物材料,以诱发遗传物质的突变,从而引起形态特征的变异,然后根据育种目标,对这些变异进行鉴定、培育和选择,最终育成新品种。EMS由于其操作简便,成本较低,诱变效果具有一定专一性和破坏性较小,诱变频率高,突变性状多为显性基因控制,易于筛选[2],染色体畸变相对较少[3]等优点,被有效用于各种作物的诱发突变育种,已育成的水稻、小麦、大麦和大豆[4]等突变体达2250个[5]。目前,关于EMS处理烟草的诱变育种研究报道还不多,陈廷俊等[6]利用0.3% EMS处理烟草Burley18的花培单倍体幼苗心叶,并接种 CMV,结合绿岛组织培养技术,筛选出抗CMV的细胞突变系R2和R3。Medrano H等[7]研究发现,经0.1%浓度处理1 h和0.05%浓度处理1~2 h的烟草花药,对提高花粉脱分化小植株的数量最有效。
本试验以EMS作为诱变剂,通过探讨EMS对烟草种子发芽率、根长等性状的诱变效应,以期为开展烟草种子化学诱变研究,构建烟草突变体库奠定基础。
1 材料与方法
1.1 试验材料
供试材料为烤烟主要品种:中烟 100、红花大金元、K326、云烟 97、云烟 87。种子由中国农业科学院烟草研究所种质资源库提供。EMS诱变剂购自SIGMA公司,规格为5G。
1.2 处理浓度与方法
处理浓度分别为0(CK)、0.1%、0.3%、0.5%、0.7%、0.9%、1.1%和1.3%。处理方法是将pH 6.5的0.01 mol/L磷酸盐缓冲液(Na2HPO4·12H2ONaH2PO4·H2O)[8]作为溶剂,配制浓度为 0(CK)、0.1%、0.3%、0.5%、0.7%、0.9%、1.1%和1.3%的EMS溶液(V/V)。称取供试种子各1 g,用纯水浸种4 h。用滤纸吸干种子表面的水后,将种子分别加到装有500 μL上述浓度EMS溶液的EP管中,放置于26 ℃、110 rpm的摇床内,诱变处理16 h。诱变处理后,用pH 6.5的0.01 mol/L磷酸缓冲液润洗,每隔0.5 h换一次磷酸缓冲液,洗3次后用长流自来水冲洗2 h左右。然后将种子点播于铺有滤纸的培养皿中,每个处理重复4次,在26 ℃培养箱中培养。第14天调查发芽率[9],第30天统计根长。发芽率/%=(14 d发芽种子数/供试种子数)×100%;相对发芽率指处理的发芽率/对照的发芽率。相对根长指处理的根长/对照的根长。在不同浓度EMS处理烤烟种子后,以相对发芽率为0.5时的EMS处理浓度即半致死浓度(Lethal concentration 50, LC50)为标准,探究EMS的适宜处理浓度。
1.3 数据分析
对试验中的种子发芽率和种苗根长进行调查,结果用 SPSS 11.5[10]及 SAS 9.1[11]数据软件进行分析。
2 结 果
2.1 EMS对烤烟发芽率的影响
半致死浓度(LC50)指处理后种子或植物的某一器官成活率为对照50%的处理浓度。一般以半致死浓度为基准,通过增加或降低试验剂量以选择适宜处理浓度[12]。由表1和图1可以看出,与CK相比,全部 EMS处理对烟草种子的发芽率均有较大影响。不同品种对 EMS的敏感性不同,但总趋势都是随着EMS浓度的升高,相对发芽率直线下降。在0.1%~0.5%浓度区间内随EMS处理浓度的升高,发芽率下降的幅度较小,而在0.7%~1.3%浓度区间内随 EMS处理浓度的升高,发芽率下降的幅度较大。5个品种的下降幅度不同,K326下降幅度最小,中烟100、红花大金元、云烟87次之,云烟97下降幅度最大。当EMS浓度达1.3%时,发芽率全部为0,说明5个烤烟品种的致死浓度均为1.3%。
差异显著性分析表明,同一烤烟品种不同EMS浓度的发芽率间差异显著,不同烤烟品种同一EMS浓度的发芽率间也有显著差异(CK和1.3%EMS浓度除外),而且前者的差异程度大于后者,这说明EMS浓度是造成供试种子发芽率变化的主要因素,但存在有基因型差异。
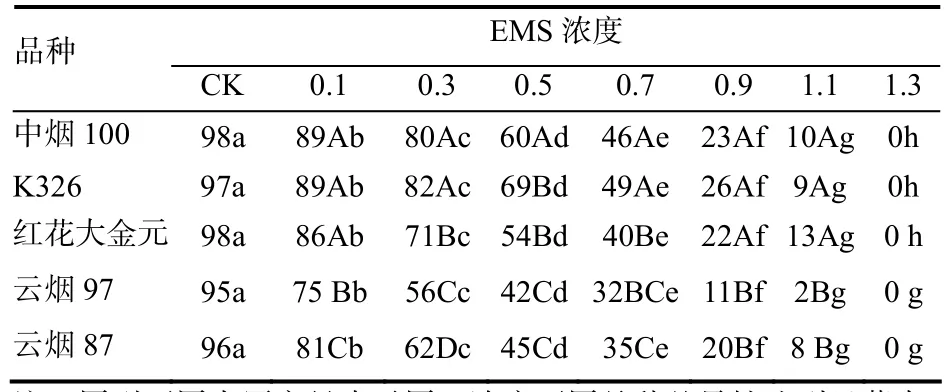
表1 不同品种经EMS处理后烤烟的发芽率 %Table1 Germination rate of different flue-cured tobacco varieties treated by various EMS concentrations
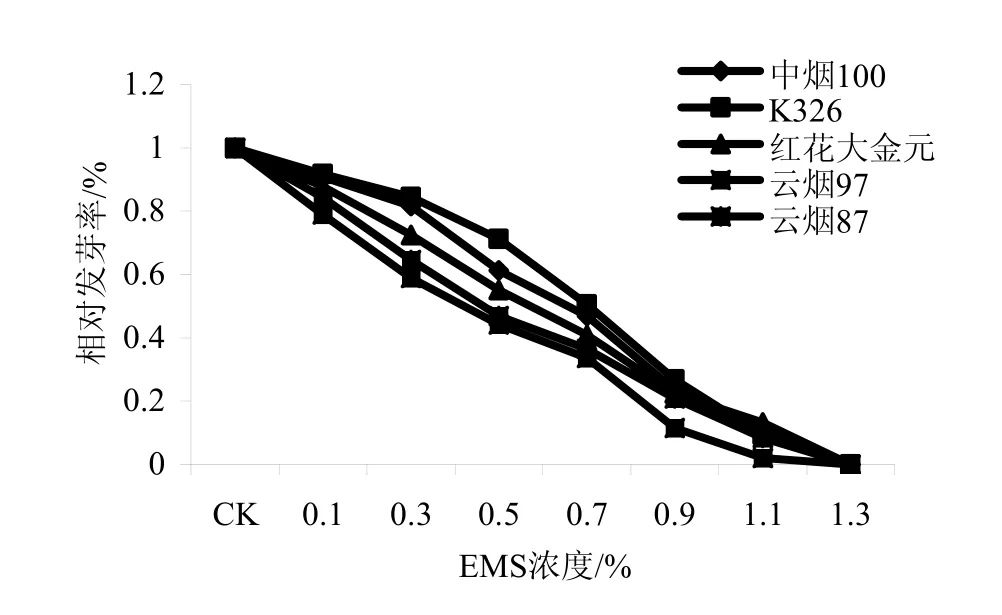
图1 不同浓度EMS处理后供试品种的相对发芽率Fig.1 Relative germination rate of various cultivars treated by different EMS concentrations
通过逐步回归分析,获得了5个烤烟品种发芽率随EMS浓度变化的回归方程(表2)。可以看出,发芽率与 EMS浓度呈显著负相关。由回归方程可以计算出,中烟100、K326、红花大金元、云烟87和云烟 97的 EMS LC50分别为 0.49%、0.52%、0.43%、0.35%和0.35%。从图1中也可以直观地看出,云烟87和云烟97的EMS LC50是一致的,但比中烟100、K326和红花大金元的低,其中K326的最高。由此可以认为,供试烤烟品种对 EMS的敏感性由大到小依次为云烟 87=云烟 97>红花大金元>中烟 100>K326。
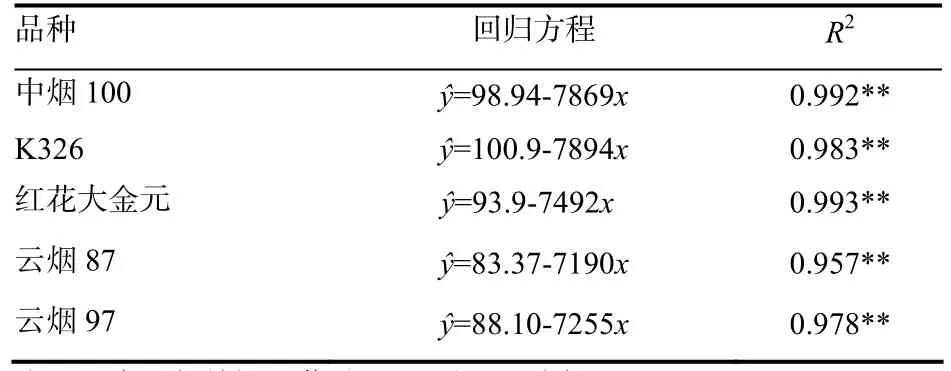
表2 5个烤烟品种的发芽率和EMS浓度的回归方程Table2 Regression equations between germination rate and EMS concentrations for five flue-cured tobacco varieties
2.2 EMS对烤烟种苗根长的影响
由表3和图2看出,浓度为0.1%的EMS对各品种种苗根长均有促进作用。中烟100、K326、红花大金元、云烟97、云烟87的种苗根长分别比CK增长了6.77%、4.74%、5.37%、2.52%、1.18%。随着 EMS浓度进一步提高,根长受到抑制,且损伤程度随着 EMS浓度的逐步增加而加大。其中随EMS浓度增大,K326的根长与CK相比减短最小,中烟100、红花大金元、云烟87次之,云烟97减短最大。
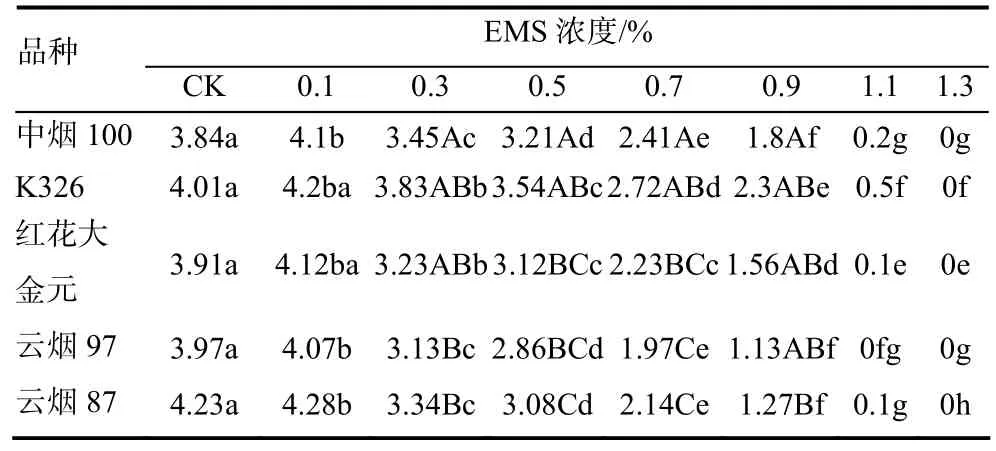
表3 不同浓度EMS处理后供试品种种苗根长 cmTable3 Root lengths of various cultivars treated by different EMS concentrations
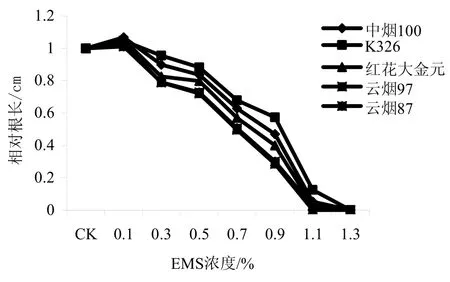
图2 不同浓度EMS处理后5个烤烟品种的种苗相对根长Fig.2 Relative root lengths of five flue-cured tobacco varieties treated by different EMS concentrations
虽然同一品种不同 EMS浓度的种苗根长之间以及不同品种同一 EMS浓度(CK、1.1%和1.3%EMS浓度除外)的种苗根长之间均达到显著差异,但根长的差异程度要小于发芽率。通过逐步回归分析,也获得了5个烤烟品种根长随EMS浓度变化的回归方程,种苗的根长与 EMS浓度呈显著负相关(表4)。

表4 5个烤烟品种的种苗根长和EMS浓度的回归方程Table4 Regression equations between root length and EMS concentrations for 5 flue-cured tobacco varieties
3 讨 论
目前,烟草诱变育种多采用γ射线[13]、离子注入[14]等物理方法,关于烟草化学诱变特别是 EMS诱变处理的报道较少。本试验选取5个烤烟栽培品种中烟 100、红花大金元、K326、云烟 97、云烟87进行不同 EMS浓度处理。结果表明,在0.1%~1.3%处理的浓度范围内,EMS对种子的发芽率主要呈抑制作用。以半致死浓度为选择标准,确定了 EMS诱变烤烟不同品种的适宜浓度为0.35%~0.52%,致死浓度均为 1.3%。它们对 EMS的诱变敏感性顺序为云烟 87=云烟 97>红花大金元>中烟 100>K326。Julio E 等[15]采用白肋烟(BB16NN)为材料,以种子处理后7 d的发芽势降低25%~40%为筛选条件,选择的EMS适宜处理浓度为0.6%和0.8%。史跃伟等[16]以烤烟(K346、NC82和云烟 85)为材料,得出 EMS适宜的诱变浓度为0.35%,且3个品种对EMS的诱变敏感性顺序为云烟85>K346≈NC82。本试验得到的烤烟适宜EMS诱变浓度比拟南芥的适应浓度0.2%[17]要高,与大豆的适应浓度 0.4%[18]接近,比小麦的适应浓度0.9%或1.0%[19]和水稻的适应浓度1.5%[20]的要低的多,与史跃伟等[16]得到的烤烟 EMS诱变适宜浓度0.35%接近,但比其稍高。因此,在对植物种子进行处理时,不同种植物之间,同种植物不同类型(例如烤烟和白肋烟)之间以及同种类型(例如烤烟)不同品种之间 EMS诱变的适宜浓度以及对EMS的敏感性均存在显著差异。
通过差异显著性分析发现,同一烤烟品种不同EMS浓度的发芽率间差异显著,说明EMS浓度是影响烤烟种子发芽率的主要因素;而不同烤烟品种同一 EMS浓度烤烟种子的发芽率也有显著差异(CK和1.3%EMS浓度除外),可见品种也是影响EMS处理种子发芽率的关键因素。但是前者的差异程度大于后者,因而在进行 EMS诱变处理时,针对不同的烟草品种类型要分别摸索其适宜的 EMS浓度。
试验表明,低浓度处理对种子发芽率和种子根的伸长有促进作用,高浓度处理对种子发芽率和种子根的伸长均呈显著抑制作用。原因可能是低浓度的 EMS能促进细胞的呼吸作用,生理代谢增强,从而促进其生长分化;而高浓度的 EMS则对烟草的生理代谢有抑制作用,且浓度越高代谢受到的抑制作用越强。
烤烟 EMS诱变适宜浓度的获得为创建烟草突变体库奠定了基础,后续研究也得到了许多不同表型的突变体。这些突变材料可用于克隆和阐明烟草的重要功能基因,是烟草功能基因组学研究中不可缺少的重要组成部分[21]。还可直接育成烟草新品种或创造新的烟草种质资源,极大丰富烟草的遗传资源。
[1]中国农业科学院烟草研究所.中国烟草栽培学[M].上海:上海科学技术出版社,2005.
[2]安学丽,蔡一林,王久光,等.化学诱变及其在农作物育种上应用[J].核农学报,2003,17(3):239-242.
[3]Greene E A, Codomo C A, Taylor N E, et al.Spectrum of chemically induced mutations from a large-scale reverse genetic screen in Arabidopsis[J].Genetics, 2003, 164:731-740.
[4]韩锁义,杨玛丽,陈远东,等.大豆“南农94-16”突变体库的构建及部分性状分析[J].核农学报,2008(2):131-135.
[5]Ahloowalia B S, Maluszynski M, Nichterlein K.Global impact of mutation-derived varieties[J].Euphytica, 2004,135: 187-204.
[6]陈廷俊.烟草抗CMV细胞突变系筛选系统研究[J].植物保护学报,1997,24(4):317-320.
[7]Medrano H, Millo E P, Guerri J.Ethyl-methane-sulphonate effects on anther cultures of Nicotiana abacum[J].Euphytica, 1986, 35: 161-168.
[8]薛万新.种子生理学[D].西安:西北农业大学,1998.
[9]杨春雷,林国平,杨久红,等.烟草种子渗透调节技术及机理研究[J].中国烟草学报,2009,15(2):50-54.
[10]贾春生.利用 SPSS软件计算杀虫剂的 LC50[J].昆虫知识,2006,43(3):414-417.
[11]曹建敏,邱军,杨德廉,等.不同等级烤烟多酚含量及其规律性分析[J].中国烟草科学,2009,30(6):21-24.
[12]西南农业大学.蔬菜育种学[M].北京:农业出版社,1980:139.
[13]佟道儒,贾兴华.γ射线诱变烟草花药培养的突变体[J].核农学报,1991,5(4):193-198.
[14]殷凤生,林国平,孙学永,等.离子注入对烟草种子萌发及苗期生长发育的影响[J].中国烟草科学,1999,20(2):15-19.
[15]Julio E, Laporte F, Reis S, et al.Reducing the content of nornicotine in tobacco via targeted mutation breeding[J].Mol Breed, 2008, 21: 369-381.
[16]史跃伟,任学良,王轶,等.γ射线与EMS单一及复合处理对烤烟种子活力的诱变效应[J].贵州农业科学,2009,37(12):62-65.
[17]赵淑清.一种筛选拟南芥突变体的有效方法[J].遗传,2001,23(3):260-262.
[18]陈远东,喻德跃.EMS诱发大豆“南农94-16”突变体库的扩建及部分突变体的 SSR分析[J].大豆科学,2009,28(4):574-582.
[19]Uauy C, Paraiso F, Colasuonno P, et al.A modified TILLING approach to detect induced mutations in tetraploid and hexaploid wheat[J].BMC Plant Biol, 2009,9: 115.
[20]Till B J, Cooper J, Tai T H, et al.Discovery of chemically induced mutations in rice by TILLING[J].BMC Plant Biol, 2007, 7: 19.
[21]蔡刘体,郑少清,胡重怡,等.烟草突变体库及其在功能基因组研究中的应用[J].中国烟草科学,2008,29(6):27-31.
