抑制性消减杂交技术(SSH)及其在烟草生物学研究中的应用
2011-05-25李立芹鲁黎明
李立芹,鲁黎明
(四川农业大学农学院,四川 雅安 625014)
科学研究表明,基因的选择性差异表达决定植物的生长、发育、衰老、死亡、对逆境的适应等生理过程。分离差异表达基因对于了解和揭示植物体的生长、发育规律,进而有针对性地对生物性状进行改良具有重要意义。近年来随着 PCR技术的兴起,出现了许多基于PCR的分离差别表达基因的新方法。1992年Liang等[1]提出mRNA差异显示技术(mRNA differential display reverse transcription PCR或称 DDRT-PCR),1994年Huband等[2]提出代表性差示分析技术(representational difference analysis或RDA),1996年Diatchenco等[3-4]提出抑制性差减杂交技术(suppression subtractive hybridization,SSH),l998年Kang等[5]提出交互扣除 RNA差别显示技术(reciprocal subtraction differential RNA display或RSDD)等等。近年来,在上述众多研究基因差异表达的方法中,SSH技术由于速度快、假阳性率低、灵敏度高等优点,现已广泛应用于植物学研究的各个领域[6]。烟草是我国重要的经济作物之一,面积和总产量都居世界第一。与此同时,它作为模式植物,在植物学的研究领域具有重要的科研意义,尤其是在遗传、繁育、生理、生化和转基因等研究领域。笔者就SSH技术的基本原理、主要方法及该技术的优缺点等进行了介绍,并综述了其在烟草研究领域中的应用进展。
1 抑制性消减杂交技术的主要原理和方法
1.1 cDNA的合成
提取2种不同材料如正常情况和经过处理的样RNA,然后从中分离出mRNA,分别作为参照样本(driver)和检测样本(tester)。接着在反转录酶的作用下将这2个样品的mRNA分别转录为cDNA。
1.2 cDNA的酶切
将检测样本(tester)和参照样本(driver)的cDNA分别以RcaI或HaeIII等识别四碱基的限制性内切酶切割,这些酶在44=256 bp处就有一切点,因此cDNA经酶切后可产生许多个小片段,且最长片段约为600 bp。
1.3 接头连接
将检测样本经酶切后的cDNA片段均等分为2份,分别连上接头 1(Adapter-1)和接头 2(Adapter-2),接头是一段双链DNA片段,由一长链(约40余个核苷酸)和一短链(约10个核苷酸)组成。值得注意的是2个接头末端设计为缺少磷酸基团,以便只有DNA片段3’端与cDNA的5’端共价结合。此外接头1和2的外侧序列依次与第1次PCR引物相同;内侧序列分别与第2次PCR引物的两个相同。同时接头上还含有 T7启动子系列和多个限制性内切酶识别位点,为后续差异片段的测序和相关载体的构建提供了方便。
1.4 扣除杂交
SSH技术中第1次扣除杂交时,把过量的参照样本(driver)加入到连有两个接头的 cDNA中进行变性和退火杂交,则检测样本和参照样本中系列相同的片段形成双链片段而留下各自有差别表达的片段。经过第1次扣除杂交,检测样本(tester)中的 cDNA单链(a)均等化了,即表达有差别的cDNA相对含量大体相等。这是二级杂交动力学原理的应用,即丰度高的单链cDNA退火时产生同源杂交双链 cDNA(b)的速度要快于丰度低的单链cDNA。第2次扣除杂交时,在第1次杂交后的产物中加入新制备变性的参照样本(driver),再次退火杂交。因此杂交后形成4种类型的DNA片段,即 Tester-cDNA 单链(a)、同源杂交双链 cDNA(b)、相同的片段形成了异源双链分子(c)、带有两种接头的杂交分子(e)。最后一种就是在检测样本(tester)和参照样本(driver)样本之间所存在的那些有差别表达的片段,能在以后的PCR中有效地以指数形成扩增。这样达到富集目标cDNA的目的。
1.5 PCR扩增
在PCR反应中,只有(e)类cDNA片段能被大量扩增。然而其他 3种,如 a、d类无引物结合点,不能扩增;(b)类两端均为同一接头,链内退火优于链间退火。因此会在链内形成发夹或锅柄结构,故不能被扩增。第1次PCR扩增,依据PCR抑制效应的原理,只有两端分别为接头1和接头2的差异片段才能以指数形式扩增;第2次PCR主要是特异性扩增,并可用于后续研究工作。
1.6 转化、筛选与鉴定
第2次PCR所得的差别表达cDNA片段可以利用接头上已有的酶切位点,连接到适当载体中去转化大肠杆菌。然后经 X–gal-IPTG显色反应(即把大肠杆菌涂布在含X–gal和IPTG的培养基平板上,根据克隆的颜色来判断阳性克隆),初步确定出阳性克隆。最后对插入差异片段进行测序和序列比对等工作,从而得到差异片段的相关信息。抑制性消减杂交(SSH)技术的主要步骤如图1所示。
2 抑制性消减杂交技术的主要优缺点
SSH技术与其他技术相比主要的优点如下:(1)筛选周期短、效率高,一轮SSH过程仅需3~4 d,且一次反应可同时分离几十或上百个差异表达的基因片段。(2)假阳性率低,由于2次扣除杂交和2次PCR作用,SSH技术阳性率高达94%[7]。(3)灵敏程度高,SSH用RsaI或HaeIII酶切后产生许多cDNA片段,保证差别DNA的检出率;同时,由于该技术可以富集差别DNA达1000~5000倍左右[8],从而保证了低丰度 mRNA能被检出。(4)操作简便易行,一般分子生物学实验室即可完成。
SSH技术与其他技术相比主要的缺点如下:
(1)实验中所需的mRNA量较大(一般微克级),因而某些特殊样本的mRNA不易获得。此外,对植物组织而言,应尽量选择幼嫩的组织作为研究对象,因为一些老的植物组织不易分离出高质量的mRNA,影响后面的实验操作。
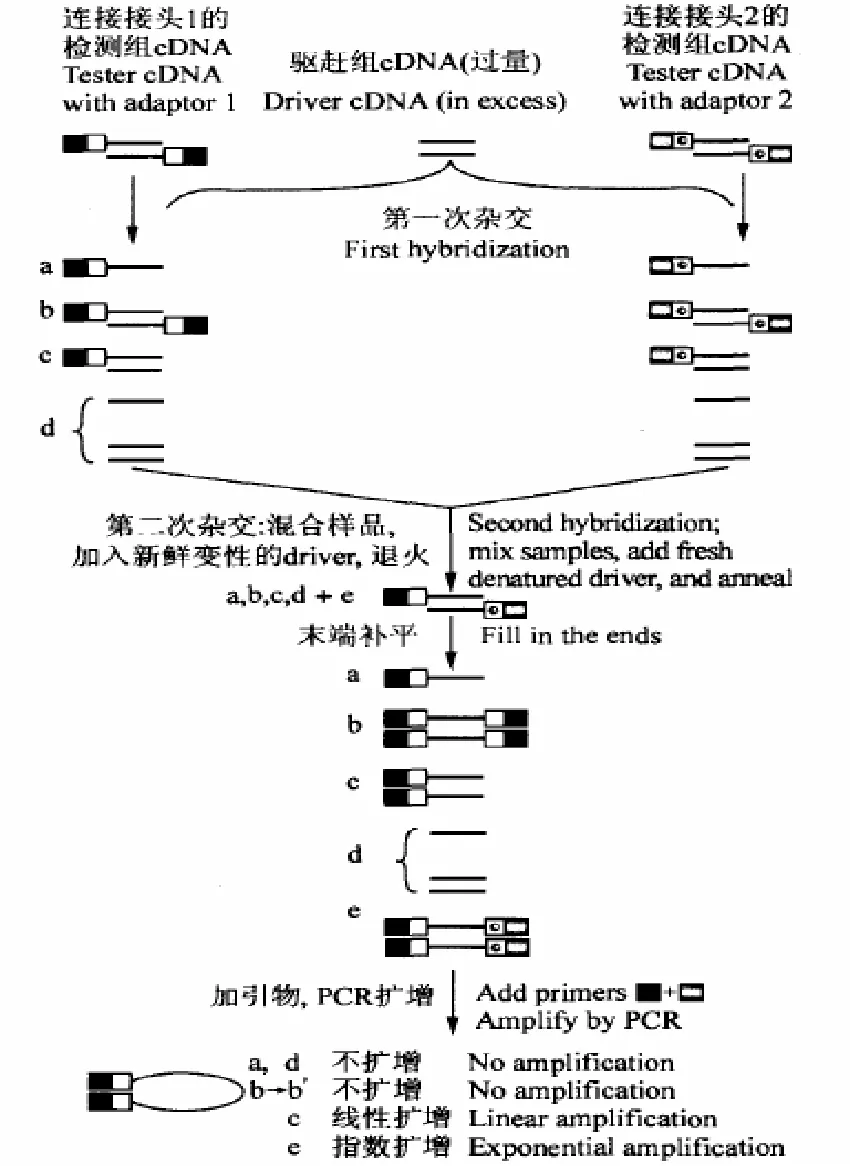
图1 抑制性消减杂交 ( SSH) 步骤示意图(Diachenko et al,1996, 黄鑫等, 2006)Fig.1 The principle and progress of suppression subtractive hybridization (SSH) (Diachenko et al, 1996, Huang Xin et al,2006)
(2)SSH中的2次扣除杂交Driver-cDNA均过量,故可能掩盖Tester-cDNA中某些表达有丰度差别的cDNA,难以发现某些有差别表达的基因,为后续的研究工作增加难度。
(3)SSH技术不能同时对数个材料之间进行比较,一次只能比较2个样品;而且所研究的材料的差异不宜太大,否则假阳性率升高。
3 抑制性消减杂交技术在烟草研究中的应用
3.1 在发育研究中的应用
烟草烤烟品种K326在我国已推广20余年,目前仍是我国推广种植面积最大的品种,表明该品种烟叶内在质量优异。为了分析该品种参与叶片发育的基因,潘建菁等[9]利用SSH技术,构建其茎叶抑制性消减cDNA文库。实验结果表明,插入基因片段长度在200~1000 bp之间,符合构建文库标准。但并未对差异片段进行分析和报道。
烟草突变体 T-cdf是经过航天诱变获得的,形态特征是叶片表面起皱尤其是次级叶脉之间突起和延迟开花的特性[10]。经过扫描电镜分析,烟草突变体 T-cdf的叶片形态特征是由于叶片表面细胞的生长失衡所致。为了从分子水平上揭示该突变体烟叶生长发育规律,蔡刘体等[11]以烟草突变体 T-cdf和烟草品种K346叶片分别作为Tester和Driver材料,构建了抑制性消减cDNA文库,经过阳性克隆的鉴定和序列分析共获得 62个表达序列标签(ESTs,已登录GenBank数据库),按照功能可划分为7类。其中与烟草光合作用相关的ESTs有9个,这些基因的表达都是上调的,例如叶绿体中两个a/b结合蛋白(EB102894;E B102895)、光合系统I反应中心亚单位XpsaK(EB041775)和光合系统II中一个分子量是23 kD多肽链(EC391385)。烟草突变体 T-cdf叶片上表面隆起的皱叶形态特征是由于叶片上表皮细胞分裂速率比野生型叶片上表皮快[11],因此这些上调表达的基因可能参与这一过程。此外水孔蛋白(EB041772)和类水水孔蛋白(EC391403)在烟草突变体T-cdf叶片中表达是上调的。关于水孔蛋白的功能,Uehlei等[12]报道在烟草叶片中人为过量表达NtQP1,一种水孔蛋白能加强细胞膜对二氧化碳和水的渗透性,促进叶片的生长和发育。由此推测这2个基因的表达上调也可能是引起突变体叶片上表面隆起的原因之一,当然仍需要相关实验证明。此外还发现与结构蛋白相关的ESTs有4个,与抗性防卫蛋白相关的ESTs有5个,与信号转导相关的ESTs有2个,与代谢功能相关的ESTs有11个。蔡刘体等[13]进一步的研究工作从以上构建的SSH文库中,筛选到一个表达序列标签P1T10(GenBank Access No.EB102896),结合末端快速扩增(RACE)方法克隆到这个基因全长的cDNA,通过软件分析表明该基因编码一个 110个氨基酸的小分量蛋白(GenBank Access No.ABE03627),它与烟草叶片一个表面抗性蛋白(GenBank Access No.AY705384)具有93%的同源性。表达分析证明,该基因在烟草突变体 T-cdf叶片中的表达量明显高于对照。
3.2 在抗病研究中的应用
水杨酸是一种酚类激素,可调节植物的生长发育,同时还作为内生信号参与植物对病原菌的抵御,通过诱导组织产生病程相关蛋白,当植物的一部分受到病原体感染时在其他部分产生抗性。以上抗病反应的获得是由基因表达差异所决定的。董霞等[14]利用消减杂交(SSH)技术构建SA诱导的烟草差异表达文库,为克隆抗病相关基因及进一步从分子水平研究SA诱导的抗病反应变化规律奠定基础。他们的方法是以漂浮育苗法培育的云烟 85烟苗为试验材料,以0.1 mmol/L SA诱导的烟苗分别在24、48、72 h取样,混合后提取的RNA为Tester,以清水喷施处理烟苗的 RNA为 Driver;对随机挑选的 12个阳性克隆进行测序,经过序列分析比对后发现有4条片段与Sar8.2g基因同源性为100%,有2条片段与Sar8.2d 基因同源性为98%和99%。1条与抗性相关蛋白1a的同源性一致性为100%。此外序列中还有1条与光系统II的促氧蛋白的33 kDa亚基有较高同源性,1条与水通道蛋白基因(aquaporin 1)同源,1条与Ertl3基因有同源性,1条没有相关信息,为未知功能的新基因。
烟草霜霉病(Blue Mold)是一种由真菌引起的重要病害。在适合病害发生发展的条件下,往往造成毁灭性的破坏。烟草霜霉病菌在世界不同生态地区有高度适应性和极强的传播力。麦格隆熄丰烟是一个野生烟草品种,通常作为烟草遗传育种的模式植物。例如它对黑胫病和霜霉病(P.parasitica var.nicotianae and Peronospora hyoscyami)有较强的抗性,为了鉴定该品种参与抵抗霜霉病的基因。Hidalgo等[15]应用SSH技术研究不亲和性相互作用不同时期转录本,通过杂交共检测到182个不同克隆,通过测序和分析,鉴定的基因参与植物各种各样的生理过程。通过Northern Blot 证明其中16个基因在亲和性和不亲和性的相互作用中具有不同的表达模式。进一步工作从中挑选4个基因进行深入研究,结果表明它们在不亲和的相互作用中快速和大量诱导表达,而在亲和的相互作用中没有观察到诱导表达。采用基因沉默的方法敲除一个磷脂膜上的转运蛋白和谷氨酸盐脱羧酶并不影响烟草对霜霉病的抗性,但是敲除 EIL2转录因子和谷胱甘肽合成酶基因后使烟草减弱对霜霉病的抗性,因此有希望通过在烟草中过量表达这2个基因来培育霜霉病的品种。
烟草黑胫病是世界烟草生产中最主要的病害之一,这种病在高温高湿的条件下发展迅速。特点是发病率高,分布范围广,造成的经济损失巨大。这种病原菌侵害植株发育各个时期的根、茎和叶等部位,导致根、茎坏死、植株发育迟缓,严重植株死亡。为了鉴定麦格隆熄丰烟参与抵抗黑胫病的基因,Chacon等[16]应用同Hidalgo等同样的方法构建SSH文库,通过杂交共筛选到48个基因克隆。经过分析后将它们分成6个组,分别参与防卫、信号转导、转运、代谢、能量、蛋白合成等生理过程。后续的实验第一次证明 hrs203J和一个锌指蛋白在非亲和性的相互作用中有很强的诱导表达。同时发现这些基因并不受亲和性相互作用的诱导。这些说明它们对烟草抗病性是有贡献的,可能是参与抗病的靶基因。要明确它们的功能还需要进一步实验。
3.3 在逆境研究中的应用
硫是烟草必需的营养元素之一,烟株干物质的含硫量一般在0.2%~0.7%之间。烟草缺硫后症状:新叶呈均一的浅黄绿色,而老叶仍保持绿色,随后发展至整株黄化,叶片小,节间短。为了研究烟草适应硫胁迫的分子机制,Wawrzynska等[17]利用SSH技术鉴定到38个响应短期硫胁迫的基因,其中22个基因参与正向调节,16个基因参与负向调节。材料来源于 4个部位(幼嫩、成熟叶片、茎和根),这4个部位会表现出不同的硫缺乏症状。有趣的是在植物的不同部位一些基因表现出不同的表达方式。数据库分析表明所鉴定到的基因可分成9组,每组都有表达上调和下调的基因。这9组基因参与病原菌抗性、细胞壁合成基因、蛋白降解、光合作用、碳代谢、硫代谢、核糖体组装等过程。值得注意的是检测到4个参与硫代谢的基因表达都是上调的,这4个基因分别是磷脂酸磷酸半胱氨酸合成酶、亚硫酸盐还原酶、硫酸盐转运体和谷胱甘肽-S-转移酶。推测这4个基因与烟草的硫代谢密切相关。
在离体条件下,当高等植物的小孢子遭受各种各样的逆境胁迫时,它们能够调整发育的方向以便形成单倍体的植株。Hosp等[18]采用SSH技术来研究这种发育过程的转变。在逆境处理后的配子中通过反向Northern blot杂交的方法鉴定到90个上调的序列。经过比对、分析后可把这些序列分成5组,它们分别是参与代谢、染色体重塑、信号、转录和翻译等过程。其中这些序列中有一半功能未知。
3.4 在遗传育种研究中的应用
从育种角度考虑,虽然单倍体本身并无直接利用价值,但通过染色体加倍处理可获得双单倍体。从选择的效率来看,双单倍体比一般的二倍体优越,它可以保证基因型是纯合的,所需性状不会因后代分离而丢失。在遗传学研究中,单倍体和双单倍体还可以作为基因突变、基因与环境互作以及数量遗传等研究的基础材料,可以找到在二倍体中很难发现的稀有基因。Shary等[19]利用SSH技术以双单倍体分化的愈伤组织为 Tester,以增殖的愈伤组织为Driver,检测在不同分化时期表达的基因。共筛选到 41个不同的基因克隆,这些基因在不同分化组织中表达是上调的。其中21个基因未见报道,可能是新基因,还有 20个与数据库中的其他基因具有高度的同源性。这20个基因可分为7组,有4个基因与光合相关,有2个基因参与转录后修饰过程,参与蛋白合成的有2个基因,参与蛋白运输的有2个基因,还有1个结构基因,2个与代谢相关的基因和7个未分类的基因。
烟草的育种目标主要集中在高产、高抗、优质3个方面。实现育种目标有多种途径,杂种优势的利用是其中之一。与常规育种方法比较,利用杂种优势在实现育种目标上需时短、见效快,可以尽快解决我国目前烟草生产上对优质高抗品种的迫切需要。杂种致死对于杂交育种是一个很重要的问题,但是关于这个问题的分子机制并不清楚。Masuda等[20]的研究集中在鉴定杂种烟草细胞(野生种烟草×烟草)致死过程中的基因。首先提取杂种致死细胞中的 RNA和能够存活杂种细胞中的RNA,取材的时间包括4个,即在诱导前和诱导后、在开始发生程序性死亡和发生后期。通过SSH分析和斑点印迹法,在138个分离到克隆发现99个基因被鉴定是杂种致死的基因。实时定量PCR分析表明在致死的杂种细胞中有10个克隆是特异性表达。发现的杂种致死基因参与病菌抗性、乙烯诱导的反应、磷酸化、泛素化、茉莉酸相关反应、钙信号和自交不亲和等过程。这些数据表明,至少在某种程度上杂种致死的机制与那些预测参与杂种致死的基因是相关的。
4 展 望
虽然SSH技术问世至今只有10多年的时间,却在生物学各个研究领域应用广泛。特别是在差异基因的表达、鉴定和克隆中发挥巨大的作用。高等生物大约 10万个基因,在正常情况下,真核生物基因组中只有15%的基因得以表达,因此大力挖掘植物中有价值的新基因是今后科研的主要方向。今后随着SSH技术的不断发展、改进以及结合其他技术,如cDNA微阵列及高密度点阵膜等可以快速对差减产物进行分析,它将日益成为科研工作者手中克隆新基因、研究基因表达和植物生长发育的有效工具。烟草作为一种重要的经济和科研的模式植物,对我国经济生产和科学研究起到举足轻重的作用。因此,采用SSH技术分离烟草中与品质、抗病、抗逆性相关功能基因及研究烟草基因表达调控的规律,具有极其重要的意义,前景十分广阔。
[1]Liang P, Pardee A B.Differential display of eukaryotic messenger RNA by means of the polymerase chain reaction[J].Science, 1992, 257(5072): 967-971.
[2]Huband M , Schata D G.Identifying differences in mRNA expression by representational difference analysis of cDNA.Nucleic Acids Res[J].1994, 22(25):5640-5648.
[3]Diatchenco L, Lau Y C, Campbell A P.Suppression subtractive hybridization: a method for generating differentially regulated or tissue specific cDNA probes and libraries[J].Proc.Nat1.Acad.Sci.USA , 1996,93(12): 6025-6030.
[4]Diatchenko L, Lukyanov S, et al.Suppression subtractive hybridization: a versatile method for identifying differentially expressed genes [J].Methods Enzymol,1999,303: 349-380.
[5]Kang D, La F R, Su Z Z, et al.Reciprocal subtraction differential RNA display: ban efficient and rapid procedure for isolating differentially expressed gene sequences[J].Proc.Nat1.Acad.Sci.USA, 95(23):1998 :13788-13793.
[6]黄鑫,戴思兰,孟丽,等.抑制性差减杂交(SSH)技术在分离植物差异表达基因中的应用[J].分子植物育种,2006,4(5):735-746.
[7]Vonstdin O D, Thies W G, Hofmann M.A high throughput screening for rarely transcribed differentially expressed genes[J].Nucleic Acids Res,1997, 25(13): 2598-2602.
[8]Ji W, Wright M B, Cai L, et al.Efficacy of SSH PCR in isolating differentially expressed genes[J].BMC Genomics, 2002, 3(1): 12.
[9]潘建菁,兰岚,庄伟建,等.烤烟品种K326茎叶消减文库的构建及质量分析[J].福建农林大学学报:自然科学版,2007,36(5):449-453.
[10]Cai L T, Zheng S Q, Huang X L.A crinkly leaf and delay flowering mutant of tobacco obtained from recoverable satellite–flown seeds[J].Adv in Space Res, 2007,40:1689-1693.
[11]蔡刘体,郑少清,叶定勇,等.烟草突变T-cldf叶片差异ESTs的克隆与分析[J].烟草科技,2008(1):50-55.
[12]Uehlein N, Lovisoi C, Siefritz F, et al.The tobacco aquaporin NtAQP1 is a membrane CO2pore with physiological functions[J].Nature, 2003, 425: 734-737.
[13]蔡刘体,胡重怡,郑少清,等.烟草叶片表面抗性蛋白T-phylloplanin基因的克隆[J].烟草科技,2008(7):48-51.
[14]董霞,李文正,黄夸克,等.水杨酸诱导云烟85基因表达差减文库的构建及初步分析[J].云南农业大学学报,2005,20(6):771-773.
[15]Hidalgo O B, Thomma B P, Collazo C, et al.EIL2 transcription factor and glutathione synthetase are required for defense of tobacco against tobacco blue mold[J].Mol.Plant Microb.Interact 2006, 19(4):399-406.
[16]Chacon O, Hernandez I, Portieles R, et al.Identification of defense-related genes in tobacco responding to black shank disease.Plant Science[J].Plant Science, 2009, 177:175-180.
[17]Wawrzynska A, Lewandowska M, Hawkesford M J.Using a suppression subtractive library-based approach to identify tobacco genes regulated in response to short-term sulphur deficit [J].Journal of Experimental Botany, 2005, 56(46): 1575-1590.
[18]Hosp J, Tashpulatov A, Roessner U, et al.Transcriptional and metabolic profiles of stress-induced embryogenic tobacco microspores[J].Plant Mol Biol , 2007, 63(1):137-149.
[19]Shary S, Mukherjee S G.Isolation and expression studies of differentiation-specific genes in tobacco dihaploids using PCR-based subtractive hybridization method[J].Plant Science, 2004, 166: 317-322.
[20]Masuda Y, Yamada T, Kuboyama T, et al.Identification and characterization of genes involved in hybrid lethality in hybrid tobacco cells (Nicotiana suaveolens × N.tabacum) using suppression subtractive hybridization[J].Plant cell Rep, 2007, 26(9): 1595-1604.
