湖北省烟草黑胫病菌生理小种研究初报
2011-05-25李锡坤孔凡玉李锡宏张成省陈雅琼苏振刚李佰乐
李锡坤,孔凡玉,李锡宏,王 静,张成省,冯 超,陈雅琼,刘 璇,苏振刚,李佰乐
(1.中国农业科学院烟草研究所,青岛 266101;2.中国农业科学院研究生院,北京 100081;3.湖北省烟草研究所,武汉 430000;4.云南省玉溪市烟草公司,云南 玉溪 653100)
烟草黑胫病于 1896年在印度尼西亚的爪哇首次发现,此后迅速蔓延全世界,成为烟草生产上最具毁灭性的病害之一[1]。烟草黑胫病菌(Phytophthora parasitica var.nicotianae)可以为害所有栽培烟草,主要侵染烟草根部和茎基部,高温、高湿有利于病原的侵染,随着病害的发展,烟株根系和茎基部变黑腐烂,最终导致烟株死亡。20世纪60年代以来,美国、南非、印度、中国等主要产烟国对其致病性与生理分化进行了研究[2]。迄今为止,国内外已发现0号、1号、2号、3号共4个烟草黑胫病生理小种。朱贤朝等[3-8]在20世纪80年代对我国烟草黑胫病菌生理小种的研究发现,我国存在 0号和1号生理小种及一个未鉴定出生理小种的致病型。李锡宏等[9]于1995—1998年从湖北恩施州烟草上采集到黑胫病标样102个,分离纯化出46个菌系,用游动孢子悬浮液注射 10叶期左右鉴别寄主的茎基部,所用鉴别寄主为L8(具有N.longiflora抗性)、NC1071(具有N.Plumbaginifolia抗性)、N.nudicaulis和小黄金1025。结果表明,46个菌系对L8、NC1071和N.nudicaulis无致病力,为0号小种。本研究对 2009年采集的湖北烟草黑胫病菌进行了生理小种的初步鉴定。
1 材料与方法
1.1 样品的采集与病原分离
1.1.1 样品采集 自2009年7—9月,于湖北省主产烟区采集具有典型症状的烟草黑胫病标样 111个,分离纯化得到烟草黑胫病病原菌样本 30个。其中,烤烟标样22个,白肋烟标样7个,晒烟标样1个。
1.1.2 病原分离 取典型的烟草黑胫病病株,用自来水洗净茎秆,将枝叶及根系等去除,在超净工作台内用75%酒精擦拭茎秆后烧去残余酒精,用灭菌解剖刀将茎秆纵向剖开,用灭菌镊子夹取髓部碟片或灭菌解剖针挑取髓部碟片间菌丝放入选择性燕麦培养基平板上,每皿均匀放置3~4块,28 ℃温箱中培养,2~4 d后挑取边缘菌落纯化。
1.2 培养基的制备
燕麦培养基配方[10]:燕麦片30 g,琼胶17~20 g,水1 L。
选择性燕麦培养基[11]:在燕麦培养基倒平板前(约冷却到40 ℃)加入100 mg/L利福平、50 mg/L氨卞青霉素、50 mg/L五氯硝基苯和50 mg/L制霉菌素。
TTZ培养基[12]:TTZ液体培养基的基本成分为蔗糖30 g、柠檬酸20 g、氯化钙1.0 g、硝酸钾2.0 g、磷酸二氢钾0.67 g、磷酸氢二钾0.33 g、1%氯化铁溶液10滴、VB11 mg和蒸馏水1 L。将上述各试剂在烧杯内混匀溶解后,调节pH至5.5,121 ℃高压蒸汽灭菌30 min,冷却后加入经细菌过滤器灭菌的0.05%(W/V)TTZ(2,3,5-氯化三苯基四氮唑,2,3,5-triphenyl tetrazolium chloride)。
TTZ固体培养基为燕麦培养基在倒平板前(冷却至约 40 ℃)加入经细菌过滤器灭菌的 0.05%(W/V)TTZ[13]。
1.3 TTZ颜色反应鉴定
1.3.1 TTZ液体培养基中的颜色反应 供试烟草的黑胫病菌在28 ℃培养箱内培养3~5 d,用直径为 5 mm的打孔器取边缘菌龄一致的菌块,移入TTZ液体培养基中,以不加TTZ的液体培养基为对照,处理和对照皆设3个重复。置于28 ℃培养箱,接种后72 h分别观察培养基及菌体的颜色变化。
1.3.2 TTZ固体培养基中的颜色反应 供试烟草的黑胫病菌在28 ℃培养箱内培养3~5 d,用直径为 5 mm的打孔器取边缘菌龄一致的菌块,移入TTZ固体培养基中,以不加TTZ的燕麦琼脂培养基为对照,每个处理和对照皆设3个重复。置于28 ℃培养箱,接种24 h后分别观察培养基及菌体的颜色反应。
判断依据[12]:0号和1号生理小种在TTZ液体培养基中,72 h内菌丝全部变为红色;在固体培养基中,24 h菌体变为红色;3号生理小种在TTZ液体培养基和固体培养基中均不变红。
1.4 鉴别寄主鉴定
1.4.1 鉴别寄主 选择反应相对稳定的烟草品种NC1071、L8、N.nesophila、Florida301作抗病对照,小黄金1025作感病对照。0、1、2和3号生理小种在选定的鉴别寄主上的反应见表1[14]。

表1 烟草黑胫病菌在鉴别寄主上的反应Table1 The response of Phytophthora nicotianae on the different hosts
1.4.2 育苗 烟草种子于 25 ℃下用灭菌水黑暗浸泡约3~5 d,播于装有高压灭菌湿润土的盘中,置于24~28 ℃温室培养,幼苗3片真叶时移栽于装有灭菌砂壤土的塑料盆钵中(直径12 cm)。
1.4.3 游动孢子悬浮液的制备 向培养14~21 d的供试菌株培养基平板内,加入 0.1%KNO3和 1%葡萄糖溶液,黑暗浸泡2 d,之后4 ℃处理40 min,25 ℃静置20 min,调整游动孢子浓度为1×104个/mL。
1.4.4 接种方法 用医用注射器(5号针头)吸取制备好的游动孢子悬浮液,选取6~8叶期烟苗,茎基部注射菌液,置于25~28 ℃温室,维持湿度90%,诱发病害。每处理4次重复,重复2株。每7 d调查病情,连续调查3次。
1.4.5 烟草黑胫病分级标准 0级:全株无病。
1级:茎部病斑不超过茎围的1/2,或(和)半数以下叶片或顶叶轻度凋萎,或下部少数叶片出现病斑。
2级:茎部病斑超过茎围的1/2,或(和)半数以上或部分腰叶以上叶片凋萎。
3级:茎部病斑环绕茎围,或(和)2/3以上叶片或下一棚以上叶片凋萎。
4级:病株枯死。

2 结 果
30个菌株在TTZ固体培养基上接种24 h即可见接入的菌块变为红色,并且随着培养时间的加长,红色范围逐渐扩大,从培养基平板背面观察,呈红色圆斑(图1)。30个菌株在TTZ液体培养基培养72 h后,其菌体变为浅红,并且液体培养基亦呈浅红色(图2)。根据反应[12],排除供试菌株为3号生理小种的可能,即供试菌株为烟草黑胫病菌的0号或1号生理小种。
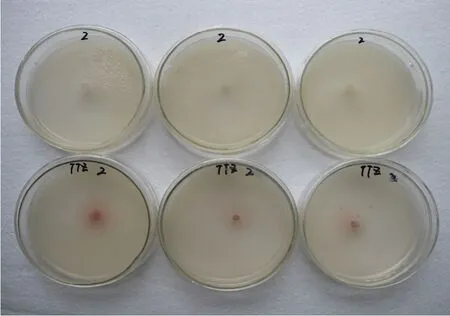
图1 烟草黑胫病菌在TTZ固体培养基中的变色反应Fig.1 The mycelial color of Phytophthora nicotianae on solid TTZ medium cultured after 24 h
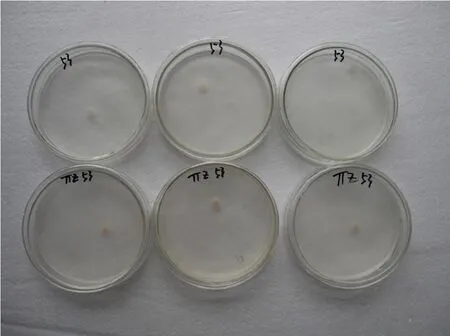
图2 烟草黑胫病菌在TTZ液体培养基中的变色反应Fig.2 The mycelial color of Phytophthora nicotianae on liquid TTZ medium cultured after 72 h
由表2可看出,全部供试菌株在N.nesophila、Florida301和小黄金1025品种上的反应分别表现为抗病、中抗和感病,但在NC1071和L8品种上的反应表现有差异。其中,24个菌株在 NC1071和L8品种上的反应皆表现为感病,病情指数分别为78.13~100和75.00~100。依据烟草黑胫病菌在鉴别寄主上的反应(表1)与TTZ颜色反应结果,初步鉴定24个菌株为1号生理小种,其余6个菌株在NC1071和L8品种上的反应有所不同:BD-1菌株在2个品种上均为抗病,Xf-1、LC-2、XF-4三个菌株中感 NC1071中抗 L8,LC-5菌株中抗 NC1071感L8,ES-5菌株感NC1071中抗L8。根据TTZ颜色反应结果,排除6个菌株为3号生理小种的可能,是否为2号生理小种还是其他致病型,尚待进一步研究确定。不同菌株在鉴别寄主上的反应如图3。
3 讨 论
供试的30个菌株在TTZ液体和固体培养基中的反应皆为红色。与TTZ液体培养基相比,在TTZ固体培养基中颜色变化更为明显。不管是液体培养基中的菌丝,还是固体培养基中的菌丝,变色部分菌体菌丝的原生质皆呈现红色。John L McIntyre和G S Taylor[14]认为菌体在TTZ培养中变为红色是与菌丝体中新陈代谢活跃的细胞中的脱氢酶有关。而王智发等[12]认为,烟草黑胫病菌0号、1号生理小种可以使 TTZ培养基变色的基本机制是脱氢酶与TTZ发生氧化还原反应生成了红色物质,且越是具有活性的菌体,变色愈深。由此说明,0号和1号生理小种的菌体内存在与 TTZ发生氧化还原反应的脱氢酶,而3号生理小种不具有可以与TTZ发生氧化还原反应的脱氢酶。TTZ与脱氢酶作用的具体机制仍有待进一步的研究[12,15]。与生理小种间某些培养性状差异和其他生理生化特性相比,TTZ颜色反应有着较小的误差和较明显的可辨认性,在烟草黑胫病菌生理小种的鉴定上起到了良好的辅助作用。
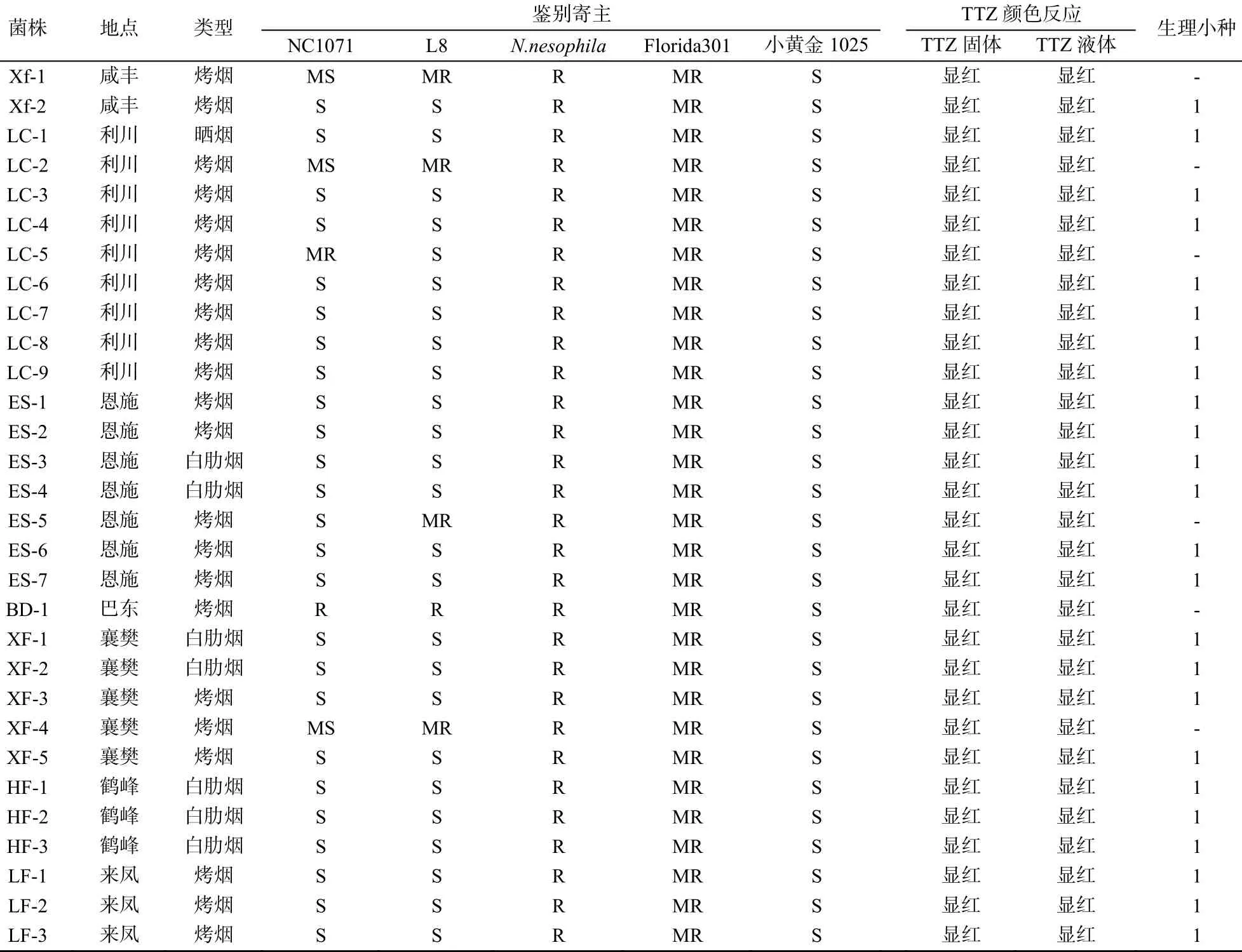
表2 烟草黑胫病菌在鉴别寄主上的反应及生理小种类型Table2 The response of Phytophthora nicotianae on the different hosts

图3 烟草黑胫病菌株在各寄主上的反应Fig.3 The response of several strains of Phytophthora nicotianae on the different hosts
国内外鉴别烟草黑胫病菌生理小种的寄主有很多,常用的有Florida301, L8, NC1071, Nicotiana.plunbaginifolia, Nicotiana.nesophila, Nicotiana.stocktonii, Nicotiana.nudicaulis, Burley21, Burley37,(L8×Burley21)F1等。有研究资料证明抗性来自N.longiflora的L8和抗性来自N.Plumbaginifolia的NC1071的抗性基因片断是相似的,且都为显性单基因遗传,根、茎的抗性与正株抗性高度相关,且对0和1号生理小种的抗感反应是稳定的,因此不仅把这两个材料作为田间出现 1号小种的指示寄主,同时也是区分0号和1号生理小种的标准鉴别寄主,而把茎接种技术作为标准接种方法[3]。N.nesophila对烟草黑胫病0号和1号生理小种的反应是抗1号感0号生理小种,且它是野生种,基因比较稳定,自然变异的可能性较小[8,13]。因此,本次试验选用NC1071、L8和N.nesophila作为区分0号和1号小种的鉴别寄主,小黄金1025作感病品种对照。
迄今为止,国内外已报道的烟草黑胫病菌有 4个生理小种。1962年,Apple[16]在美国北卡罗莱纳州发现了0号和1号生理小种,现0号和1号生理小种广泛发生于世界烟草种植区;1973年Pringsloo G C等[17]在南非鉴定出烟草黑胫病菌 2号小种;1978年John L Mclntyre等[14]在美国康涅狄格州鉴定出3号小种。国内报道的烟草黑胫病菌生理小种是0号和1号。朱贤朝等[6]于20世纪80年代研究发现,认为我国主要烟区的烟草黑胫病菌,0号生理小种是优势种,亦有1号生理小种和1个致病型。其中,湖北省有1个菌系为1号生理小种,2个菌系为0号生理小种。1999年,李锡宏等[9]对湖北省恩施州烟草上分离得到的 46个菌系进行生理小种鉴定,认为46个菌系是0号生理小种,恩施烟区烟草黑胫病菌以0号生理小种占主导地位。
根据本研究,供试24个菌株为烟草黑胫病菌1号生理小种,占供试菌系的80%,与李锡宏等[9]1999年鉴定湖北恩施州烟草黑胫病菌基本是0号生理小种的结果发生了较大变化,是受品种基因型的影响,还是环境与遗传基因共同作用的结果,还待进一步研究探讨。
[1]朱贤朝,王彦亭,王智发.中国烟草病害[M].北京:中国农业出版社,2001:21-22.
[2]马国胜,高智谋.烟草黑胫病菌研究进展(II)[J].烟草科技,2004(1):41-46.
[3]朱贤朝,郭振业,刘保安,等.山东省烟草黑胫病菌生理小种研究[J].植物病理学报,1987,17(2):90-95.
[4]朱贤朝,郭振业,刘保安.烟草黑胫病菌(Phytophthora parasitica var.nicotianae)生理小种研究初报[J].中国烟草,1984(4):4-7.
[5]朱贤朝,郭振业,刘保安.在山东省烟草黑胫病菌(Phytophthora parasitica var.nicotianae)中出现0和1号小种的分化[J].中国烟草,1986(2):8-10.
[6]朱贤朝,郭振业,刘保安.我国烟草黑胫病菌生理小种研究初报[J].中国烟草,1987(4):1-3.
[7]王智发,刘延荣,谢成颂.山东省烟草黑胫病菌生理小种初步鉴定[J].植物保护学报,1985,12(1):51-55.
[8]王智发,刘延荣,谢成颂.我国烟草黑胫病菌生理小种鉴定[J].山东农业大学学报,1987,18(1):1-8.
[9]李锡宏,孔凡玉,朱贤朝,等.湖北省恩施州烟草黑胫病菌生理小种研究[J].中国烟草科学,1999,20(4):23-25.
[10]方中达.植病研究方法[M].北京:中国农业出版社,1998:49.
[11]郑小波.疫霉菌及其研究技术[M].北京:中国农业出版社,1997:81-83.
[12]王智发,马德岭,刘延荣.用生化方法研究烟草黑胫病菌生理分化[J].山东农业大学学报,1990(1):1-6.
[13]谢成颂,王智发,刘延荣,等.烟草黑胫病菌生理小种鉴定技术研究[J].山东农业大学学报,1989(1):20-25.
[14]John L McIntyre, G S Taylor.Race 3 of Phytophthora parasitica var.nicotianae[J].Phytopathology.1978, 68:35-38.
[15]刘廷利,肖崇刚,陈国康,等.重庆市烟草黑胫病菌生理小种研究初报[J].烟草科技,2008(2):61-64.
[16]Apple J L.Physiological specialization within Phytophthora parasitica var. nicotianae[J].Phytopathology.1962, 52: 351-354.
[17]Pringsloo G C, Pauer G D C.Identification of races of Phytophthora parasitica var.nicotianae occuring in South Africa[J].Phytophylactica.1974, 6(4): 217-219.
