PI3K/Akt-aPKCι/ζ-Nrf2调控大鼠气道上皮细胞γ-谷氨酰半胱氨酸合成酶表达*
2011-05-24戴爱国
江 刚,戴爱国
(1.湖南省人民医院呼吸内科,长沙 410005;2.湖南省老年医院-湖南省老年医学研究所呼吸疾病研究室,长沙 410016)
氧化/抗氧化失衡是慢性阻塞性肺疾患(chronic obstructive pulmonary disease,COPD)的主要发病机制之一,香烟烟雾是引起COPD进展的危险因素。核因子相关因子 2(nuclear factor-E2 related factor,Nrf2)是调节抗氧化基因和维持细胞内氧化还原稳态的关键转录因子。谷胱甘肽(glutathione,GSH)是肺内主要的抗氧化剂,GSH及其合成限速酶γ-谷氨酰半胱氨酸合成酶(γ-glutamylcysteine synthetase,γ-GCS)在COPD的抗氧化机制中具有重要作用。研究表明不典型蛋白激酶C(antypical protein kinase C,aPKC)、磷酯酰肌醇-3-激酶 (phosphoinositol-3-kinase,PI3K)信号通路参与Nrf2激活及对抗氧化基因的调节[1]。本研究通过香烟烟雾提取物诱导大鼠气道上皮细胞氧化应激,使用PI3K 和aPKCι/ζ抑制剂进行干预,探讨PI3K/Akt-aPKCι/ζ-Nrf2 信号通路在大鼠气道上皮细胞抗氧化机制中的作用。
1 材料与方法
1.1 材料
1.1.1 试剂 白沙牌香烟(湖南白沙卷烟厂)、RTPCR(日本Toyobo公司)、RO318220和Nrf2多克隆抗体(美国 Santa Cruz公司)、LY294002 和 p-aPKCι/ζ抗体(美国Cell Signaling公司)、PIERCE蛋白提取液(美国Pierce公司)、异硫氰酸(FITC)-藕联的抗大鼠抗体和抗兔抗体(北京中杉金桥)、γ-GCS多克隆抗体和细胞角蛋白18单克隆抗体(武汉博士德生物公司)。
1.1.2 实验动物 雄性清洁级SD大鼠30只,体质量180~200g,由中南大学湘雅医院动物实验部提供。
1.2 实验细胞来源及分组
1.2.1 大鼠气道上皮细胞原代培养 参照Wu等方法培养SD大鼠气道上皮细胞,待细胞 70%~80%融合时,采用电镜和细胞角蛋白18免疫荧光方法鉴定及分别取1×106个细胞用于实验,每次实验重复5次[2]。
1.2.2 分组 将30只SD大鼠随机分为对照组和CSE(cigarette smoke extract,CSE)处理组,每组 5 只 。CSE处理组为将气道上皮细胞与含10%CSE和20%胎牛血清的 DMEM/F12培养基共培养1、3、6和12 h,aPKCι/ζ抑 制 剂 RO318220组 和 PI3K 抑 制 剂LY294002组则在加入CSE前0.5 h加入3μmol/L RO318220抑制剂和或 10μmol/L LY294002 ,其余处理同CSE 3 h组。
1.3 香烟烟雾提取物的制备
参照Nakamura等方法将制备的CSE在30min内用于实验[3]。
1.4 流式细胞分析
消化并收集细胞,制成浓度为1×106的单细胞悬液,加入荧光素标记的FITC-p-Akt抗体,避光,冰上孵育和固定,加入同型对照组消除非特异性荧光,流式细胞仪(FACSort,Becton-Dickinson)检测表达p-Akt细胞率,数据分析采用Cellquest软件(Becton-Dickinson)。
1.5 细胞免疫化学染色
采用链亲和素蛋白过氧化物酶法按以下步骤进行:将爬有气道上皮细胞的盖玻片常规固定、滴加兔抗γ-GCS多克隆抗体和抗兔二抗抗体、显色、复染、脱水、透明、封片及观察,阳性结果呈棕黄色。阴性对照以磷酸盐缓冲液代替一抗进行孵育。结果观察:各随机取3个视野,计算机自动测量并计算阳性信号积分吸光度(A)值(病理图文分析系统PAS9000,无锡朗珈生物医学工程有限公司),取平均值作为各实验组阳性表达的相对强度。
1.6 细胞免疫荧光染色
一抗为兔抗大鼠 NRF2多克隆抗体,二抗为FITC标记的抗兔抗体,操作步骤按细胞免疫化学,荧光显微镜下观察荧光的表达部位。
1.7 Western blot检测
按PIERCE提取液操作说明书提取细胞胞浆蛋白和核蛋白,采用BCA法进行蛋白定量,然后各泳道以200μg蛋白上样,经SDS-聚丙烯酰胺凝胶电泳分离,转膜,封闭后依次加入一抗和辣根过氧化物酶偶联的山羊抗大鼠二抗,增强化学发光法发光,X线胶片显影,凝胶图像分析系统(Tanon Gis-2010China)对所得条带吸光度半定量,β-actin作为内参照,计算待测条带的吸光度与内参照吸光度比值。
1.8 RT-PCR检测
采用Trizol、氯仿/异丙醇法提取细胞中总RNA,按反转录试剂盒说明操作,反转录成cDNA后进行PCR扩增。大鼠γ-GCS上、下游引物分别5'-CGTGGTGGATGGGTGTAGC-3'和5'-TAAAGCCTGATCCAAG TAACTCTG-3',扩增产物为359 bp。以G3PDH为内参照,其上、下游引物分别为:5'-TCACCATCTTCCAG GAGCGAG-3'和5'-TGTCGCTGTTGAAGTCAGAG-3',扩增产物为450bp。PCR反应条件为94℃变性1 h,63℃退火1 min,72℃延伸 30s,32 循环 。取 8μl扩增产物经1.5%琼脂糖凝胶(含溴化乙烷1 mg/L)电泳观察,用Bio-Rad Gel Doc 2000型凝胶图像分析系统进行扫描分析,所测扩增条带积分光吸度值用内参照修正。
1.9 γ-GCS活性测定
γ-GCS活性测量采用双酶法[2]。
1.10 统计学分析
2 结果
2.1 CSE对大鼠气道上皮细胞Nrf2核转位的影响
细胞免疫荧光显示Nrf2蛋白在对照组、CSE 12 h组主要表达在细胞胞浆,而在CSE 1、3和6 h组主要在胞核中表达;Western blot分析表明在对照组和CSE 12 h组Nrf2胞浆蛋白表达增强,胞核蛋白弱表达,而在CSE 1、3和6 h组Nrf2胞核蛋白表达增强,胞浆蛋白表达减弱。细胞免疫荧光和Western blot分析显示在抑制剂组Nrf2蛋白主要表达在胞浆,其胞浆蛋白表达增强,胞核蛋白弱表达,三组与CSE 3 h组比较有统计学意义(P<0.05,图1,表1)。
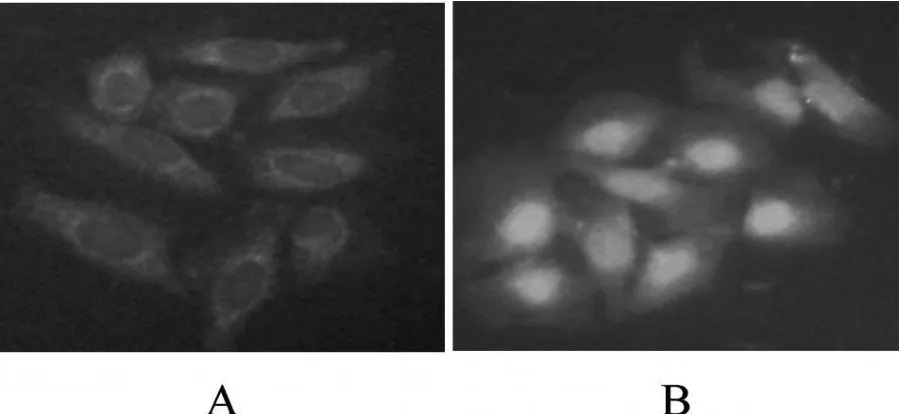
Fig.1 Effect of CSE on Nrf2 protein in the bronchial epithelial cells of rats by immunofluorescence staining(×400)
2.2 CSE对大鼠气道上皮细胞p-Akt蛋白质的影响
Western blot结果显示在CSE 1和3 h组,p-Akt蛋白质表达增强,在 LY294002组和 RO318220+LY294002组,其表达减弱,与CSE 3 h组比较差异有统计学意义(P<0.05),而在 RO318220组,其表达增强,与CSE 3 h组比较无显著性差异(P>0.05,图2)。
2.3 CSE对大鼠气道上皮细胞p-aPKCι/ζ蛋白质的影响
Western blot结果显示,p-aPKCι/ζ蛋白质在暴露CSE后1 h增强,3 h最强,6 h减弱,三组与对照组比较均有显著性差异(P<0.05),而在抑制剂组其蛋白质表达均明显减于CSE 3 h组(P<0.05)。流式分析结果表明表达p-Akt阳性细胞率的变化趋势与其蛋白质变化趋势相同(图2,表1)。

Fig.2 Western blot analysis of the expression of γ-GCS,p-Akt and p-aPKCι/ζproteins in the bronchial epithelial cells of rats
Tab.1 Effect of nucleic and cytoplasmic Nrf2 proteins,p-Akt and aPKCι/ζproteins in the bronchial epithelial cells of rats exposed to CSE(A value,,n=5)
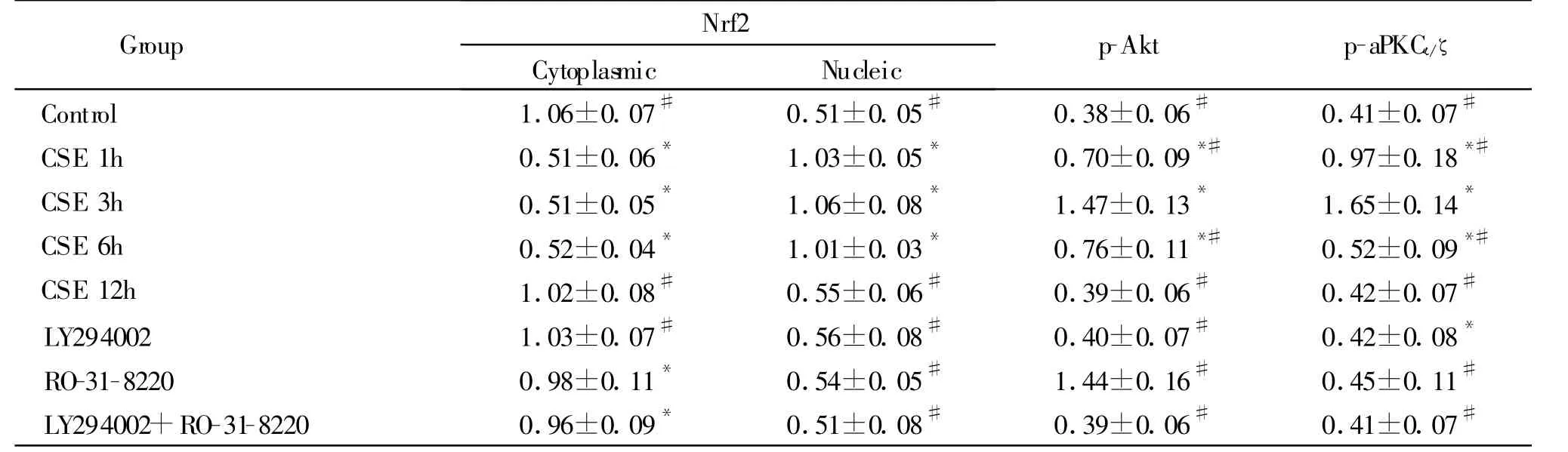
Tab.1 Effect of nucleic and cytoplasmic Nrf2 proteins,p-Akt and aPKCι/ζproteins in the bronchial epithelial cells of rats exposed to CSE(A value,,n=5)
*P<0.05 vs control group;#P<0.05 vs CSE 3 h group
Group Nrf2 Cytoplasmic Nucleic p-Akt p-aPKCι/ζ Control 1.06±0.07# 0.51±0.05# 0.38±0.06# 0.41±0.07#CSE 1h 0.51±0.06* 1.03±0.05* 0.70±0.09*# 0.97±0.18*#CSE 3h 0.51±0.05* 1.06±0.08* 1.47±0.13* 1.65±0.14*CSE 6h 0.52±0.04* 1.01±0.03* 0.76±0.11*# 0.52±0.09*#CSE 12h 1.02±0.08# 0.55±0.06# 0.39±0.06# 0.42±0.07#LY294002 1.03±0.07# 0.56±0.08# 0.40±0.07# 0.42±0.08*RO-31-8220 0.98±0.11* 0.54±0.05# 1.44±0.16# 0.45±0.11#LY294002+RO-31-8220 0.96±0.09* 0.51±0.08# 0.39±0.06# 0.41±0.07#
2.4 CSE对大鼠气道上皮细胞GSH影响
暴露CSE 1 h,GSH含量明显低于对照组(P<0.05),暴露CSE 3、6 h,GSH 含量明显增高并高于对照组(P <0.05),而预先使用 aPKCι/ζ抑制剂RO318220或和PI3K抑制剂LY292002,GSH含量下降,明显低于CSE 3 h组(P<0.05),三组抑制剂组之间无显著性差异(P>0.05,表2)。
2.5 CSE对大鼠气道上皮细胞γ-GCS mRNA表达的影响
RT-PCR分析显示暴露CSE 1、3和6 h,γ-GCSm-RNA表达逐渐增强,均明显高于对照组(P<0.05),组间比较有显著差异(P<0.05);在抑制剂组γ-GCSmRNA弱表达,较CSE 3 h组显著降低(P<0.05),组间比较无显著差异(P>0.05,表2)。
2.6 CSE对大鼠气道上皮细胞γ-GCS蛋白质的影响
细胞免疫化学显示在CSE 1、3和 6 h组,γ-GCS蛋白质在胞浆为中度至强阳性表达,而在抑制剂组其弱阳性表达。Western blot分析显示暴露CSE 1、3和6 h,γ-GCS蛋白质表达逐渐增强,6 h达高峰,三组均明显高于对照组,组间比较差异显著(P<0.05),而在抑制剂组其表达明显减弱,三组均明显低于CSE 3 h组(P<0.05,图3,表2)。
Tab.2 Effect of CSE onGSH content(nmol/mg pro),γ-GCS protein,mR NA and activity(U)in the bronchial epithelial cells of rats exposed to CSE(A value,,n=5)
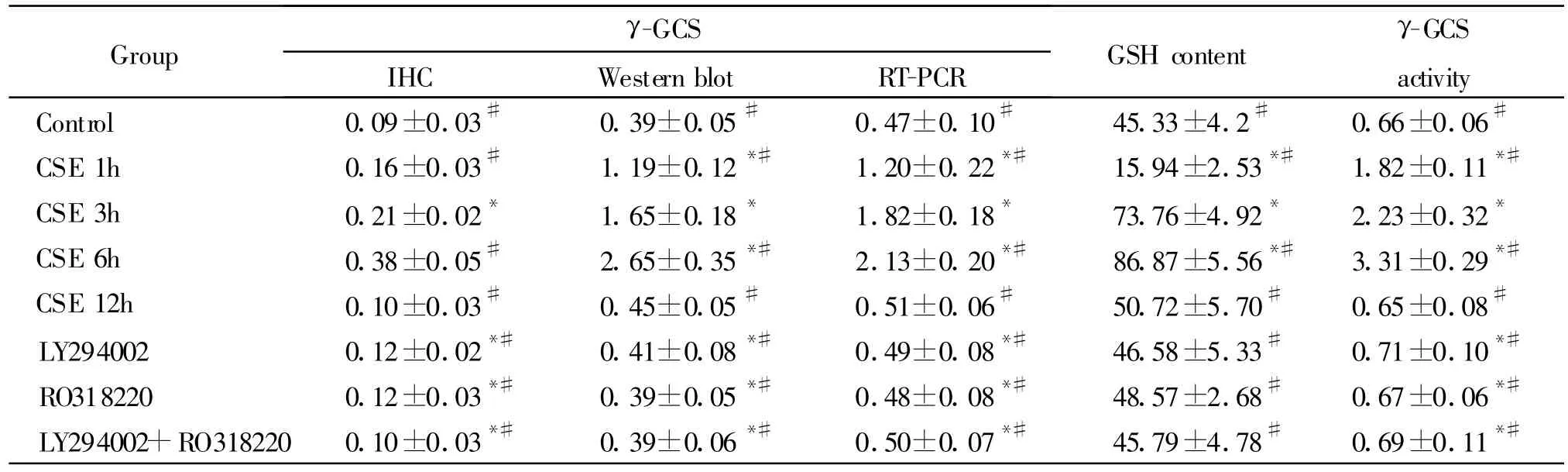
Tab.2 Effect of CSE onGSH content(nmol/mg pro),γ-GCS protein,mR NA and activity(U)in the bronchial epithelial cells of rats exposed to CSE(A value,,n=5)
*P<0.05 vs control group;#P<0.05 vs CSE 3 h group
Group γ-GCS IHC Western blot RT-PCR GSH content γ-GCS activity Control 0.09±0.03# 0.39±0.05# 0.47±0.10# 45.33±4.2# 0.66±0.06#CSE 1h 0.16±0.03# 1.19±0.12*# 1.20±0.22*# 15.94±2.53*# 1.82±0.11*#CSE 3h 0.21±0.02* 1.65±0.18* 1.82±0.18* 73.76±4.92* 2.23±0.32*CSE 6h 0.38±0.05# 2.65±0.35*# 2.13±0.20*# 86.87±5.56*# 3.31±0.29*#CSE 12h 0.10±0.03# 0.45±0.05# 0.51±0.06# 50.72±5.70# 0.65±0.08#LY294002 0.12±0.02*# 0.41±0.08*# 0.49±0.08*# 46.58±5.33# 0.71±0.10*#RO318220 0.12±0.03*# 0.39±0.05*# 0.48±0.08*# 48.57±2.68# 0.67±0.06*#LY294002+RO318220 0.10±0.03*# 0.39±0.06*# 0.50±0.07*# 45.79±4.78# 0.69±0.11*#

Fig.3 Effect of CSE on γ-GCS protein in the bronchial epithelial cells of rats by immunocytochemistry staining(×200)
2.7 CSE对γ-GCS活性的影响
暴露CSE 1、3和6 h,γ-GCS活性逐渐增高,较对照组显著增高,且组间比较有显著差异,而在抑制剂组明显低于CSE 3 h组(P<0.05,表2)。
2.8 相关性分析
相关性分析显示Nrf2与 γ-GCS、p-Akt和p-aPKCι/ζ呈正相关,p-aPKCι/ζ与 γ-GCS、p-Akt及 Nrf2 成正相关 ,p-Akt与 γ-GCS 、p-aPKCι/ζ及 Nrf2 成正相关(P<0.05)。
3 讨论
GSH是肺内主要的抗氧化剂。本研究发现,大鼠气道上皮细胞暴露CSE后,GSH含量首先出现消耗,然后逐渐升高,6 h达高峰。表明CSE通过氧化应激造成GSH耗竭,引起氧化/抗氧化失衡,继而增加GSH合成对抗氧化应激。
γ-GCS是肺内主要的抗氧化基因,是合成GSH的限速酶。我室前期研究已证明在COPD大鼠和患者中γ-GCS活性、mRNA、蛋白质明显高于正常对照组[4]。本研究结果表明,暴露CSE 后1、3、6 h,γ-GCSmRNA表达逐渐增强,在暴露CSE 1 h,其表达增加约1.85倍,3h约增加2.6倍,6 h约增加3.87倍,呈时间依赖性;γ-GCS蛋白质和活性变化趋势与其mRNA变化趋势相同;GSH含量在暴露CSE 3 h增加,6 h达高峰。以上分析表明CSE通过氧化应激上调γ-GCS mRNA和蛋白质的表达,提高γ-GCS的活性,增加GSH合成。
目前研究认为Nrf2是调节抗氧化基因表达的关键核转录因子,通过与抗氧化反应元件(antioxidant response element,ARE)结合调节抗氧化基因表达,是氧化还原感受器[5]。γ-GCS是肺内主要的抗氧化基因,是Nrf2调节的靶基因[6]。大鼠γ-GCS启动子缺乏ARE序列,Nrf2调节其机制仍不清楚。Li等研究表明Nrf2通过与γ-GCS上游某ARE相似区域结合,调节γ-GCS表达[7]。本研究结果显示,暴露CSE 1、3、6 h,Nrf2蛋白质主要表达在胞核,其胞核蛋白质表达明显增强,表明CSE诱导Nrf2核转位,同时,γ-GCSmRNA、蛋白质及其活性逐渐增强。相关性分析显示Nrf2与γ-GCS呈正相关。Reddy等研究表明Nrf2(-/-)大鼠Ⅱ型肺泡上皮细胞γ-GCS表达和GSH含量明显低于Nrf2(+/+)大鼠[8]。以上分析表明CSE通过氧化应激诱导Nrf2核转移,与γ-GCS的相应位点结合,调节γ-GCS表达。
研究表明PKC信号通路参与激活Nrf2。本研究发现,p-aPKCι/ζ蛋白质在暴露 CSE 1 h 增强,3 h达高峰,6 h稍降低,且Nrf2出现核转位,其胞核蛋白表达明显增强 ;预先加入RO318220,p-aPKCι/ζ蛋白表达减弱,Nrf2主要表达在胞浆,未出现核转位,其胞浆蛋白水平增强,表明 CSE通过aPKCι/ζ诱导Nrf2核转位,aPKCι/ζ抑制剂影响Nrf2核转位。同时,本研究发现,在 RO318220组,γ-GCS蛋白和mRNA低表达,其活性和GSH含量降低,表明RO318220影响γ-GCS表达和GSH 合成。相关性分析表明 aPKCι/ζ与Nrf2、γ-GCS及GSH成正相关。以上分析表明aPKCι/ζ参与Nrf2激活及其对γ-GCS调节和GSH合成。
研究表明PI3K/Akt信号通路也参与激活Nrf2及其对抗氧化基因的调节。本研究结果表明,暴露CSE 1和3 h,p-Akt阳性细胞率明显增加,其蛋白质表达明显增强,且Nrf2胞核蛋白质表达增强。然而,预先加入PI3K抑制剂LY294002,p-Akt阳性细胞率及其蛋白质表达减弱,Nrf2胞核蛋白质表达减弱,γ-GCS蛋白质、mRNA及其活性降低,GSH合成减少。相关性分析表明p-Akt与γ-GCS、Nrf2成正相关。Arisawa等研究证明熊去氧胆酸通过活化PI3K/Akt促进Nrf2核转位,提高γ-GCS表达和GSH合成,而LY294002抑制Nrf2核转位和降低GSH水平[9]。以上分析表明CSE通过PI3K/Akt信号通路诱导Nrf2核转位,LY294002抑制Nrf2核转位及降低抗氧化基因γ-GCS表达和GSH合成。
本研究结果表明,预先予以 RO318220,p-aPKCι/ζ蛋白质表达降低 ,p-Akt蛋白质无明显改变 ,而预先加入 LY294002,p-aPKCι/ζ和 p-Akt蛋白质均弱表达;相关性分析表明 p-Akt与 aPKCι/ζ成正相关。表明 PI3k/Akt信号通路调节aPKCι/ζ表达。
总之 ,本研究表明 PI3k/Akt-aPKCι/ζ信号通路可能参与Nrf2对抗氧化基因γ-GCS的调控。其可能机制是,CSE通过氧化应激耗竭抗氧化剂GSH,造成氧化/抗氧化失衡,同时,通过PI3k/Akt-aPKCι/ζ信号通路激活Nrf2,引起Nrf2核转位,与γ-GCS的相应位点结合,上调γ-GCS mRNA和蛋白质的表达,提高γ-GCS的活性,增加GSH合成,对抗氧化应激,维持氧化/抗氧化平衡。 对 PI3k/Akt-aPKCι/ζ-Nrf2-γ-GCS 信号通路的进一步研究有助于更加深入了解COPD氧化/抗氧化发病机制,为寻找更有效的治疗方法提供理论研究基础。
[1]江 刚,戴爱国,胡瑞成.Nrf2调控γ-谷氨酰半胱氨酸合成酶表达与慢性阻塞性肺疾病[J].国际呼吸杂志,2007,27(4):265-269.
[2]Wu R,Nolan E,Turner C.Expression of tracheal differentiated functions in serum-free hormone-supplemented medium[J].J Cell Physiol,1985,125(2):167-181.
[3]Nakamura Y,Romberger D J,Tate L,et al.Cigarette smoke inhibits lung fibroblast proliferation and chemotaxis[J].Am J Respir Crit Care Med,1995,151(5):1497-1503.
[4]陈 林,戴爱国,胡瑞成.核因子相关因子2及其蛋白激酶与γ谷氨酰半胱氨酸合成酶在慢性阻塞性肺疾病大鼠肺组织中的表达[J].中华结核和呼吸杂志,2006,29(7):487-489.
[5]McGrath-Morrow S,Lauer T,Yee M,et al.Nrf2 increases survival and attenuates alveolar growth inhibition in neonatal mice exposed to hyperoxia[J].Am J Physiol Lung Cell Mol Physiol,2009,296(4):565-573.
[6]Zhang H,Shih A,Rinna A,et al.Resveratrol and 4-hydroxynonenal act in concert to increase glutamate cysteine ligase expression and glutathione in human bronchial epithelial cells[J].Arch Biochem Biophys,2009,481(1):110-115.
[7]LiM,Chiu JF,KelsenA,et al.Identification and characterization of an Nrf2-mediated ARE upstream of the rat glutamate cysteine ligase catalytic subunit gene(GCLC)[J].J Cell Biochem,2009,107(5):944-954.
[8]Reddy N M,Kleeberger S R,Cho H Y,et al.Deficiency in Nrf2-GSH signaling impairs type II cell growth and enhances sensitivity to oxidants[J].Am J Respir Cell Mol Biol,2007,37(1):3-8.
[9]Arisawa S,Ishida K,Kameyama N,et al.Ursodeoxycholic acid induces glutathione synthesis through activation of PI3K/Akt pathway inHepG2 cells[J].Biochem Pharmacol,2009,77(5):858-866.
