高原低氧习服大鼠红细胞变形性的变化规律及其分子机制*
2011-05-24聂鸿靖田云梅张东祥
聂鸿靖,田云梅,张东祥,汪 海
(军事医学科学院卫生学环境医学研究所军事高原医学研究室,天津 300050)
红细胞有多种重要生理功能,其中红细胞膜在维持其正常形态、物质运输、变形性、膜抗原性、免疫功能等功能方面发挥着重要作用,红细胞变形性是组织和器官血液灌注及供氧的决定因素,是完成体内O2与CO2运输的保证,红细胞变形性降低会影响血液循环,导致微循环的有效灌注量减少,加重组织缺氧[1]。
以往研究表明,世居和移居久居人群的红细胞变形性显著高于对照组和移居暂居人群,认为高原低氧使红细胞的生成增加、更新加速、幼稚红细胞的比例提高,从而改善了红细胞群体的变形性,这是机体对高原低氧环境的一种适应性改变[2]。据报道,进入高原初期若能改善红细胞的变形性,对急性高原病的防治将会起到积极作用。但有关低氧引起红细胞变形性改变的机制尚不明确,因此本实验拟从红细胞变形性、红细胞的膜流动性、红细胞膜蛋白质表达、红细胞膜ATP酶活性及胞内Na+和Ca2+浓度方面观察高原低氧习服红细胞变形性的变化规律,初步探索其分子机制,为寻找急性高原病的防治新措施提供实验依据。
1 材料与方法
1.1 试剂
1,6-二苯基1 ,3,5-乙三烯(DPH)荧光探针 、磷脂酰乙醇胺(phosphatidylethanolamines,PE)、PC 、PS、SM的标准品均为 Sigma产品;APS、CHAPS、DTT、SDS、TEMED、Tris、Iodoacetamide、Acrylamide、N,N ‘ -Methylenebisacrylamide、Urea、Glycerol 、Glycine、Pharmalytes,pH 3~10、IPG Strip均为Amersham Pharmacia公司产品;BSA、DNase I、PMSF、RNase、Bromophenol blue、Acetone、Coomassie Brilliant Blue、Silver nitrate、Thiourea为Amresco公司产品;红细胞膜ATP酶活性的测定试剂盒、红细胞内Na+和Ca2+浓度的测定试剂盒均为南京建成生物制品有限责任公司产品;其余均为国产分析纯试剂。
1.2 动物模型
健康雄性Wistar大鼠30只,体质量(200±20)g,随机分为3组(n=10):常氧对照组、急性低氧组和低氧习服组。急性低氧组大鼠在小型动物低压舱内模拟海拔高度8000m进行低氧,8 h后下舱,2%戊巴比妥钠腹腔注射麻醉,心脏采血;低氧习服组大鼠在上述低压舱内模拟一定海拔高度进行间断低氧习服,在模拟海拔高度3000m间断低氧习服2周,每天4h;然后在模拟海拔高度5000m间断低氧习服2周,每天4h。于第29天同急性低氧组大鼠一起进行急性低氧,下舱后,心脏采血处理同上;常氧对照组大鼠在常氧条件下饲养,心脏采血处理同上。
1.3 红细胞变形性的测定
取20μl ACD 液抗 凝血液 加入 800μl的 15%PVP液中混匀,采用LG-B-190血细胞变形聚焦测试仪进行红细胞变形性的测定[2]。
1.4 红细胞膜流动性的测定
取1 ml肝素抗凝血,离心除去血浆和灰白色血细胞层,加入154 mmol/L NaCl溶液将沉淀红细胞悬浮,离心弃上清。然后按1∶10(V/V)加入预冷的低渗液(10mmol/L Tris-HCl,pH 7.4),混匀后置 4℃30min,以 12000r/min 4℃离心10min,弃上清,将得到红细胞膜样品按文献[2]方法进行,采用日立F-4000荧光分光光度计检测标记于红细胞膜内的DPH荧光偏振度(P),表示膜流动性。
1.5 红细胞膜胆固醇和总磷脂含量的测定
取1 ml肝素抗凝血,离心除去血浆和灰白色血细胞层后取红细胞液 200μl,加入双蒸水 500μl,置4℃10min,然后加异丙醇 5.5 ml摇匀,置 4℃10min,然后置室温1 h。加入三氯甲烷3.3 ml,置4℃10min,取出后置室温1 h。3000r/min离心10min后取上清液,通氮气将其吹干后,按文献[3]方法进行,红细胞膜胆固醇的测定采用邻苯二甲醛-醋酸-硫酸法,红细胞膜总磷脂的测定采用化学定量法。
1.6 红细胞膜磷脂成分PC、PS、PE、SM的测定
红细胞膜磷脂的提取同1.5,加三氯甲烷-甲醇(2∶1,V/V)20μl于通氮气吹干的 EP 管内,摇匀后,用毛细管吸取样品30μg,按文献[4]方法进行,采用津岛CS-930型双波长扫描仪测定红细胞膜磷脂成分 PC 、PS、PE、SM 的含量,扫描条件:测定波长 λs650nm,λF475 nm,狭缝 6.7 mm×0.2 mm。
1.7 红细胞膜蛋白质表达的变化
将1.5取得的样品重悬于300μl的裂解液(6 mol/L urea 、2 mol/L thiourea、4%CHAPS、40mmol/L Tris、60mmol/L DTT 、0.5%Pharmalytes 3-10,20μg/μl DNase I、5μg/μl RNase)中 ,混匀 ,室温静置2 h ,以4℃,12000r/min离心20min,取上清。蛋白质定量后依据文献[5]进行双向电泳。凝胶图像分析与质谱技术鉴定依据文献[6]。
1.8 红细胞膜ATP酶活性、红细胞内Na+和Ca2+浓度的测定
取1 ml肝素抗凝血,采用南京建成生物制品有限责任公司试剂盒分别按说明书进行操作[7]。
1.9 统计学处理
2 结果
2.1 急性低氧及低氧习服对大鼠红细胞变形性和膜脂流动性的影响
常氧对照组、急性低氧组和低氧习服组大鼠红细胞变形性分别为0.51±0.05、0.42±0.01和0.52±0.09。急性低氧组大鼠红细胞变形性低于常氧对照组(P<0.05),低氧习服组大鼠红细胞变形性较急性低氧组大鼠红细胞变形性增强(P<0.05),并接近于常氧对照组水平(图1A)。
膜脂流动性用荧光偏振度表示,荧光偏振度数值愈高表示膜脂流动性愈低,反之亦然。常氧对照组、急性低氧组和低氧习服组大鼠红细胞膜荧光偏振度分别为0.289±0.016、0.336±0.018和0.294±0.013。急性低氧组红细胞膜荧光偏振度明显高于常氧对照组(P<0.01),低氧习服组红细胞膜荧光偏振度明显低于急性低氧组(P<0.01),接近于常氧对照组的水平(图1B)。
2.2 急性低氧及低氧习服对大鼠红细胞膜胆固醇和总磷脂含量的影响
急性低氧组红细胞膜胆固醇含量、红细胞膜总磷脂含量、膜胆固醇/总磷脂的比值明显低于常氧对照组(P<0.01),而低氧习服组这三项指标明显高于急性低氧组(P<0.01),并接近于常氧对照组的水平(表1)。

Fig.1 Effect of acute hypoxia andhypoxia acclimatization on erythrocyte deformability and fluorescence polarization
Tab.1 Effect of acute hypoxia and hypoxia acclimatization on erythrocyte membrane cholesterin and total lipid(,n=10)
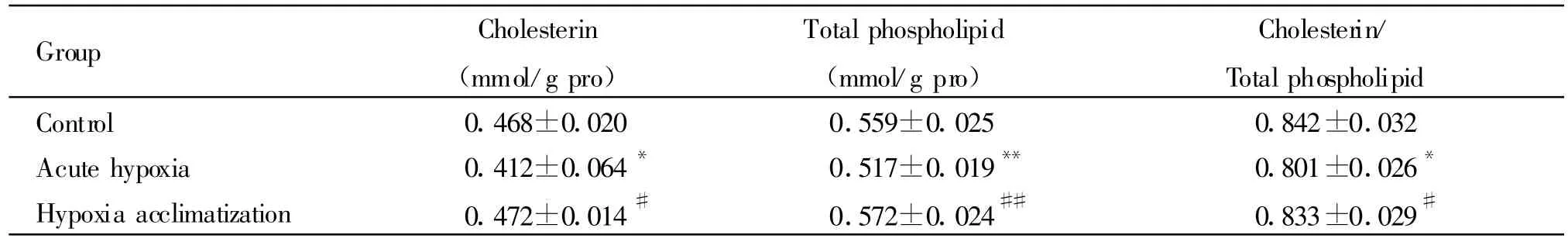
Tab.1 Effect of acute hypoxia and hypoxia acclimatization on erythrocyte membrane cholesterin and total lipid(,n=10)
*P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs acute hypoxia
Group Cholesterin(mmol/g pro)Total phospholipid(mmol/g pro)Cholesterin/Total phospholipid Control 0.468±0.020 0.559±0.025 0.842±0.032 Acute hypoxia 0.412±0.064* 0.517±0.019** 0.801±0.026*Hypoxia acclimatization 0.472±0.014# 0.572±0.024## 0.833±0.029#
2.3 急性低氧及低氧习服对大鼠红细胞膜磷脂各成分含量的影响
急性低氧组PS、SM 含量、SM/PC明显高于常氧对照组(P<0.01),PC含量明显低于常氧对照组(P<0.01),而低氧习服组PS、SM 含量、SM/PC低于或明显低于急性低氧组(P<0.05,P<0.01),并接近常氧对照组水平,PC含量明显高于急性低氧组(P<0.01),并接近常氧对照组水平,三组之间PE含量的变化无明显差别(表2)。
Tab.2 Effect of acute hypoxia and hypoxia acclimatization on the components of erythrocyte membrane lipids(,n=10)

Tab.2 Effect of acute hypoxia and hypoxia acclimatization on the components of erythrocyte membrane lipids(,n=10)
**P<0.01 vs control;#P<0.05,##P<0.01 vs acute hypoxia
Group Phosphatidylserines(PS)(g/L)Phosphatidylethanolamines(PE)(g/L)Phosphatidylcholine(PC)(g/L)Sphingomyelin(SM)(g/L)SM/PC Control 0.379±0.065 0.431±0.055 0.609±0.022 0.151±0.030 0.247±0.045 Acute hypoxia 0.463±0.065** 0.471±0.052 0.548±0.036** 0.241±0.036** 0.440±0.054**Hypoxia acclimatization 0.383±0.061# 0.443±0.044 0.591±0.019## 0.168±0.035## 0.283±0.058##
2.4 急性低氧及低氧习服对大鼠红细胞膜蛋白质含量的影响
选取7个差异蛋白质点,急性低氧后蛋白质点1、3 、4、5表达降低(P <0.05),蛋白质点 2、6、7 表达无明显改变;低氧习服后蛋白质点1、3、4表达显著降低(P <0.01),蛋白质点2、5、6、7表达显著增高(P<0.01,图2);差异蛋白质点的等电点、分子量和相对含量结果见表3;质谱鉴定结果见表4,分别是补体结合蛋白、水通道蛋白I、膜攻击复合物抑制因子、脂质移行酶、葡萄糖运载体、氨基磷脂转移酶、依赖ATP的翻转酶。

Fig.2 Enlarged 2-DEmaps of rat erythrocyte membrane.The numbers showed the protein spots which relative spot volume changed
Tab.3 Effect of acute hypoxia and hypoxia acclimatization on the relative spot volume of erythrocyte membrane protein spots(,n=3)

Tab.3 Effect of acute hypoxia and hypoxia acclimatization on the relative spot volume of erythrocyte membrane protein spots(,n=3)
*P<0.05,**P<0.01 vs control;##P<0.01 vs acute hypoxia
Spot pI MWt(kD)Relative spot volume(%)Control Acute hypoxia Hypoxia acclimatization 1 7.38 29.031 0.486±0.018 0.451±0.011* 0.204±0.016**##2 8.08 33.108 0.126±0.011 0.123±0.012 0.468±0.008**##3 6.05 18.697 0.482±0.016 0.447±0.011* 0.205±0.005**##4 7.72 18.471 0.326±0.006 0.309±0.008* 0.191±0.006**##5 4.43 31.983 0.421±0.012 0.391±0.011* 0.601±0.011**##6 5.96 38.323 0.428±0.022 0.419±0.024 0.817±0.019**##7 7.83 35.601 0.188±0.012 0.178±0.016 0.478±0.018**##
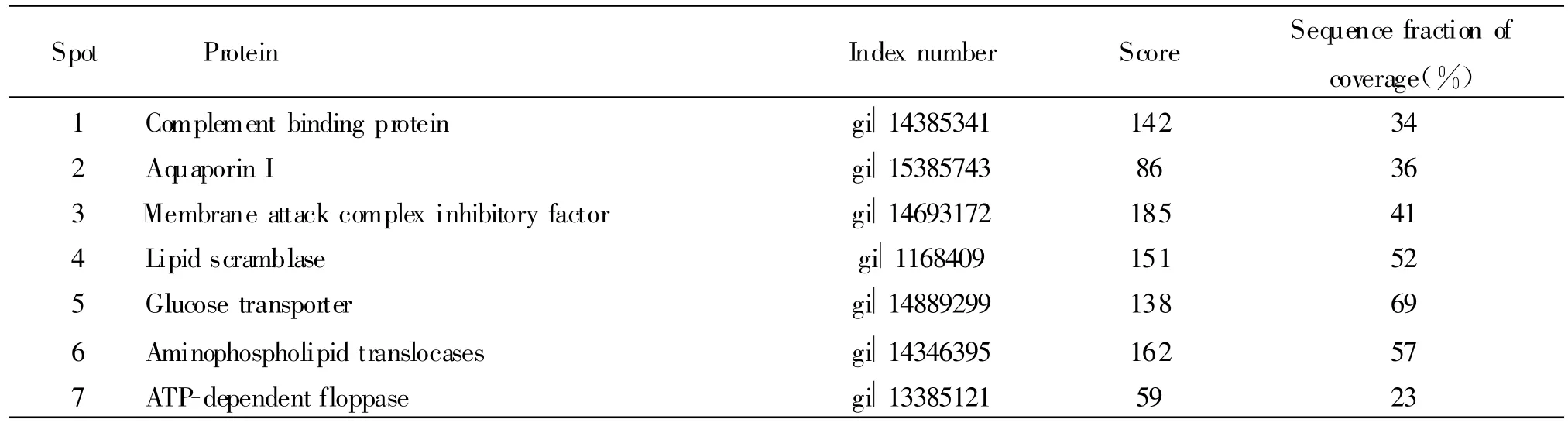
Tab.4 Identification result of mass spectrum of different proteins
2.5 急性低氧及低氧习服对大鼠红细胞ATP酶活性、红细胞Na+和Ca2+浓度的影响
急性低氧组红细胞Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶活性明显低于常氧对照组(P<0.01),而低氧习服组这两种酶活性均明显高于急性低氧组(P<0.01),并接近于常氧对照组的水平(表5)。
急性低氧组红细胞内Na+浓度和Ca2+浓度明显高于常氧对照组(P<0.01),低氧习服组这两种离子浓度均明显低于急性低氧组(P<0.01),并接近于常氧对照组的水平(表6)。
Tab.5 Effect of acute hypoxia and hypoxia acclimatization on ATP enzyme activity of erythrocyte membrane(μmol/(mg pro◦h),,n=10)

Tab.5 Effect of acute hypoxia and hypoxia acclimatization on ATP enzyme activity of erythrocyte membrane(μmol/(mg pro◦h),,n=10)
**P<0.01 vs control;##P<0.01 vs acute hypoxia
Group Na+-K+-ATP enzyme Ca2+-Mg2+-ATP enzyme Control 17.032±0.891 18.346±0.287 Acute hypoxia 15.788±0.415**16.376±0.227**Hypoxia acclimatization 16.963±0.816##18.179±0.142##
Tab.6 Effect of acute hypoxia and hypoxia acclimatization on ionic concentration of Na+and Ca2+in erythrocyte(μmol/g,,n=10)

Tab.6 Effect of acute hypoxia and hypoxia acclimatization on ionic concentration of Na+and Ca2+in erythrocyte(μmol/g,,n=10)
**P<0.01 vs control;##P<0.01 vs acute hypoxia
Group Na+ Ca2+Control 34.170±2.389 4.610±1.077 Acute hypoxia 40.330±2.230**7.500±1.049**Hypoxia acclimatization 35.420±1.730##4.910±0.504##
3 讨论
红细胞变形性是保证微循环有效灌注和组织供氧的重要因素,红细胞的膜流动性是影响红细胞变形性的重要因素,膜流动性是指膜内部脂质和蛋白质分子的运动性。本实验结果表明,急性低氧使大鼠红细胞变形性和红细胞膜流动性均明显降低,经低氧习服后,变形性和膜流动性均有所改善,可见低氧习服对急性低氧致红细胞变形性和膜流动性降低具有一定的改善作用,这提示,低氧使红细胞变形性变化可能与红细胞膜流动性的改变有密切关系[1]。
红细胞膜中脂质占42%,脂质的变化与膜流动性关系密切,红细胞膜上的胆固醇为红细胞膜的蛋白质提供结构骨架,可调节细胞膜流动性。红细胞膜胆固醇含量与磷脂有一定的比例,若胆固醇/磷脂(C/P)比值降低,则膜流动性降低,此时红细胞变形性降低[2]。本实验结果表明,急性低氧后红细胞膜胆固醇含量、总磷脂含量、胆固醇/总磷脂的比值下降,经低氧习服后这三项指标有所恢复,接近于常氧对照组的水平,可见低氧习服对急性低氧致红细胞膜胆固醇含量、总磷脂含量、胆固醇/总磷脂的比值降低具有一定改善作用,低氧习服后大鼠红细胞膜流动性升高,变形性增强,从而有利于组织和器官供氧。
红细胞膜外层脂类富含PC和SM,内层脂类以PS和PE为主。膜磷脂的不对称分布是维持红细胞正常形态、良好的变形性、膜的结构与功能的基础[3]。本实验结果表明,急性低氧后红细胞膜PS含量、SM 含量、SM/PC比值明显升高,PC含量明显下降,经低氧习服后有所恢复,提示低氧习服对急性低氧致红细胞膜磷脂成分的变化具有一定改善作用,红细胞变形性增强可能与低氧习服引起的红细胞膜磷脂各成分含量的变化有关,低氧习服对维持红细胞的正常功能,保证组织和器官的供氧有重要作用。
近年国外高原医学学者把蛋白质组学概念及其相关的技术方法应用到高原医学研究领域中,目前主要集中于揭示高原低氧习服/适应机制方面的研究[8-10],但与高原低氧习服/适应极为密切的红细胞蛋白质组学研究未见报道,因此本实验进行了低氧大鼠红细胞膜蛋白质组学的初步探索,实验结果表明,与维持红细胞膜正常不对称性有关的氨基磷脂转移酶、依赖ATP的翻转酶在急性低氧后表达虽变化不明显,但在低氧习服后表达明显增加,而脂质移行酶在急性低氧后表达下降,在低氧习服后表达进一步下降。其中氨基磷脂转移酶能够将脂双层外层的PS和PE翻转至内层,对PC无此作用;依赖ATP的翻转酶可将脂双层内层的PE、PS、PC翻转至外层,与氨基磷脂转移酶作用正好相反,但速度慢;脂质移行酶可促进脂质翻转。氨基磷脂转移酶表达增加的结果促使PS和PE内翻;依赖ATP的翻转酶表达增加的结果促使PS、PE、PC外翻,但 PS、PE外翻的结果被氨基磷脂转移酶内翻的作用所抵消,致PC增加;脂质移行酶表达降低可能在一定程度上抑制了脂质的翻转,综上这三种酶的作用使得低氧习服大鼠红细胞膜磷脂成分发生变化,使得低氧习服后红细胞变形性增强,从而保证组织和器官供氧。
另外本实验还发现,低氧习服后,与红细胞免疫功能有关的补体结合蛋白和膜攻击复合物抑制因子表达下降,提示红细胞的免疫功能下降;维持红细胞内外水平衡的水通道蛋白Ⅰ表达增加,提示水分子通过红细胞膜的量增加,从而保护红细胞不破溶;与红细胞代谢有关的葡萄糖运载体表达增加,提示葡萄糖通过红细胞膜的量增加,红细胞代谢增强。
红细胞ATP酶的主动转运功能对红细胞与外环境进行物质交换和保持离子内环境稳定具有重要意义。生理状态下,Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶基本功能是维持胞内低Na+、低Ca2+的状态。红细胞的许多功能都依赖于胞内外的离子浓度差,一旦这种浓度差减低,红细胞就要受到功能性损伤,甚至引起死亡[7]。本实验结果表明,急性低氧后红细胞膜Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶活性下降,经低氧习服后有所恢复,可见低氧习服对急性低氧致大鼠红细胞膜ATP酶活性的降低有一定改善作用。急性低氧时大鼠红细胞ATP与血红蛋白结合,使得胞浆ATP水平显著下降,ATP的下降使得红细胞膜ATPase能量供给不足,红细胞离子转运失衡,难以维持其正常形态、良好的变形性以及功能,从而导致红细胞变形性下降;关于低氧习服引起红细胞ATP水平恢复的具体机制尚有待于进一步的研究。
Na+、Ca2+是红细胞内的重要阳离子,其含量的相对稳定对维持红细胞的正常形态和功能起重要作用。急性低氧时由于红细胞ATP含量减少、钠泵和钙泵功能降低,红细胞内Na+和H2O潴留,Ca2+积聚,红细胞肿胀,丧失其正常的形态,导致红细胞变形性降低[7]。本实验结果表明,急性低氧后红细胞内Na+和Ca2+浓度升高,经低氧习服后有所恢复,可见低氧习服对急性低氧致大鼠红细胞膜内钠和钙离子浓度变化有一定改善作用。国外学者认为,红细胞内Ca2+水平升高是其变形性降低的重要原因之一。低氧习服对急性低氧致大鼠红细胞膜内钠和钙离子浓度变化有一定保护作用,从而保证了红细胞的变形性,保证了组织和器官的供氧。
[1]洪 平,冯连世,赵 晶,等.模拟不同海拔高度训练对大鼠红细胞变形性的影响[J].中国应用生理学杂志,1998,14(4):296-299.
[2]苗 会,薛全福,庄逢源,等.低氧性肺动脉高压大鼠红细胞的变形性、膜流动性及外形变化[J].基础医学与临床,1997,17(1):58-62.
[3]邹春华,宋强华,李素芝,等.高原红细胞增多症患者红细胞膜物理特性变化及分子机制探讨[J].中华血液学杂志,2000,21(5):226-227.
[4]徐承水,王春梅,张祥沛.灵芝提取物对红细胞膜磷脂成分及电泳率的影响[J].曲阜师范大学学报,2002,28(2):93-95.
[5]Olivieri E,Herbert B,Righetti P G.The effect of protease inhibitors on the two-dimensional electrophoresis pattern of red blood cell membranes[J].Electrophoresis,2001,22(3):560-565.
[6]万晶宏,罗 凌.人肺巨细胞癌蛋白质组的二维电泳和计算机图像分析[J].中国生物化学与分子生物学报,2000,16(6):820-826.
[7]邹春华,李素芝,薛增军,等.高原红细胞增多症患者红细胞膜ATP酶活性及电子转运功能[J].解放军预防医学杂志,2000,18(4):249-250.
[8]Vasquez R,Villena M.Normal hematological values for healthy persons living at 4000meters in Bolivia[J].High Alt Med Biol,2001,2(3):361-367.
[9]Gozal E,Gozal D,Pierce W M,et al.Proteomic analysisof CA1 and CA3 regions of rat hippocampus anddifferential susceptibility to intermittent hypoxia[J].J Neurochem ,2002,83(2):331-345.
[10]Gelfi C,De Palma S,Cerretelli P,et al.Two-dimensional protein map of human vastus lateralis muscle[J].Electrophoresis,2003,24(1-2):286-295.
