小剂量芬太尼联合咪达唑仑对大鼠皮质神经元钠离子通道电流的影响*
2011-05-24杨云春伍佳丽周述芝王晓斌
杨云春,周 贤,伍佳丽,姜 鲜,周述芝,王晓斌
(泸州医学院附属医院麻醉科,四川 泸州 646000)
大脑皮质神经元参与了意识的形成和维持意识清醒,而皮质功能是通过各种离子通道完成,其中钠离子通道开放引起的去极化内向电流是其产生动作电位的关键。咪达唑仑是目前临床上广泛应用的镇静催眠药,其作用位点与神经元电压门控型钠离子通道有关[1];而芬太尼为阿片类镇痛药,但镇静效果欠佳。两者临床上常小剂量复合应用于局部麻醉强化用药,但其联合应用后发生协同效应的原因目前还不完全清楚,亦未见相关文献报道。本实验选择大脑皮质神经元作为研究对象,观察镇静剂量咪达唑仑和芬太尼对大脑皮质神经元上的钠离子通道电流的影响。
1 材料与方法
1.1 材料
选SD新生大鼠(1~3 d),雌雄不拘,清洁级,由泸州医学院实验动物中心提供;膜片钳放大器(AXOPA/PFTCH200B Axon Instruments USA),微管电极拉制器(PC-10NARISHIGE JAPA/PFN),倒置相差显微镜(AXIOVERT135 ZEISS GERMANY),A/D、D/A 转换器(DIGIDATA-1200Axon Instruments USA),二氧化碳孵箱(1815Tc SHEL-LAB U.S.A),数据处理系统pClamp软件(10.1)(Axon Instruments);咪达唑仑(2 mg/2 ml)、芬太尼(0.01μg/2 ml,湖北宜昌人福药业有限公司),TTX(河豚毒素,大连瑞芳化学公司)。
1.2 实验方法与分组
1.2.1 细胞培养 选用1~3天SD新生大鼠大脑皮层神经元行原代培养。取培养第4~9天的细胞用于全细胞膜片钳记录。
1.2.2 膜片钳实验记录 应用全细胞膜片钳法进行记录,选用形态呈锥体形,有一较长轴突和1~3个树突的细胞进行记录,用经100%O2饱和的细胞外液做持续灌流。两步法拉制玻璃微电极,内充电内液后,阻抗2~5 MΩ。采样频率20kHz,低通滤波1 kHz,在电极尖端与细胞膜接触形成巨阻封接(>1 GΩ)后,吸破尖端膜片形成全细胞状态,补偿电容和串联阻抗后,进行下一步电流记录。数据采集、贮存和分析实验中全细胞电流信号由计算机采集,电刺激脉冲的输出以及电信号的采入均通过计算机程序pClamp10.1及digidata1200转换器接口来完成。全细胞模型记录钠通道电流(INa)的钳制电压为-90mV,从-80mV开始以10mV递增的去极化方波刺激,时间持续50ms,直到30mV ,记录电流变化,绘制电流电压曲线。
1.2.3 实验分组 空白组:用不含药物的细胞外液灌流记录最大钠离子通道电流;F5组:用含5μg/L芬太尼的细胞外液灌流记录最大钠离子通道电流;F5+M200组:用含200μg/L咪达唑仑以及5μg/L芬太尼的细胞外液灌流记录最大钠离子通道电流。各组总共记录5个细胞。
1.3 统计学分析
实验数据采用pClamp10.1软件(Axon Instruments)进行分析处理。采用同一膜片实验前后自身对照,数据以均数±标准差()表示,显著性检验采用配对 t检验,t检验采用SPSS 14.0软件完成。
2 结果
2.1 培养的大鼠皮质神经元上钠离子通道的电生理特性
采用全细胞电压钳制脉冲刺激模式记录大鼠皮质神经元细胞膜上钠离子通道电流(INa),保持电位(holding potential,hp)为-90mV,测试电压(test potential,TP)为-80mV 到+30mV,脉冲阶跃步长为10mV,共12个阶跃,钳制时间(Clamp time,ct)为50ms,引出大鼠皮质神经元细胞膜上的 INa.该电流为快速激活的内向电流,持续时间约 5 ms,能被1μmol/L的TTX阻断,而TTX为钠离子电流的特异性阻断剂,同时在电极内液中不含钙离子且含钙离子螯合剂EGTA,细胞外液中加入了钙离子特异性阻断剂CdCl2,因此可以证实该电流为对TTX敏感的钠电流。
2.2 咪达唑仑复合芬太尼对钠离子通道电流的影响
2.2.1 各个细胞用药前后最大电流变化 用药前细胞平均最大电流为(-267.00±115.36)pA/pF,而用药后,F5组平均最大电流为(-231.90±97.16)pA/pF,与空白组比较,有显著性差异(n=5,P<0.05);200μg/L咪达唑仑合用5μg/L芬太尼(F5+M200)灌流后平均最大电流为(-213.98±91.68)pA/pF,与F5组比较,也存在显著性差异(n=5,表1)。
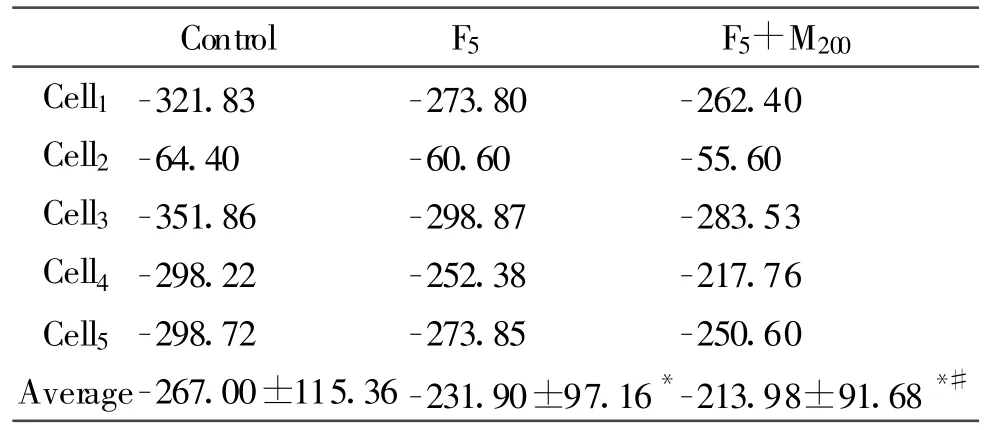
Tab.1 Changes of density of sodium peak currents in cortical neurons
2.2.2 同一个细胞在不同膜电压刺激下各组钠离子通道电流 图1表示钳制电位为-90mV时,自-80mV起,刺激电压每次增加10mV,直到+30mV;在同一个细胞上所记录到的电流曲线图,可见电流幅度的变化。A为对照组,B为F5组,C为F5+M200组,D为用细胞外液灌流后电流恢复情况。
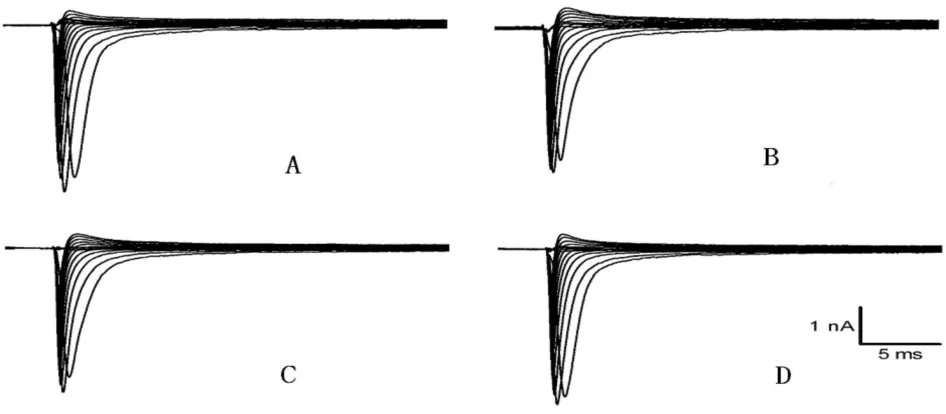
Fig.1 Changes of voltage-gated sodium channels currents of cortical neuron in different voltages
2.2.3 芬太尼、芬太尼复合咪达唑仑对细胞电流-电压曲线的影响 图2表示以不同电压下的最大电流值为纵坐标,刺激电压为横坐标的电流-电压曲线图,从电流电压曲线图可以看出,芬太尼合用咪达唑仑后,对钠离子通道的电流抑制程度较单用芬太尼时明显增强。

Fig.2 Changes of sodium channels currents-voltage of cortical neuron in different groups
3 讨论
随着分子生物学和神经生理学的迅速发展,人们对全麻药的作用机理认识不断提高,目前认为全麻药主要作用于膜蛋白而非膜脂质,随着膜片钳技术的发展,越来越多的证据表明神经细胞膜上的离子通道是全麻药的作用靶位[1~3]。由于电压门控型钠离子通道是可兴奋性细胞产生动作电位和传导神经冲动的关键部位和决定因素,对神经元的联系和整合功能起着极其重要的作用,因此被认为是全麻药分子作用靶位。皮质神经元是大脑中的最重要部分,参与意识的形成和维持意识清醒,是记忆的重要编码部位。而皮质的功能通过各种离子通道完成,其中钠离子通道开放引起的去极化内向电流是兴奋性细胞产生动作电位的关键。咪达唑仑是目前临床上广泛应用的镇静药,主要用于全麻的诱导以及局部麻醉后的镇静,具有起效快,作用时间短,有较优良的顺行性遗忘作用,但是缺乏镇痛作用;而芬太尼为阿片类镇痛药,但是镇静效果欠佳。因此两者作用互补,应用在镇静镇痛等方面具有协同作用[4],从而减少单一药物的用量,降低不良反应的发生,到目前为止,文献证实咪达唑仑复合芬太尼在镇静效能方面是比较理想的选择。但就其联合应用后发生协同效应的原因目前还不完全清楚,亦未见相关文献报道。
因此本实验选择大脑皮质神经元作为研究对象,观察镇静剂量咪达唑仑 200μg/L和芬太尼5μg/L(在定量药理学中,不同种属间药物量的换算公式DB=DA*(WA/WB)1/3*RB/RA,DB为要求得的B种动物的公斤体重剂量,DA是已知A种动物的公斤体重剂量;WA、WB为已知动物体质量,RB、RA是体型系数。大鼠的体型系数是0.09,人的体型系数是0.1)对大脑皮质神经元上的钠离子通道电流的影响对大脑皮质神经元上的钠离子通道电流的影响,探讨两种药物联合应用后药理学作用增强的分子作用机制。在本实验之前,我们通过预实验发现,咪达唑仑对大鼠皮质神经元钠离子通道电流的影响轻微,亦未表现出浓度依赖性抑制,因此在本实验过程中,未再单独观察咪达唑仑对钠离子通道电流的影响。结果发现小剂量芬太尼联合咪达唑仑后对钠离子通道电流的抑制明显大于对照组和单用小剂量芬太尼组,其P值均小于0.05,提示两药合用后对大脑皮质神经元钠离子通道电流抑制作用增强,这可能是两种药物临床合用后镇静镇痛作用增强的机制之一。
[1]Zhou X,Dong X W,Priestley T.The neuroleptic drug,fluphenazine,blocks neuronal voltage-gated sodium channels[J].Brain Res,2006,1106(1):72-81.
[2]Haeseler G,Foadi N,Ahrens J,et al.Tramadol,fentanyl and sufentanil but not morphine block voltage-operated sodium channels[J].pain,2006,126(1-3):234-244.
[3]Martella G,De Persis C,Bonsi P,et al.Inhibition of persistent sodium current fraction and voltage-gated L-type calcium current by propofol in cortical neurons:implications for its antiepileptic activity[J].Epilepsia,2005,46(5):624-635.
[4]Baris S,Karakaya D,Aykent R,et al.Comparison of midazolam with or without fentanyl for conscious sedation and hemodynamics in coronary angiography[J].Can J Cardiol,2001,17(3):277-281.
[5]Richman P S,Baram D,Varela M,et al.Sedation during mechanical ventilation:a trial of benzodiazepine and opiate incombination[J].Crit Care Med,2006,34(5):1395-1401.
