异氟醚吸入对新生大鼠认知功能的影响及 p38MAPK抑制剂的干预作用
2011-05-23由振东石雪银王成才
王 强,由振东,石雪银,王成才*
(1第二军医大学附属长征医院,上海 200003;2第二军医大学神经生物学教研室)
认知功能障碍是由多因素引起的中枢神经系统并发症,异氟醚等吸入麻醉药为其重要发病原因之一,但作用机制尚不明确。2010年 3月,我们观察了 p38细胞内丝裂原活化蛋白激酶通路(MAPK)抑制剂 SB203580对异氟醚诱发新生大鼠学习与记忆功能损害的影响,旨在为进一步异氟醚导致新生大鼠认知功能障碍的作用机制。
1 材料与方法
1.1 材料 7日龄新生 SD大鼠 60只(第二军医大学)雌雄不限;p38MAPK抑制剂 SB203580(碧云天生物技术研究所),双喹啉-4-羧酸二钠(BCA)蛋白质定量试剂盒;聚丙烯酰胺(PAGE),双丙烯酰胺,十二烷基硫酸钠(SDS),焦碳酸二乙酯(DEPC),Tris碱,甘氨酸,甲醇等。
1.2 动物分组及处理 将 60只新生 SD大鼠随机分为 5组各 12只。其中A组正常饲养;B、C组均置于自制麻醉气体吸入箱中并分别吸入 1.2%、1.8%异氟醚,D、E组处理分别同 B、C组,但在吸入异氟醚前 30 min腹腔注射 SB203580(5μg/kg),四组麻醉期间均正常饲养并经腹腔补充葡萄糖生理盐水0.5 ml/次、1次/2 h。 6周后进行下述实验。
1.3 行为学实验(Morris水迷宫实验) ①定位航行试验:历时 5 d,将大鼠从四个入水点面向池壁放入水中,其 2 min内寻找平台的时间为逃逸潜伏期(T1);②空间探索试验:定位航行实验结束后,于第6天移除平台位置,将大鼠任选一入水点放入水中,30 s内在原平台所在象限停留时间为探索时间(T2)。整个认知功能测试过程中,保持实验室内灯光、物品摆放等室内环境一致,以排除环境干扰。实验步骤参照 Vorhees等[1]研究。
1.4 海马区 p38蛋白含量测定 Morris水迷宫实验后 24 h内处死大鼠取海马组织,采用Western blot法测定 p38蛋白含量:①在海马组织中加入预冷的蛋白质抽提试剂,用匀浆器 30 s/次低速匀浆,每次匀浆间隔冰浴 1 min,至组织完全裂解。②按 50∶150比例混合 BCA试剂 A和 BCA试剂 B以配制BCA工作液。③SDS-PAGE电泳:将配制好的 BCA工作液缓慢加入到装配板中至凝胶高度为 6 cm左右,预留 1.5 cm高度配制积层胶。每板凝胶溶液上覆盖 0.1%SDS,放置 1 h后使用滤纸吸去分离胶上层覆盖的所有溶液,加入电泳缓冲液、上样,使用BioRad电泳。④取上述凝胶用 1×转移缓冲液稍微清洗,采用 Bio-Rad蛋白转移装置夹板于 100 V恒压、4℃条件下转移。⑤在5%BSA溶液中室温孵育1 h,TBS/T洗膜 3次、每次 5 min,加入一级抗体 4℃过夜,同前洗膜 3次后加入 HRP标记的二级抗体,室温孵育膜 1 h,同前洗膜 3次。⑥将膜置于反应液中室温孵育 5 min,去除过量溶液后夹在两塑料薄膜间,以 X光胶片曝光。图片扫描保存,软件分析特异条带灰度值。
1.5 统计学方法 采用 SPSS18.0软件进行统计学处理。采用重复测量及方差分析,计量资料以±s表示,P≤0.05为差异有统计学意义。
2 结果
2.1 行为学实验 五组不同时间点 T1见表1;T2在 A组为 (12.04±5.493 6)s、B组为(9.581±4.258 6)s、C组为 (8.675±3.671)s、D组为(11.825±4.288 8)s、E组为(10.467±5.095 6)s,B、C组均显著短于 A组,D、E组分别显著长于 B、C组(P均 <0.05)。
2.2 五组大鼠海马区 p38蛋白含量 A组为 380.37±8.08、B组为 491.44±2.51、C组为 681.79±16.82、D组为 404.57±2.87、E组为 573.20±13.73,B、C组均显著高于 A组(P均 <0.05),D、E组分别显著低于 B、C组(P均 <0.05)。
表1 五组不同时间点 T 1比较(s,n=12,±s)
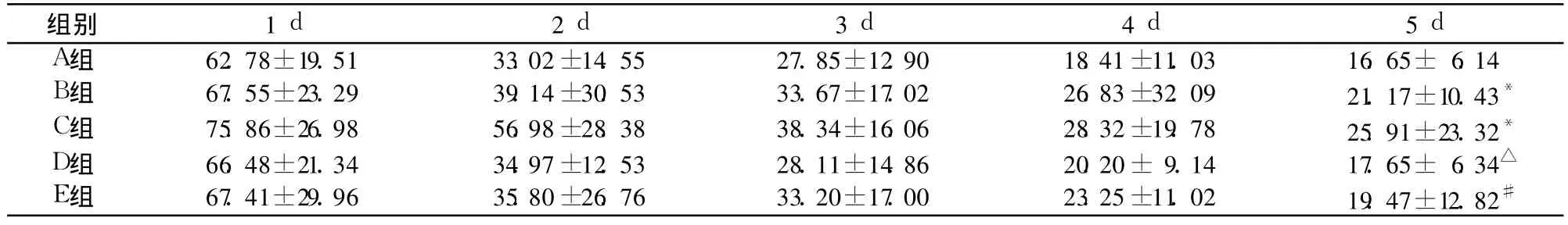
表1 五组不同时间点 T 1比较(s,n=12,±s)
注:与对照组比较,*P<0.05;与 B组比较,△P<0.05;与 C组比较,#P<0.05
组别 1 d 2 d 3 d 4 d 5 d A组 62.78±19.51 33.02±14.55 27.85±12.90 18.41±11.03 16.65± 6.14 B组 67.55±23.29 39.14±30.53 33.67±17.02 26.83±32.09 21.17±10.43*C组 75.86±26.98 56.98±28.38 38.34±16.06 28.32±19.78 25.91±23.32*D组 66.48±21.34 34.97±12.53 28.11±14.86 20.20±9.14 17.65± 6.34△E组 67.41±29.96 35.80±26.76 33.20±17.00 23.25±11.02 19.47±12.82#
3 讨论
认知功能障碍在流行病学、病因学、发病机制、预防和治疗等方面均存在众多未知领域。手术和麻醉并发症对其有促进作用[2]。研究认知功能障碍主要是从学习与记忆功能损伤方面进行。异氟醚为目前临床常用吸入麻醉药之一,用途广泛。研究表明,异氟醚可诱发新生大鼠认知功能障碍,并对其成年后的学习与记忆功能仍有影响[3],但具体机制仍有诸多不明之处。出生后第 7天是大鼠神经系统发育的一个瓶颈期,此时其神经系统极易受损伤,故本研究选择 7日龄大鼠进行异氟醚处理;按标准夹尾法测定的大鼠异氟醚最低肺泡有效浓度(MAC)值约为 1.8%和 1.2%[4],故本研究异氟醚深度分别选择 1.8%和 1.2%。
p38MAPK通路是细胞内的应激反应信号通路,在许多疾病发病过程中具有重要作用。许多研究表明,激活海马 p38MAPK通路可导致学习与记忆功能受损[5,6],而抑制海马 p38MAPK通路活化可减轻学习与记忆功能损伤;p38MAPK通路可被应激刺激(Uv、H2O2、热休克和缺氧等)、炎性因子 (TNF-α、IL-1和成纤维细胞生长因子等)及脂多糖(LPS)和革兰阳性细菌细胞壁成分而激活[7,8],本研究显示,B、C组T1均显著长于 A组,而 D、E组分别显著短于 B、C组;B、C组 T2均显著短于 A组,而 D、E组分别显著长于 B、C组;B、C组海马区 p38蛋白含量显著高于 A组,而 D、E组分别显著低于 B、C组。提示异氟醚可诱发新生大鼠学习与记忆功能受损,p38MAPK抑制剂 SB203580则可明显减轻其受损程度。故通过诱导炎症因子表达激活p38MAPK通路可能为异氟醚诱发新生大鼠认知功能障碍的途径之一。
综上所述,异氟醚诱发新生大鼠认知功能障碍与 p38MAPK通路活化具有密切关系,抑制该通路活化可减轻认知功能损害。
[1]Vorhees CV,Williams MT.Morris water maze:procedures for assessing spatial and related forms of learning and memory[J].Nat Protoc,2006,1(2):848-858.
[2]Hanning CD.Postoperative cognitive dysfunction[J].Brit J Anaesth,2005,1(95):82-87.
[3]Jevtovic TV,Hartman RE,Izumi Y,et al.Early exposure to comman anesthetic agents carsese widespread neurodegeneration in the developing rat brain and persisted learning deficts[J].J Neurosci,2003,23(3):876-882.
[4]Johns RA,Moscicki JC,Difazio CA.Nitric oxide synthase inhibitor dose-dependently and reversibly reduces the threshold for halothane anesthesia[J].Anesthesiology,1992,77(4):779-784.
[5]Togashi H,Mori K,ItohY,et al.Involvement of interleukin-1beta nitric oxide pathway in the postischemic impairment of long-term potentiation of the rat hippocampus[J].Neurosci Lett,2001,313(3):133-136.
[6]Vereker E,Donnell E,Lynch MA.The inhibitory effect of interleukin-1beta on long-term potentiation is coupled with increased activity of stress-activated protein kinases[J].Neurosci,2000,20(18):6811-6819.
[7]Boder AJ,Ye R,Lees-Miller SP.Uv-light induces p38MAPK-dependent phosphorylation of Bel10[J].Biochem Biophys Res Commun,2003,301(4):923-926.
[8]Taro M,Ingela T,Majlis B,et al.p 38MAPK kinase negatively regulatesengothelial cell survival,proliferation,ang differentiation in FGF-2-stimul-ated angiogenesis[J].JCell Biology,2002,156(1):149-160.
