实时定量PCR分析不同栽培措施下番茄蔗糖转运蛋白(SUT1)基因表达差异
2011-05-22谢小玉尹永根福田直也
谢小玉 尹永根 福田直也
(1西南大学农学与生物科技学院,重庆 400716;2筑波大学大学院生命环境科学研究科基因研究中心,日本 筑波 305-8572)
蔗糖是植物体内碳水化合物长距离转运的主要(甚至唯一)形式,其在成熟叶片中合成后,进一步转运到多种异养组织中,是影响整个植物生产能力和作物产量的重要因素(戚继艳 等,2007)。蔗糖转运蛋白(sucrose transporter,SUT)负责蔗糖的跨膜运输,在韧皮部介导的源—库蔗糖运输以及库组织的蔗糖供给中起关键作用(Kammerer et al.,1998;Nguyen-Quoc & Foyer,2001;Fridman et al.,2004)。根据近几十年的研究发现,蔗糖转运蛋白是一个多成员的基因家族,根据蔗糖转运蛋白的不同特性,分别归类为SUT1、SUT2/SUC3和SUT43个亚族,SUT1是高亲和质子共转运蛋白载体,与韧皮部蔗糖的装载/卸载、库细胞的分化和发育有关(杨彩菊 等,2006)。
实时荧光定量PCR(qRT-PCR)的相对定量方法能直观地得到处理及未处理样品间表达量差异倍数。与早期定量PCR方法即扩增产物在跑胶后通过染料、放射活性或探针定量检测、手工收集数据等繁琐工序相比,增强了常规定量分析(魏敏 等,2006)。
研究表明,品种和栽培措施〔摘叶程度、摘叶方法、栽培密度、营养液电导率(EC)值〕影响番茄(Lycopersicon esculentum Mill.)的碳水化合物的转运、积累,进而影响番茄的产量(渡部申也,2010);在番茄绿果中主要是SUT1的表达影响到番茄果实的发育(Hackel et al.,2006)。本试验通过SYBR Green染料实时PCR,以Ubqutin基因为内标,采用相对定量方法,数字化表示在不同栽培措施下不同品种的番茄绿果和叶片中SUT1基因的表达差异,研究不同栽培措施诱导SUT1基因在不同品种间表达的差异性,探索不同栽培措施下不同品种产量差异的原因,同时为阐明番茄蔗糖供给与调控的分子机理奠定基础。
1 材料与方法
1.1 供试材料与试验设计
试验在日本筑波大学农林生物中心的G5温室中栽培,试验布置如图1。采用营养液膜技术,连续流动供液,营养液配方为大塚〔大量元素(mg·L-1)∶NO3-N 16.6、P 5.1、NH4-N 1.6、K 8.6、Ca 8.2、Mg 3.0,微量元素(mg·L-1):MnCl2·4H2O 1.81、HBO32.86、ZnSO4·7H2O 0.22、CuSO4·5H2O 0.08、Na2MoO4·2H2O 0.025〕。选用两个番茄品种,分别为麗容(来自于日本)、莱邦索(来自于荷兰)。摘叶程度为1/2摘叶、1/3摘叶;摘叶方法为均一摘叶、从下至上的下位摘叶(图2);营养液EC值为1.8 dS·m-1和3.0 dS·m-1;栽植密度设两个,高密度(H)为60000株·hm-2,株距为11 cm,低密度(L)为20000株·hm-2,株距为33 cm。番茄种子经浸泡催芽后播在营养钵中,50 d的苗龄定植于栽培槽中,槽宽20 cm,槽间距80 cm。
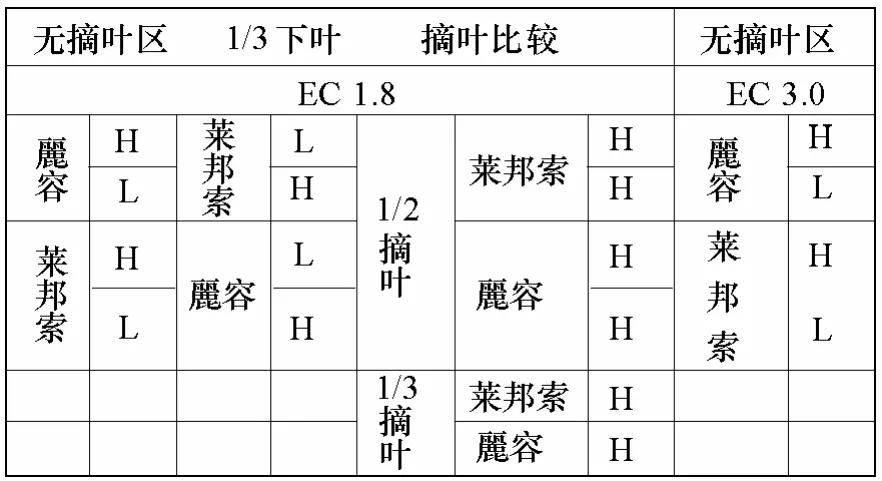
图1 试验田间种植图

图2 摘叶处理示意图
分两茬栽培分析,第一茬为早熟栽培(2009年3~8月)、第二茬为促成栽培(2009年8月~2010年2月),试验数据来自于促成栽培。每处理区栽种9株,在中间7株中随机选取4株取样。于第2穗果直径2~4 cm时取直径3 cm左右的果实、果柄及第2穗果下叶片的顶部小叶,液氮速冻,-80 ℃保存。在果实变红时分期分批收获称质量。
1.2 RNA提取、cDNA合成及qRT-PCR
总RNA的提取采用RNeasy plant Mini kit(QIAGEN,Valencia,CA,USA),提取方法参照试剂盒说明书。提取的总RNA溶解在RNase free-water中,贮藏在-80 ℃用于cDNA的合成。cDNA的合成采用First Strand cDNA Synthesis kit(TAKARA BIO Inc.,Otsu Japan),合成方法参照试剂盒使用说明。
qRT-PCR 的引物按照 Amplify ver.3.1.4(B.Engels,University of Wisconsin,USA;http://engels.genetics wisc.edu/amplify)设计,SUT1的引物为 Re primer:TAC AGT TTC GCA TCA CCG AC;Fw Primer:AAC TCC CGG AGA AAG AAG AG。内标基因为 Ubquitin,其引物为 Fw primer:CCC TGG CTG ATT ACA ACA TC;Re primer:TGG TGT CAG TGG GTT CAA TG。反应条件为95 ℃预变性10 min,1个循环;95 ℃ 30 s、50 ℃ 30 s、72 ℃ 30 s,40个循环;95 ℃ 30 s、55 ℃ 30 s、72 ℃30 s,1个循环;反应仪器为Mx3000p qRT-PCR system(Stratagene,San Diego,CA,USA)。
采用Takara公司的SYBR Premix Ex TaqTM(Perfect Real Time)试剂盒,10 μL反应体系中包含 SYBR ROX 0.3 μL,Master Mix 5 μL,Fw Primer 1 μL,Re primer 1 μL,cDNA 2.7 μL。每个样品做3次平行反应。基因表达差异的分析方法采用Pfaffl(2001)的方法。

试验数据统计分析采用SPSS13.0软件。
2 结果与分析
2.1 不同处理番茄产量
由图 3、4可看出,番茄的单株产量不论是麗容还是莱邦索都表现出低密度栽培高于高密度栽培,而单位面积的产量表现出低密度栽培低于高密度栽培;在同一栽培措施下不论是单株产量还是单位面积产量都表现出麗容低于莱邦索。

图3 不同处理下番茄单株产量
2.2 不同器官的SUT1基因表达情况
按照SUT1相对表达量的公式计算,以无摘叶低密度栽培的麗容叶片中SUT1基因表达量为参照因子,设为1,得到不同栽培措施不同品种的SUT1基因表达量(图5)。由图5可看出,果实中的SUT1表达量低于果柄和叶片。在不同处理下,叶片中SUT1的表达量与单株产量呈正相关,相关系数达0.983。

图4 不同处理下番茄单位面积产量
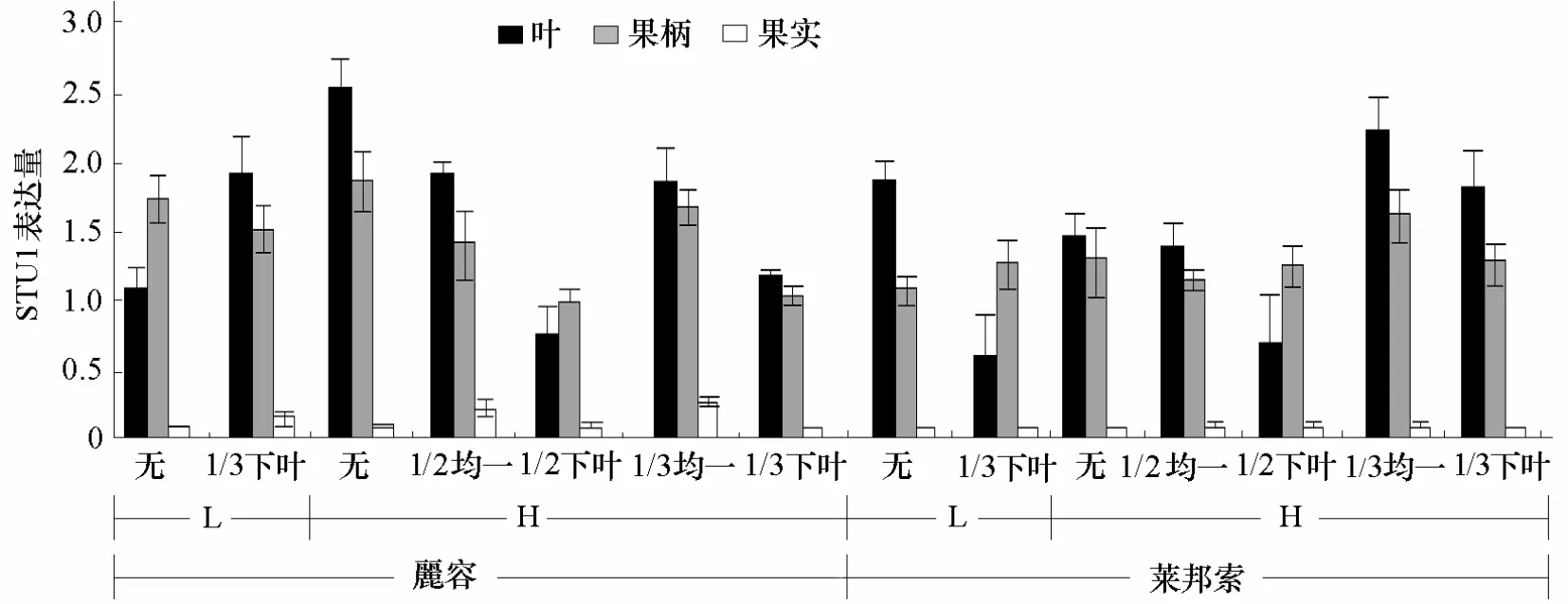
图5 不同栽培措施不同品种的SUT1基因表达量
2.3 营养液EC值、品种和栽培密度对SUT1在不同器官中表达量的影响
由表1可看出,在叶片中,EC值为1.8 dS·m-1时,麗容在高密度栽培下SUT1的表达量最高,莱邦索在低密度栽培下SUT1的表达量次之,而在EC值为3.0 dS·m-1时,麗容在高密度栽培下SUT1的表达量最低,表明麗容叶片转运蔗糖的能力低,而且已适应了长期高密度的栽培条件。麗容对EC值的适应能力较莱邦索低,高浓度的EC值使麗容的SUT1表达量大大下降,对蔗糖的转运能力下降。
果柄中,在高密度栽培下EC值为1.8 dS·m-1时麗容的SUT1的表达量最高,低密度栽培下EC值为3.0 dS·m-1时次之,但差异不显著(表1)。果柄虽也是光合器官,但不是光合主要器官,因此虽然SUT1的表达量高,但运输的蔗糖总量不大,对果实的蔗糖贡献很有限。

表1 营养液EC值、品种和栽培密度对SUT1在不同器官中表达量的影响
果实中,EC值为1.8 dS·m-1时麗容高密度栽培SUT1的表达量最高,EC值为3.0 dS·m-1时麗容高密度栽培SUT1的表达量次之,而莱邦索不管是在何种EC值和栽培密度下SUT1的表达量都较低(表1)。表明麗容由叶片转运到果实中的蔗糖可能还被转运到种子或其他幼嫩器官中,如花芽、生长点等(Smeekens,2000),而莱邦索由叶片转运到果实中的蔗糖易于贮藏(莱邦索叶片中SUT1表达量较高,表明叶片合成的蔗糖易于向贮藏器官转运,而果实中SUT1表达量较低,表明蔗糖不易向其他器官转运而贮藏下来),这可能是莱邦索较麗容产量高的一个重要原因。
2.4 摘叶、品种、栽培密度对SUT1表达量的影响
表2表明,在麗容叶片中,无摘叶、高密度栽培下SUT1表达量最高,1/3摘叶和低密度栽培下SUT1表达量次之,但与莱邦索1/3摘叶、高密度下SUT1表达量无显著差异,而莱邦索1/3摘叶低密度栽培下 SUT1表达量最低;果柄的变化与叶片差异不大;而果实中表现出麗容的 SUT1表达量均大于莱邦索,这表明麗容由叶片和果柄转运到果实中的蔗糖可能还被转运到种子或其他的幼嫩器官,而莱邦索由叶片转运到果实中的蔗糖易于贮藏。
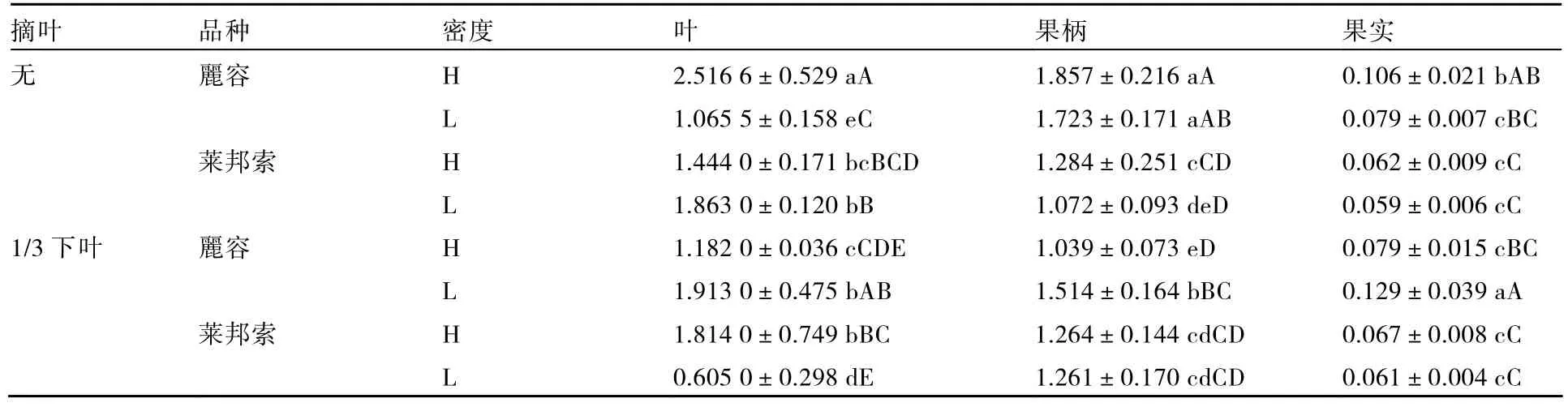
表2 摘叶、品种、栽培密度对SUT1表达量的影响
2.5 不同摘叶方式对番茄SUT1表达量的影响
表3表明,摘叶程度、摘叶方法对不同品种番茄SUT1表达量的影响不论是在叶片、果柄还是果实中都呈极显著差异。叶片中,莱邦索1/3均一摘叶的SUT1表达量最大,麗容1/3均一摘叶的次之,莱邦索1/2下叶摘叶的最小;果柄中均一摘叶的SUT1表达量大多高于下叶摘叶,而果实中除1/2下叶摘叶外,其余表现出麗容的SUT1的表达量高于莱邦索,1/2摘叶大多高于1/3摘叶。说明1/3摘叶比1/2摘叶更有利于蔗糖在产品器官的累积。

表3 摘叶程度、摘叶方法对不同品种番茄SUT1表达量的影响
2.6 单因素对SUT1表达量的影响
通过进一步分析,得到单因素对SUT1表达量的影响(图6)。由图6可以看出,不管是在番茄的叶、果实还是果柄中,营养液中的EC值1.8 dS·m-1时SUT1的表达量都高于EC值3.0 dS·m-1;高密度栽培的SUT1表达量大于低密度栽培;均一摘叶大于下叶摘叶;而1/3摘叶与1/2摘叶之间在叶片中差异达极显著水平,在果柄和果实中差异不显著。麗容的SUT1表达量在果实和果柄中都大于莱邦索,而在叶片中表达量小于莱邦索。表明番茄开花坐果期促进蔗糖转运的适宜营养液EC值不能太高,否则产生盐害,抑制蔗糖的运转。而品种的特性也是影响蔗糖运转的重要因素,叶片中莱邦索的SUT1表达量高,表明莱邦索的叶片制造的蔗糖向果实运转的速率高,而果实和果柄中SUT1的表达量低,表明果实和果柄中合成和贮藏的蔗糖不易于向其他器官运输,便于贮存,致使莱邦索的果实产量大于麗容。此外在适当高的栽培密度下,蔗糖的运转速率会更高。

图6 单因素对番茄叶片、果柄、果实SUT1表达量的影响
3 结论与讨论
本试验选择番茄的叶、果实和果柄采用 qRT-PCR技术分析可知,不论是叶片、果柄还是果实,品种、摘叶方式、摘叶量、营养液的EC值都影响到番茄SUT1基因的表达,无摘叶>1/3摘叶>1/2摘叶、均一摘叶﹥下叶摘叶、营养液EC值1.8 dS·m-1时﹥EC值3.0 dS·m-1时;而品种对SUT1表达量的影响比较复杂,叶片中莱邦索﹥麗容,而果柄和果实中反之。叶片中SUT1的表达量与番茄的单株产量成呈正相关,相关系数达0.983。
植物SUT1基因在植物光合产物(蔗糖)的转运与分配上起关键作用。SUT1是叶片中的主要蔗糖转运蛋白,一般在叶(源)中高度表达,参与蔗糖往韧皮部装载及在植株体内的长距离运输活动(Chincinska et al.,2008)。本试验结果表明,叶片和果柄中SUT1的表达量远远高于果实,蔗糖向果实的装载增强,促进蔗糖从源(叶和果柄)向果实转运。这与前人的结论相同。
SUT1对底物蔗糖的高亲和性特点还表明,它对胞内外蔗糖浓度的变化非常敏感,可受蔗糖、昼夜节律、盐渍、植物生长物质、光和 ATP等调控。Matsukura等(2000)研究发现,光照可以增强蔗糖对水稻 OsSUT1的诱导表达作用。本试验进行了早熟栽培和促成栽培番茄 SUT1表达量的研究,所得结果有些差异,其主要原因可能也是由于光照强度、光周期的影响。光照对番茄SUT1表达量的影响还有待于进一步深入研究。
渡部申也.2010.栽培密度和摘叶处理对番茄同化产物分配的影响〔硕士论文〕.筑波:筑波大学.
戚继艳,阳江华,唐朝荣.2007.植物蔗糖转运蛋白的基因与功能.植物学通报,24(4):532-543.
魏敏,熊建华,李阳生,傅彬英.2006.实时PCR定量分析干旱胁迫下水稻糖原合成酶激酶基因表达差异.中国水稻科学,20(6):567-571.
杨彩菊,郝大海,杨素祥,王芳,李灿辉,陈善娜.2006.高等植物中的蔗糖载体.植物生理学通讯,42(4):767-776.
Hackel A,Schauer N,Carrari F,Fernie A R, Grimm B, Kühn C.2006.Sucrose transporter LeSUT1 and LeSUT2 inhibition affects tomato fruit development in different ways.The Plant Journal,45:180-192.
Chincinska A,Liesche J,Krü gel U,Michalska J,Geigenberger P,Grimm B,Kü hn C.2008.Sucrose transporter StSUT4 from potato affects flowering,tuberization,and shade avoidance response.Plant Physiology,146:515-518.
Fridman E,Carrari F,Liu Y S,Fernie A R,Zamir D.2004.Zooming in on a quantitative trait for tomato yield using interspecific introgressions.Science,305:1786-1789.
Kammerer B,Fischer K,Hilpert B,Schubert S,Gutensohn M,Weber A,Flugge U.1998.Molecular characterization of a carbon transporter in plastids from heterotrophic tissues:the glucose 6-phosphate/phosphate antiporter.Plant Cell,10:105-118.
Matsukura C A,Saitoh T,Hirose T,Ohsugi R,Pereta P,Yamaguchi J.2000.Sugar uptake and transport in rice embry.Expression of companion cell-specific sucrose transporter(OsSUT1)induced by sugar and light.Plant Physiol,124:85-93.
Nguyen-Quoc B,Foyer CH.2001.A role for‘futile cycles’involving invertase and sucrose synthase in sucrose metabolism of tomato fruit.J Exp Bot,52:881-889.
Pfaffl M W.2001.A new mathematical model for relative quantification in real-time RT-PCR.Nucleic Acids Research,29(9):45.
Smeekens S.2000.Sugar-induced signal transduction in plants.Annu Rev Plant Physiol Plant Mol Biol,51:49-81.
