杨树菇培养料中农药消解动态分析
2011-05-21王生荣王秉峰赵玉卉高静梅
王 龙 张 铎 王生荣 王秉峰 赵玉卉 高静梅 秦 鹏
(1甘肃省科学院生物研究所,甘肃 兰州 730000;2甘肃农业大学草业学院,甘肃 兰州 730070)
杨树菇(Agrocybe aegerita),别名茶薪菇,是近年来我国开发利用的一种珍稀食药用蕈菌(章道忠和毕志树,1991)。培养料是杨树菇生长的重要基质载体,若是培养料受到农药污染,这些污染物就会通过杨树菇子实体的吸附而残存于子实体中,子实体作为可食用的部分,它的品质直接影响到人们的身体健康(黄年来,1993;杨月明和李美良,2003)。因此,杨树菇中农药残留限量(MRL)超标问题日益受到国内外的重视。我国现有的食用蕈菌国家标准中,仅对六六六、滴滴涕作出了要求,最高残留限量均为0.1mg·kg-1。而通常也仅限于环境中(水、土壤等)农药残留的调查研究,而对于食用蕈菌子实体及培养料中农药消解动态分析研究报道较少(门殿英 等,2004)。同时针对杨树菇中农药残留的研究也尚未见报道。所以,建立杨树菇培养料农药残留的检测方法,进行培养料农药消解动态的研究,为保障杨树菇的食品安全提供科学依据是非常必要的。
1 材料与方法
1.1 仪器与试剂
Agitent6890N气相色谱仪(美国Agilent公司),配63Ni-ECD检测器;组织捣碎机DS-1型(上海标本模型厂);旋转真空蒸发仪 ZFQ-3型(上海亚荣生化仪器厂);超声波清洗器KQ-250D型(北京天鹏有限公司);恒温水浴振荡器SHZ-88型;旋涡混合器WH-851;层析柱等各种玻璃器皿。
丙酮、正己烷、乙腈、氯化钠、活性碳均为分析纯;硅胶(农残级,使用前130 ℃活化2h,用5 %的蒸馏水降活使用);中性氧化铝(农残级,550 ℃灼烧4h,后130 ℃下烘3 h,3%蒸馏水降活使用);弗罗里硅土(农残级,130 ℃活化3 h,用2 %蒸馏水降活使用);六六六(α-BHC、β-BHC、γ-BHC、δ-BHC)、滴滴涕(o,p' -DDT、p,p' -DDT、p,p' -DDD、p,p' -DDE)、溴氰菊酯、氯氰菊酯、毒死蜱标准样品纯度均高于99 %(标准品由国家标物中心提供)。
1.2 杨树菇培养料配方
杨树菇栽培种培养料(质量比):棉籽壳38.0 %,木屑30.0 %,麦麸18.0 %,玉米粉8.0 %,豆饼3.0 %,茶叶0.5 %,石膏粉1.0 %,红糖0.5 %,磷酸氢二钾0.5 %,磷酸二铵0.5 %,水60.0%~65.0 %(路等学 等,2005)。
1.3 试验设计
设5种药剂和空白处理(CK),每种药剂混拌杨树菇培养料12kg,分装入4个包装袋,用药剂量(g·kg-1):六六六0.3、滴滴涕0.3、毒死蜱1.0、溴氰菊酯3.0、氯氰菊酯3.0。
1.4 样品处理
1.4.1 样品采集 分别于施药后0、2、4、6、10、14、20、25、30、40d,随机采样,采用四分法最终采集杨树菇培养料1000.0 g,空白处理采集空白样品,均置于-20 ℃冰箱贮存待测。
1.4.2 样品提取 准确称取3.0 g(DW)培养料置于三角瓶中,分别加入30mL蒸馏水和30mL乙腈,手动摇匀后立即放入恒温水浴振荡器中,在水浴温度为30 ℃和转速160 r·min-1下,振荡提取2h。将提取液经漏斗过滤于装有7.0~10.0 g氯化钠的100mL具塞量筒中,残渣用5mL等体积乙腈/蒸馏水冲洗3次,收集所有滤液。在室温下静置分层,吸取一定体积提取液于250mL的圆底烧瓶中,用旋转蒸发仪在40 ℃水浴下减压浓缩至近干,待柱净化(邵俊杰,1998)。
1.4.3 样品净化 玻璃层析柱中由上到下依次装入5.0 g无水硫酸钠、2.5g弗罗里硅土、1.0 g助滤剂545、2.0 g无水硫酸钠和玻璃棉。先用10mL正己烷预淋洗层析柱,弃掉洗脱液。然后用正己烷∶丙酮=8.5 V∶1.5 V的混合洗脱液分别以10、20、20mL分3次洗圆底烧瓶,将洗液全部转移到玻璃层析柱上,再用70mL混合洗脱液淋洗,收集全部洗脱液。
在35 ℃水浴下减压旋转近干。用正己烷∶丙酮=7 V∶3 V混合溶液将圆底烧瓶中的残留农药转移,用正己烷定容1mL,气相色谱测定(申继忠,1998)。
1.5 色谱条件
Agitent6890NGC,μ-ECD检测器;HP-5毛细管柱30m×0.32mm×0.25 μm;高纯氮气(纯度>99.999 %)为载气,柱流速1.5mL·min-1;进样口温度为250 ℃;检测器温度为280 ℃;柱前压为72 psi,尾吹60mL·min-1;柱升温程序为初始柱温80 ℃,恒温3min后,以10 ℃·min-1的速率升温至160 ℃,恒温5min后,以4 ℃·min-1的速率升温至250 ℃,恒温1min后,再以4 ℃·min-1的速率升温至270 ℃,恒温15min。采用不分流进样方式,进样量为 1.0μL(Beltran et al.,2003;Papadakis et al.,2006)。
1.6 标准工作储备液的配制
配制0.2mg·L-1的六六六、滴滴涕的各4种异构体8种农药混合标准品储备液,100mg·L-1毒死蜱、溴氰菊酯和氯氰菊酯3种农药混合标准品储备液。经正己烷溶液稀释成相应的标准工作溶液。
2 结果与分析
2.1 净化条件的选择
试验分别对硅胶层析柱、中性氧化铝层析柱和弗罗里硅土层析柱净化效果进行了比较。用正己烷∶丙酮=15 V∶85 V混合淋洗液淋洗,测定各农药的添加回收率。硅胶层析柱净化效果不理想,氯氰菊酯、o,p' –DDT、p,p' -DDT处有较多的干扰杂质,而且毒死蜱的回收率偏低;中性氧化铝层析柱净化农药时,毒死蜱、p,p' -DDT、o,p' -DDT均有少量杂质干扰;采用弗罗里硅土层析柱净化时,各种农药的回收率均在 80 %以上,且分离效果较好(图 1)。综上,最终确定净化条件为弗罗里硅土层析柱净化。

图1 5种农药气相色谱图
农药保留时间:α-BHC,13.221min;β-BHC,14.409min;γ-BHC,14.495min;δ-BHC,15.790min;p,p' –DDE,25.221min;p,p' –DDD,25.561min;o,p' –DDT,27.176min;p,p' –DDT,28.810min;毒死蜱,20.785min;氯氰菊酯,37.848min;溴氰菊酯,41.934min。
2.2 线性关系
将六六六、滴滴涕的4种异构体标准溶液和毒死蜱、溴氰菊酯、氯氰菊酯的混合标准溶液经正己烷溶液稀释配制成1.0、0.5、0.1、0.05、0.025、0.01mg·kg-1浓度的混合标准溶液。按照上述色谱条件测定,得到色谱图及相应农药的回归方程。结果表明α-BHC、β-BHC、γ-BHC、δ-BHC、p,p' -DDE、p,p' -DDD、o,p' -DDT、p,p'-DDT 、毒死蜱、溴氰菊酯和氯氰菊酯在0.01~1mg·kg-1范围内线性良好,相关系数≥0.9954,可以满足定量分析的需要(表1、2)。
2.3 最小检出量和最低检出浓度测定
在所设定的仪器条件下,各种农药的最小进样量峰高为噪声3倍时,为最小检出量。培养料样品称取3.0 g(DW),经提取、净化、定容1.0mL,气相色谱测定,进样量1μL,计算样品的最小检出量和最低检出浓度:Cmin=(M×V1)/V2×m。Cmin,样品最低检出浓度,单位 mg·kg-1;M,农药的最小检出量,单位 g;V1,样品定容体积,单位 mL;V2:样品溶液进样体积,单位μL;m:样品质量,单位g(吴文君 等,2008)。

表1 混合农药的进样浓度与峰面积(uv.s)

表2 农药回归方程和相关系数
由表3可知,检测出5种农药最小检出量为2.8×10-10~1.6×10-8g,最小检出浓度为0.00015~0.05300mg·kg-1。
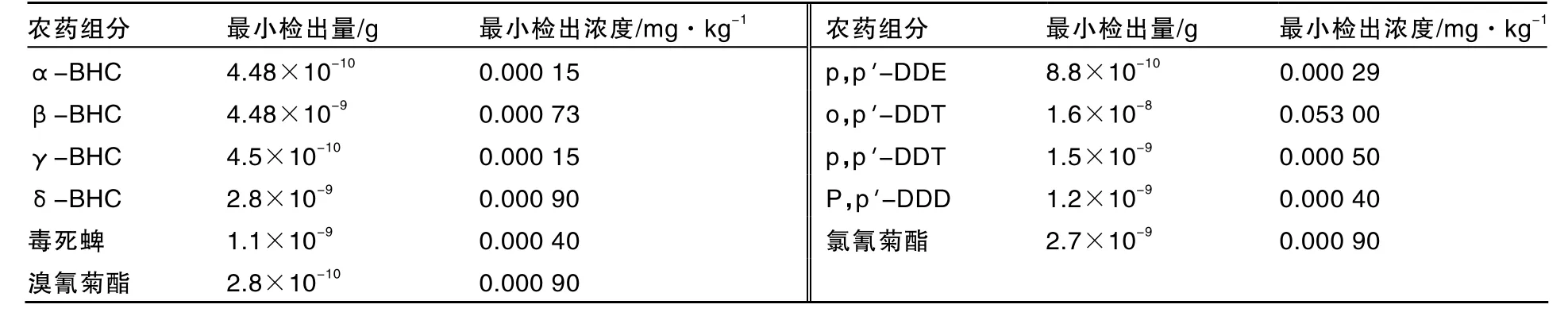
表3 培养料中农药的最小检出量和检出浓度
2.4 培养料中5种农药消解动态测定
利用已建立的农药多残留检测方法分别对杨树菇培养料中农药的消解动态进行检测分析,得出农药的消解动力方程和半衰期。六六六、滴滴涕、毒死蜱、溴氰菊酯、氯氰菊酯5种农药在杨树菇培养料中的半衰期分别为33.02、53.14、18.21、18.16、9.40d。分析检测结果和消解动态方程见表4,消解动态曲线见图2。
农药降解模式可用一级反应动力方程式:C=C0e-KT。C为农药在 t时刻的残留量,单位mg·kg-1;C0为农药的初始浓度,单位 mg·kg-1;K为降解速率常数;T为降解时间,单位d。农药残留量计算公式:R=(Q×V终)/(V样×W)。Q为从标准样曲线上查得的相应农药量(ng),V终为样品溶液最终定容体积(mL),V样为进样体积(μL),W为称样量(g)(赵善欢,1998;吴文君和罗万春,2008)。

图2 杨树菇培养料中农药消解动态曲线

表4 药剂处理后杨树菇培养料中农药消解动态
3 结论
本试验利用气相色谱法,针对杨树菇培养料中六六六、滴滴涕、毒死蜱、氯氰菊酯、溴氰菊酯5种农药的残留及其消解动态进行了检测分析。检测出5种农药最小检出量为2.8×10-10~1.6×10-8g,最小检出浓度为0.00015~0.05300mg·kg-1,相关系数≥0.9954;5种农药在杨树菇培养料中的半衰期分别为:33.02、53.14、18.21、18.16、9.40d。该方法的灵敏度、精确度和准确度均符合农药残留分析方法的要求(农业部农药检定所,1995;武汉大学,2000),对于我国食用菌中农药残留的检测具有一定的使用价值。此外,本测试分析只是对杨树菇培养料中的 5种农药残留检测方法进行了研究,这些检测方法是否可以运用到其他食用菌培养料农药残留检测上还有待于进一步试验。
黄年来.1993.中国食用菌百科.北京:中国农业出版社.
路等学,王秉峰,高静梅,邵建宁.2005.茶薪菇栽培技术研究.食用菌学报,12(1):42-45.
门殿英,谭琦,王南.2004.我国食用菌出口遭遇贸易壁垒的原因、类型及对策.食用菌学报,11(4):51-56.
邵俊杰.1998.农药残留量分析中的前处理技术.食品理化检验,(2):11-17.
申继忠.1998.农药残留分析样品前处理新技术简介.农药科学与管理,(4):8-10.
农业部农药检定所.1995.农药残留量实用检测方法手册.北京:中国农业科技出版社.
武汉大学.2000.分析化学.北京:高等教育出版社.
吴文君,罗万春.2008.农药学.北京:中国农业出版社.
杨月明,李美良.2003.杨树菇栽培技术.北京:金盾出版社.
章道忠,毕志树.1991.中国食用菌志.北京:中国林业出版社.
赵善欢.1998.植物化学保护.北京:中国农业出版社.
Beltran J,Peruga A,Pitarch E,L ó pez J,Hern á ndez F.2003.Application of solid-phase mieroextraetion for the determination of pyrethroid residues in vegetable samples by GC-MS.Anal Bioanal Chem,376:502-511.
Papadakis E N,Vryzas Z,Papadopoulou-Mourkidou E.2006.Rapid method for the determination of 16 organoehlorine pesticides in sesame seeds by microwave-assisted extraction and analysis of extracts by gas chromatography- mass spectrometry.Journal
