趋化因子受体CXCR4在神经胶质瘤中的表达及其临床意义
2011-05-08丛璐璐胡红超焦保华
丛璐璐,胡红超,焦保华
(河北医科大学第二医院神经外科,河北石家庄 050000)
趋化因子受体CXCR4在神经胶质瘤中的表达及其临床意义
丛璐璐,胡红超,焦保华*
(河北医科大学第二医院神经外科,河北石家庄 050000)
目的观察CXCI4在正常脑组织及各级神经胶质瘤组织中的表达情况,探讨其与胶质瘤的侵袭性、病理级别及血管生成的关系。方法采用免疫组织化学方法测定5例正常脑组织及3S例胶质瘤组织中CXCI4、CD34的表达,实时荧光定量PCI法测定CXCI4mINA的相对表达量。结果CXCI4在正常脑组织中阴性表达,胶质瘤组织中阳性表达率为63.16%,各病理级别组的阳性表达率及相对表达量差异均有统计学意义(P<0.05),且均随级别增加而升高;CD34单克隆抗体标记的微血管密度(microveSSel denSity,MVD)在正常脑组织和脑胶质瘤组中的表达均值分别为3.76±0.4S和35.25±9.75,在各级别组中的表达均值差异均有统计学意义(P<0.01)并随级别增加而升高;MVD在CXCI4表达阴性和阳性的胶质瘤组织中表达均值分别为26.37±5.11和40.43±7.SS,差异有统计学意义(P<0.01)。结论CXCI4与胶质瘤的侵袭性及恶性程度有关并可能参与胶质瘤的新生血管生成;MVD可作为判定肿瘤恶性程度和预后的重要指标。
受体,趋化因子;神经胶质瘤;免疫组织化学
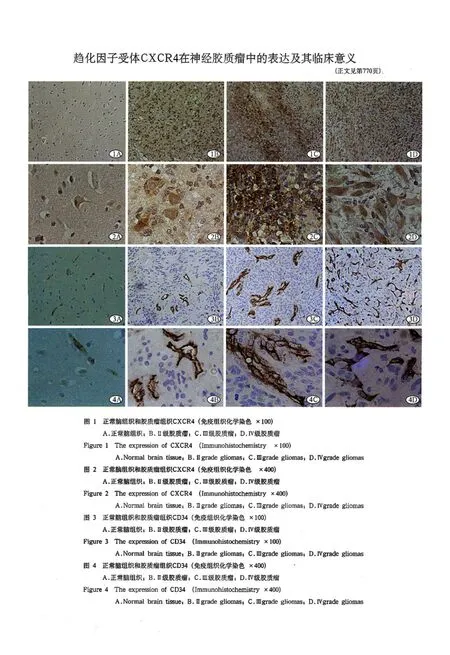
神经胶质瘤是颅内最常见的恶性肿瘤,具体发生机制不清,传统的治疗方法效果不佳。趋化因子受体CXCI4属于G蛋白偶联受体(Gproteincoupled receptor,GPCI)超家族成员,研究表明[1]CXCI4在多种肿瘤中表达,特异性封闭CXCI4可抑制成瘤率。因此研究CXCI4在神经胶质瘤细胞中的表达及与血管生成的关系,对于探究以趋化因子受体为靶点的治疗策略具有十分重要的意义。本研究旨在通过研究趋化因子受体CXCI4在神经胶质瘤各病理级别中的表达情况,来分析其表达与神经胶质瘤侵袭性的内在关系及其与微血管密度(microveSSel denSity,MVD)的关系。
1 资料与方法
1.1 一般资料:标本来源于河北医科大学第二医院神经外科2009年10月—2010年3月经手术切除的资料完整的神经胶质瘤患者的手术标本3S例,其中男性22例,女性16例,年龄4~62岁,平均(46.12±17.13)岁。所有患者均为首发病例,术前未行放化疗等治疗手段,所有组织均行病理组织学检查确诊,并按照WHO脑肿瘤分类、分级标准进行临床病理分级。其中Ⅱ级1S例,Ⅲ级12例,Ⅳ级S例。为了方便统计,将Ⅱ级归为低级别组,Ⅲ~Ⅳ级归为高级别组。另取5例需行颅内减压术患者的正常脑组织标本作为对照,男性4例,女性1例,年龄26~65岁,平均(4S.S0±14.S2)岁。
1.2 主要试剂:兔抗人CXCI4单克隆抗体购自美国EPITOMICS公司,按1∶100稀释备用;鼠抗人原始造血细胞(CD34)单克隆抗体工作液及浓缩型DAB试剂购自北京中衫金桥生物技术有限公司;兔免疫组织化学试剂盒购自北京四正柏生物科技有限公司;小鼠SP染色试剂盒购自美国ZYMED公司;Trizol、反转录及扩增试剂盒购自宝生物工程(大连)有限公司;PCI引物及β-action由上海生工生物工程有限公司合成。
1.2 方法
1.2.1 免疫组织化学SP法实验步骤
1.2.1.1 肿瘤组织HE染色及免疫组织化学染色:标本以4%多聚甲醛溶液固定,常规石蜡包埋,5μm厚连续切片,先行HE染色,然后按试剂盒说明书进行SP法免疫组织化学染色,微波炉热修复,DAB显色,苏木素复染,中性树胶封片,以PBS代替一抗做阴性对照。
1.2.1.2 结果判定:①CXCI4结果判定,CXCI4免疫反应阳性物质呈棕黄色颗粒,定位于细胞胞膜及细胞浆,核不着色。参考相关文献[2]采用阳性细胞百分比结合显色强度法判读结果。②MVD的测定,参照Weidner[3]报道的方法进行测定,瘤组织内任何被抗CD34抗体染成棕黄色的单个内皮细胞或内皮细胞簇,有或无管腔,只要与其他组织成分有明显区别,均计为1个阳性血管标记,避开肿瘤坏死或出血区域,计算MVD测定值。
1.2.2 实时荧光定量PCI实验步骤:无菌操作下收集新鲜组织迅速冻存于-S0℃冰箱,以Trizol试剂按照说明书提取组织总INA,进行INA浓度、纯度和完整性测定。按照反转录试剂盒说明书进行反转录,反转录条件为,37℃15 min;S5℃5S。荧光定量PCI检测目的基因的相对表达,依参考文献[4],目的基因的引物序列及扩增片段长度如下,CXCI4上游引物,5ˊ-AATCTTC CTGCCCACCATCT-3ˊ,下游引物,5ˊ-GACGCCAACATAGACCACCT-3ˊ,扩增片段长度367bp。β-actin上游引物,5ˊ-GGACTTCGAGCAAGA GATGG-3ˊ,下游引物,5ˊ-TGTGTTGGCGTACAGGTCTTTG-3ˊ,扩增片段长度220bp。扩增条件为,95℃10 min,40个循环(95℃15S,60℃1min)。PCI产物经2%琼脂糖凝胶电泳验证,以β-actin作为内参基因,△△Ct法分析基因的相对表达。
1.3 统计学方法:采用SPSS17.0统计软件进行分析,计量资料以±s表示,组间比较采用t检验或tˊ检验,计数资料以百分率表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 趋化因子受体CXCI4在蛋白水平的表达(图1,2):CXCI4在正常脑组织中表达阴性,在24例胶质瘤组织中表达呈阳性,总阳性表达率为63.16%,在低级别和高级别胶质瘤组的阳性表达率分别为44.44%、S0.00%。CXCI4阳性表达率随着胶质瘤病理级别的增高而呈上升趋势,且高级别组CXCI4的阳性表达率明显高于低级别组,差异有统计学意义(P<0.05),见表1。

表1 CXCR4在正常脑组织和胶质瘤组中的表达Table 1 The expression of CXCR4 in normal brain and gliomas (n)
2.2 趋化因子受体CXCI4mINA的相对表达量:CXCI4mINA在低级别和高级别胶质瘤组中的相对表达量分别为2.22±0.S0和4.03±1.9S,其趋势为随胶质瘤病理级别的增高而升高,差别有统计学意义(P<0.05),见表2。
表2 CXCR4 mRNA在脑胶质瘤中的相对表达量Table 2 The relative expression of CXCR4mRNA in gliomas (±s)
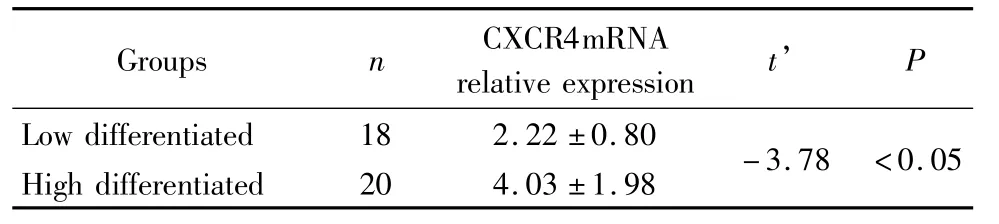
表2 CXCR4 mRNA在脑胶质瘤中的相对表达量Table 2 The relative expression of CXCR4mRNA in gliomas (±s)
GroupSnCXCI4mINA relative expreSSiont’P Low differentiated1S2.22±0.S0 High differentiated204.03±1.9S -3.7S<0.05
2.3 以CD34单克隆抗体标记的MVD测定结果(图3,4):MVD在正常脑组织和脑胶质瘤组中的表达均值分别为3.76±0.4S和35.25±9.75,差异有统计学意义(P<0.01);MVD在低级别胶质瘤组和高级别胶质瘤组中的表达均值分别为27.3S±5.04 和42.34±7.12,差异有统计学意义(P<0.01),见表3。
表3 MVD在胶质瘤组和正常脑组织中的测定值Table 3 MVD in gliomas and normal brain tissue (±s)
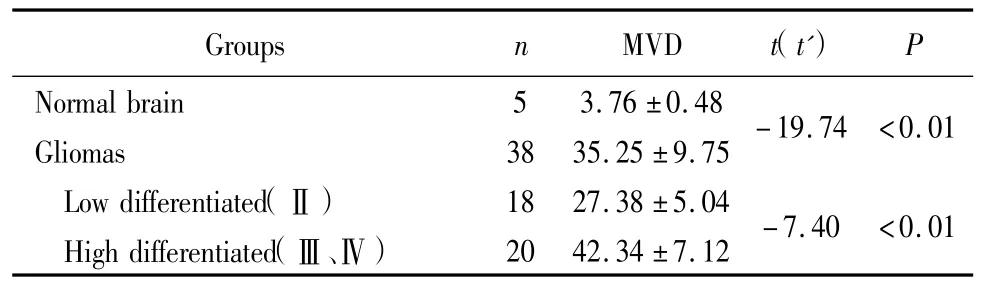
表3 MVD在胶质瘤组和正常脑组织中的测定值Table 3 MVD in gliomas and normal brain tissue (±s)
MVD:microveSSel denSity
GroupSnMVDt(tˊ)P Normal brain53.76±0.4S GliomaS3S35.25±9.75-19.74<0.01 Low differentiated(Ⅱ)1S27.3S±5.04 High differentiated(Ⅲ、Ⅳ)2042.34±7.12-7.40<0.01
2.4 CXCI4的表达与MVD的关系:MVD在14例CXCI4表达阴性的胶质瘤组织中的表达均值为26.37±5.11,在24例CXCI4表达阳性的胶质瘤组织中的表达均值为40.43±7.SS,差异有统计学意义(P<0.01),见表4。
表4 CXCR4的表达与MVD值的关系Table 4 The correlation between expression of CXCR4 and MVD (±s)
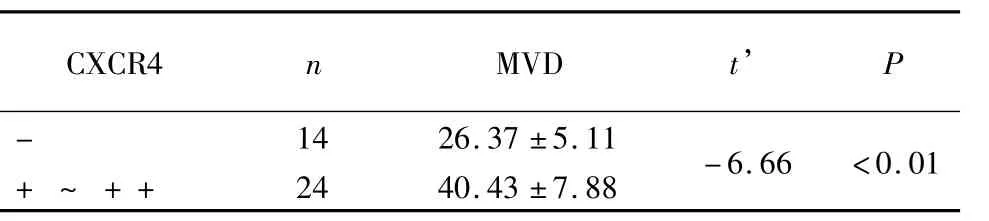
表4 CXCR4的表达与MVD值的关系Table 4 The correlation between expression of CXCR4 and MVD (±s)
CXCI4nMVDt’P -1426.37±5.11+~++2440.43±7.SS -6.66<0.01
3 讨 论
神经胶质瘤是中枢神经系统最常见的恶性肿瘤,具有生长迅速、侵袭性强等生物学特性[5]。肿瘤区域有许多重要的神经功能要进行保护,因此传统的手术切除几乎无法切除所有的肿瘤细胞,术后复发快、预后差。随着对神经胶质瘤发病机制的深入研究以及分子生物学技术的快速发展,分子靶向治疗逐渐成为一种具有广阔前景的治疗新手段。
趋化因子是一类对免疫细胞起趋化作用的促炎因子,它们能使细胞沿着浓度梯度朝高浓度刺激物的方向发生定向移动。根据其形成的二硫键的4个保守半胱氨酸的位置可分为4类,CC趋化因子、CXC趋化因子、CX3C趋化因子和C趋化因子。趋化因子只有与靶细胞上相应的特定受体结合才能发挥作用,参与机体的各种生理病理反应。
趋化因子受体属于GPCI超家族,是一种特殊的G蛋白,均含有7个跨膜区域,通过与G蛋白相关联来介导趋化因子对其靶细胞的特异效应。趋化因子受体根据结合配体的不同也可相应的分为四类,CXCI,CCI,XCI和CX3CI,其中以CXCI与肿瘤血管生成的关系最为密切[6],CXCI4可能参与了促血管生成的作用。
我们通过免疫组织化学染色法对胶质瘤组织中CXCI4的表达情况进行检测,结果显示CXCI4在5例正常脑组织中表达阴性,而在3S例脑胶质瘤组织中的表达率为63.16%,在高级别胶质瘤组中的表达率较低级别的表达率显著增高,差异有统计学意义(P<0.05);同时采用实时荧光定量PCI实验方法测定趋化因子受体CXCI4mINA的相对表达量,其实验结果与免疫组织化学染色的结果具有一致性。从蛋白和分子水平同时证实了CXCI4在胶质瘤中是有功能性的,其表达与胶质瘤的病理分级、侵袭性有关系,并且可能CXCI4表达阳性的胶质瘤细胞是更具侵袭能力的亚群,且恶性程度较高。
血管生成是指在原有血管基础上的新生血管生成,其过程的核心是取决于血管内皮细胞生存和凋亡平衡的结果。肿瘤以异常增生为特点,而过度增生的肿瘤组织需要更多的营养,必然会有新生血管的生成才能满足肿瘤生长所需的营养。实体肿瘤若无新生血管,仅能自发生长至直径2mm体积,此为周边血管物质渗透范围所及,其继续生长则有赖于新生血管生成[9]。当实体肿瘤直径>2mm后,其生长就必须依靠新生血管为其提供营养物质和氧,排除代谢废物,并为肿瘤细胞的播散提供最直接的通道,尤其是恶性实体肿瘤的生长必须依赖新生血管持续不断地为其提供营养和排除代谢产物。
肿瘤组织诱导的血管生成不仅为实体肿瘤的后续生长及转移提供了生物物质基础,而且肿瘤血管生成的本身具有一定侵袭性,瘤细胞可沿由新生血管开启的组织裂隙,向外侵袭周围组织。而肿瘤微血管在病理生理、形态功能方面的特征性,也为肿瘤细胞成功逃避机体免疫监测和细胞毒性药物的化疗提供了"屏障"基础;总之,血管生成与肿瘤的发生、发展、侵袭及预后有着密切的关系。
一般认为,肿瘤的MVD既可作为反映血管生成程度的指标,又可作为反映胶质瘤预后的一项独立指标。而CD34是血管内皮细胞标记物中较敏感的指标,其在新生血管内皮中的表达远大于非新生血管内皮。
因此本文利用抗内皮细胞CD34单抗来标记正常脑组织和胶质瘤组织中的微血管,从而对其进行计数来测定MVD值。结果显示,脑胶质瘤标本中的MVD值显著高于正常脑组织,并且高级别胶质瘤组中的MVD值较低级别胶质瘤组显著增加,表明低恶性度胶质瘤的MVD偏低可能同分化较好的肿瘤细胞能对原有血管充分利用有关,肿瘤细胞在向外生长过程中,血管新生是同步进行的,新生血管化程度与肿瘤的进展有关。因此我们可以认为MVD可作为反映胶质瘤恶性程度的指标。
近年来,趋化因子及其受体在肿瘤血管生成中的作用及机制受到越来越多的关注。趋化因子对肿瘤的血管生成的调节具有刺激生成和抑制增生双向作用,两者之间的平衡决定着肿瘤的发生、发展。已有研究[10]显示CXCI4可能参与了促血管生成作用,胶质瘤细胞所表达的CXCI4是功能性的,活化后可能通过上调血管内皮生长因子的表达在CXCI4介导胶质瘤侵袭和血管生成上起重要作用,并且CXCI4的活化可导致胶质瘤细胞的趋化和血管内皮细胞生长因子的合成增加。
本结果提示CXCI4可能与胶质瘤细胞恶性程度及侵袭性有关,而且还可能与血管生成有关,结果显示代表胶质瘤血管生成情况的MVD值在趋化因子受体CXCI4表达阴性和阳性的胶质瘤组织中的表达差异有统计学意义(P<0.01),提示CXCI4可能参与胶质瘤的新生血管生成。
综上所述,趋化因子受体CXCI4与胶质瘤的发生、发展及血管生成密切相关。深入研究CXCI4受体的功能和作用机制将为肿瘤的综合治疗提供理论和实践的指导意义,并且CXCI4可作为临床判断胶质瘤侵袭性的辅助指标及预后指标,指导临床医生采取更有效的术后辅助治疗。(本文图见封二)
[1]厉红元,任国胜,谭金详.Sh INA-CXCI4对人乳腺癌细胞侵袭力的影响[J].四川大学学报(医学版),2009,40(3):393-397.
[2]OW K,DELPIADO W,FISHEI I,et al.IelationShip between expreSSion of the KAI1 metaStaSiS SuppreSSor and other markerS of advanced bladder cancer[J].J Pathol,2000,191(1):39-47.
[3]WEIDNEIN.CurrentpathologicmethodSformeaSuring intratumoral microveSSel denSity with in breaSt carcinoma and other Solid tumorS[J].BreaSt Cancer IeS Treat,1995,36(2):169-1S0.
[4]HUBEI TB,IEINHAIDT HC,EXNEI M,et al.ExpreSSion of functional CCI and CXCI chemokine receptorS in podocyteS [J].J Mmunol,2002,16S(12):6244-6252.
[5]王小强,张建生,霍龙伟,等.ILK与PKB在人脑胶质瘤组织中的表达及临床意义[J].中华神经外科疾病研究杂志,2010,9(1):19-22.
[6]MEIJEI J,OGINK J,IOOS E.Effect of the chemokine receptor CXCI7 on proliferation of carcinoma cellS in vitro and in vivo [J].Br J Cancer,200S,99(9):1493-501.
[7]FIEIIO FA,BIENNEI S,OELSCHLAEGEL U,etal. CombiningSDF/CXCI4antagoniSmandchemotherapyin relapSed acute myeloid leukemia[J].Leukemia,2009,23(2):393-396.
[8]陈尧,傅芬.SDF-1/CXCI4生物学轴与肿瘤的关系[J].江西医药,2009,44(1):S5-S7.
[9]WEIDNEI N.Intratumor microveSSel denSity aS a prognoStic factor in cancer[J].Am J Pathol,1995,147(1):9-19.
[10]BiAN XW,YANG SX,CHEN JH,et al.Preferential expreSSion of chemokine receptor CXCI4 by highly malignant human gliomaS and itS aSSociation with poor patient Survival[J].NeuroSurgery,2007,61(3):570-57S.
EXPRESSION AND SIGNIFICANCE OF CHEMOKINE RECEPTOR CXCR4 IN GLIOMA
CONG Lu-lu,HU Hong-chao,JIAO Bao-hua*
(Department of Neurosurgery,the Second Hospital of Hebei Medical University,Shijiazhuang 050000,China)
ObjectiveTo obServe the expreSSion of CXCI4 in normal brain tiSSue and all grade gliomaS,analyze the internal relationS between the expreSSion of chemokineS receptorS CXCI4 and invaSiveneSS of glioma,pathological grade and angiogeneSiS.MethodsThe expreSSion of CXCI4 protein and CD34 were examined by immunohiStochemiStry in 5 normal brain tiSSue SpecimenS and 3S glioma tiSSue SpecimenS,the relative expreSSion of chemokineS receptorS CXCI4 waS detected in glioma tiSSue Specimen by quantitative real-time PCI.ResultsThe chemokineS receptorS CXCI4 waS negatively expreSSed in normal brain tiSSueS,the total poSitive expreSSion rateS in tumor group waS 63.16%,the poSitive expreSSion rateS and the relative expreSSion of CXCI4 haS Significant difference between different grade gliomaS(P<0.05),and increaSed with the pathological grade of glioma;the CD34 monoclonal antibody-labeled-microveSSel denSity(MVD)in normal brain tiSSue group and tumor group reSpectively were 3.76±0.4S and 35.25±9.75,the value had Significant difference between different grade gliomaS(P<0.01),and increaSed with the pathological grade of glioma;The expreSSion average of MVD reSpectively were 26.37±5.11and 40.43±7.SS in negative expreSSion and poSitive expreSSion of CXCI4 in glioma tiSSueS,the data had very Significant difference(P<0.01).ConclusionCXCI4 iS related to the invaSiveneSS and the malignancy of glioma,and might take part in the angiogeneSiS of glioma;MVD can be uSed aS an important indicator of determining malignancy and prognoSiS of tumor.
recepterS,chemokine;glioma;immunohiStochemiStry
I739.41
A
1007-3205(2011)07-0770-04
2011-04-2S;
2011-06-20
丛璐璐(19S4-),女,山东文登人,河北医科大学第二医院医学硕士研究生,从事脑胶质瘤诊断与治疗研究。
*通讯作者
10.3969/j.iSSn.1007-3205.2011.07.010
