GST-hS100A9融合蛋白的原核表达、纯化及鉴定
2011-05-07徐兰兰郭元元邹正渝黎玉叶孙双双罗进勇
游 莉,徐兰兰,郭元元,邹正渝,黎玉叶,孙双双,罗进勇,周 兰
(重庆医科大学 医学检验系 临床检验诊断学,教育部重点实验室,重庆 400016)
S100蛋白是一类具有EF-手型的钙调蛋白,具有多种细胞内外的生物学功能;S100A9为该家族成员之一,是由嗜中性粒细胞和巨噬细胞在微生物成分或细胞因子刺激时分泌的促炎性蛋白,主要与S100A8以异源二聚体的形式发挥作用[1]。作为免疫原性蛋白,其高表达于各种炎性疾病和肿瘤微环境,具有促炎症扩散、抗菌、抑制多种正常细胞(巨噬细胞、淋巴细胞、成纤维细胞等)和肿瘤细胞(乳腺癌细胞、淋巴瘤细胞、白血病细胞等)生长的活性[2];但是,目前也有研究表明,其能产生骨髓起源的抑制细胞(MDSCs),从而促进肿瘤产生免疫逃逸[3]。上述研究提示S100A9在人体多种疾病如炎症、肿瘤中发挥着重要作用,但其作用机制还有待进一步探讨。
本实验利用基因重组技术将hS100A9基因插入原核表达载体pGST-moluc,并在大肠杆菌BL21中诱导表达,再用谷胱甘肽-琼脂糖4B球珠(Glutathione Sepharose 4B beads,GS4BB)分离纯化出高纯度的 GST-hS100A9融合蛋白,为进一步研究hS100A9蛋白的功能及其作用机制奠定基础。
1 材料和方法
1.1 材料
pGST-moluc、pHAHA-hS100A9质粒由美国芝加哥大学医学中心分子肿瘤研究室馈赠;PCR引物由Takara公司合成;高保真PCR、普通PCR、DNA连接试剂盒、限制性内切酶 BamHⅠ和 HindⅢ 购自Takara公司;胶回收、DNA纯化试剂盒购自Omega公司;异丙基-β-D-硫代半乳糖苷(IPTG)购自 Bio Basic Inc;预染的蛋白质相对分子质量(Mr)标准购自Fermertans;丙烯酰胺、还原型谷胱甘肽购自Amresco;GS4BB购自Amersharm Biosciences;hS100A9抗体购自SANTA CRUS公司;BCA蛋白测定试剂盒购自Beyotime;CCK-8试剂盒购自Dojindo公司。
1.2 pGST-hS100A9质粒的构建
1.2.1 hS100A9基因片段的获得 以 pHAHA-hS100A9为模板,设计含BamHⅠ/HindⅢ酶切位点的hS100A9片段的引物(sense/BamHⅠ:5'-CGCGGATCCGCATGACTTGCAAAATGTCGCAG-3',antisense/HindⅢ:5'-CCCAAGCTTTTAGGGGGTGCCCTCCCCGAG-3'),用高保真PCR扩增hS100A9片段,15g/L琼脂糖凝胶电泳,DNA回收试剂盒回收hS100A9片段。
1.2.2 hS100A9片段与载体 pGST-moluc的连接BamHⅠ和HindⅢ双酶切hS100A9及 pGST-moluc,酶切产物经纯化试剂盒纯化,DNA连接试剂盒连接,连接产物命名为pGST-hS100A9。
1.2.3 pGST-hS100A9的鉴定 以上连接产物经乙醇沉淀后电转入DH5α菌,并接种于含氨苄西林(Amp)100 μg/mL的LB平板,37℃培养过夜后挑取单个菌落接种于含Amp 100 μg/mL的LB培养基2 mL 中,37 ℃、180 r/min 振荡培养 6 h,取 1.5 μL做hS100A9片段的菌液PCR。将菌液继续扩大培养后提质粒,取 5 μL送测序,5 μL 用 BamHⅠ和HindⅢ双酶切鉴定。
1.3 大肠杆菌BL21的转化
氯化钙法制备感受态的大肠杆菌BL21,加重组质粒 pGST-hS100A9置冰浴 30 min,37℃水浴2 min,冰浴2 min;转入预热至37℃的LB培养基1 mL中,37 ℃,180 r/min,振荡培养1 h。取转化反应液100 μL铺于含 Amp 100 μg/mL的 LB平板培养,37℃过夜,挑取两个菌落,接种到含Amp 100 μg/mL的LB培养基10 mL中,37℃,180 r/min,振荡培养过夜,提质粒。
1.4 GST-hS100A9融合蛋白的表达
取上一步过夜培养物1.5 mL接种于含Amp 100 μg/mL的 LB培养基300 mL中,37℃,200 r/min,振荡培养3 h,加入 IPTG(终浓度0.1 mmol/L),37℃,200 r/min,振荡培养3 h,完成融合蛋白的诱导表达。4℃,5000 r/min离心10 min收集细菌沉淀,保存于-80℃或立即进行蛋白分离纯化。同步诱导表达对照蛋白GST(其质粒为pGST-moluc)。
1.5 融合蛋白的分离纯化
每100 mL菌液的沉淀用磷酸盐缓冲液(PBS)5 mL重悬,加入蛋白酶抑制剂和终浓度为0.1%的Triton-X100,冰上超声裂解细菌(参数:振幅26%,超声3 s,间隔3 s,总时间60 min),冰上摇动孵育30 min。4 ℃,10000 r/min离心20 min,取上清,每10 mL上清加入50%GS4BB混悬液400 μL,冰上摇动孵育 3 h,4 ℃,1000 r/min 离心5 min,弃上清,冷PBS洗涤3次,去上清,加入洗脱缓冲液300 μL,冰上摇动洗脱3 h,4℃,1000 r/min离心5 min,重复洗脱3次,上清即为所得融合蛋白。取洗脱液20 μL进行SDS-PAGE,考马斯亮蓝染色、凝胶成像仪成像,Quantity One软件分析纯化效果,余分装后于-80℃保存。
1.6 Western blot鉴定融合蛋白
取适量纯化所得的融合蛋白,以GST蛋白为阴性对照,加入等体积2×SDS凝胶加样缓冲液,煮沸后取10 μL上样,行SDS-PAGE和Western blot鉴定。
1.7 融合蛋白的定量
按照说明书操作,在酶标仪上测定540 nm波长处的吸光度(A)值,用A为纵坐标、牛血清白蛋白(BSA)浓度(C)为横坐标作标准曲线,融合蛋白GST-hS100A9稀释10倍后测定,并由此计算所制备的融合蛋白的浓度及产量。
1.8 GST-hS100A9对乳腺癌细胞MCF-7增殖的影响
按照CCK-8操作说明,在96孔板中接种浓度为2500个/孔的 MCF-7细胞悬液(培养基为含10%FBS 的 RPMI 1640)100 μL,37 ℃,5%CO2的细胞培养箱12 h后将培养基换为含1%FBS的RPMI 1640,同时加入干预因素,实验分为3组:空白对照组、GST对照组、GST-hS100A9组,后两组分别加入相应蛋白使其终浓度为100 μg/mL,每组设3个复孔,于37 ℃,5%CO2的细胞培养箱培养1,2,3 d后加入 CCK-8试剂 10 μL,培养箱孵育 2 h后在450 nm处波长测定A值。A值采用SPSS12.0统计软件进行显著性检验,P<0.05为差异具有显著性。
2 结果
2.1 hS100A9基因片段的获得
用高保真PCR从pHAHA-hS100A9中扩增hS100A9基因片段,其产物经琼脂糖凝胶电泳后可见约360 bp的条带(图1)。

图1 高保真PCR获得hS100A9基因片段Fig.1 hS100A9 gene from high fidelity PCR
2.2 pGST-hS100A9 的鉴定
用BamHⅠ和HindⅢ双酶切pGST-hS100A9,正确重组的质粒可以得到约360 bp和5 kb的两个片段。图2所示酶切结果提示质粒重组成功。将pGST-hS100A9送测序,测序结果示hS100A9成功重组入质粒pGST-moluc(结果未显示)。

图2 BamHⅠ和HindⅢ双酶切鉴定pGST-hS100A9Fig.2 pGST-hS100A9 digested with BamHⅠand HindⅢ
2.3 GST-hS100A9 的鉴定
3次洗脱共获得融合蛋白GST-hS100A9溶液1.5 mL,将其与对照蛋白GST进行SDS-PAGE和考马斯亮蓝染色,结果如图3A所示,融合蛋白Mr为36000,GST Mr为26000,与预期值相符;用 Quantity One软件分析纯化效果,GST-hS100A9纯度为94%。用hS100A9抗体针对GST-hS100A9和GST行Western blot检测,结果如图3B所示,GST-hS100A9融合蛋白与抗体呈现特异反应,而GST则与该抗体没有反应。
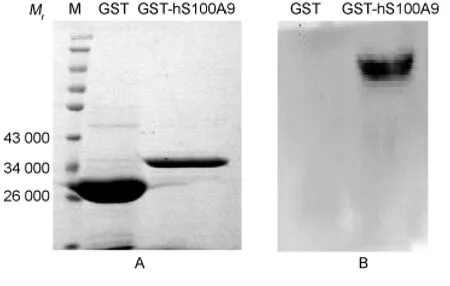
图3 GST-hS100A9的SDS-PAGE鉴定(A)及Western blot鉴定(B)电泳图Fig.3 SDS-PAGE(A)and Western blot(B)of GST-hS100A9
2.4 GST-hS100A9 的定量
BSA 的标准曲线方程为:A=0.314 C+0.005,r=0.9962,线性范围为 20 ~2000 μg/mL。本次菌液300 mL制备hS100A9-GST融合蛋白,3次洗脱共获得融合蛋白GST-hS100A9溶液1.5 mL,测定其蛋白浓度为4 mg/mL,因此总量为6 mg。
2.5 GST-hS100A9抑制MCF-7的增殖
CCK-8测定GST-hS100A9对MCF-7增殖的影响结果见表1。可见,3个时间点空白组和GST组的活细胞数无明显差异(P>0.05),第1天 GST-hS100A9组与空白组及GST组无明显差异(P>0.05),从第2天开始,GST-hS100A9组比空白组及GST组活细胞数减少,第3天分别为空白组和GST组的75%和76%,差异具有统计学意义(P<0.05)。提示GST-hS100A9抑制MCF-7细胞的增殖。
3 讨论
S100蛋白是一类具有EF-手型结构的钙调蛋白,目前发现该家族至少有25个成员,其中21个成员的基因定位在人染色体1q21上,该区染色体稳定性差,易发生人染色体重排,与肿瘤关系密切[4-5]。S100A9是定位于该染色体上的S100家族成员之一。它是由嗜中性粒细胞分泌和表达的一种具有免疫原性的蛋白质,有抑制细胞生长、抗菌、抑制巨噬细胞的活化的作用[6-7]。但近来研究发现,S100A9可促进肿瘤微环境中骨髓起源的抑制细胞(MD-SCs)和肿瘤相关性巨噬细胞(TAM)的产生,这两种细胞能抑制T细胞、NK细胞、巨噬细胞的免疫杀伤功能,产生促细胞生长的多种细胞因子[8-12],S100A9作为肿瘤微环境中的重要因子,有效的调控着肿瘤的动态发展过程,因此进一步探讨S100A9在肿瘤中的作用及作用机制具有重要意义。
表1 GST-hS100A9作用不同时间对MCF-7增殖的影响(,n=3)Tab.1 The effects of GST-hS100A9 on cell proliferation of MCF-7 in different time(,n=3)

表1 GST-hS100A9作用不同时间对MCF-7增殖的影响(,n=3)Tab.1 The effects of GST-hS100A9 on cell proliferation of MCF-7 in different time(,n=3)
与空白组相比:1P<0.05;与GST组相比:2P<0.05Compared with control group:1P <0.05;Compared with GST group:2P <0.05
组 别A4501 d 2 d 3 d空白组0.991 ±0.096 2.060 ±0.086 2.710 ±0.076 GST 组 1.072 ±0.068 2.092 ±0.072 2.646 ±0.075 GST-hS100A9 组 0.990 ±0.048 1.889 ±0.0791,2 2.024 ±0.0561,2
本文选择pGEX系列表达载体表达GST-hS100A9融合蛋白来研究其生物学功能和作用。该表达载体表达的融合蛋白既易于制备,纯度较高,且保持有外源蛋白的生物学活性。我们通过基因重组技术将hS100A9基因插入融合表达载体pGST-moluc中构建了 pGST-hS100A9,经过BamHⅠ和HindⅢ双酶切鉴定,其所产生的两个片段与限制性内切酶图谱相符,提示质粒构建成功。将质粒转化大肠杆菌,经IPTG诱导表达融合蛋白GST-hS100A9。随后利用谷胱甘肽偶联球珠分离出融合蛋白,再经含有还原型谷胱甘肽的洗脱缓冲液洗脱,离心后在上清中得到纯化的融合蛋白。对纯化的蛋白进行SDSPAGE和考马斯亮蓝染色以及Western blot鉴定,证实诱导表达的融合蛋白为GST-hS100A9,且纯度达94%,与通常报道的一步亲和色谱可分离纯化纯度90%以上蛋白一致;这也进一步证实了该融合蛋白质粒构建正确。BCA法测定诱导表达的菌液300 mL获得了融合蛋白6 mg,产量高。且该蛋白可以抑制MCF-7细胞的增殖,与Li等[13]报道的结果相符,为我们进一步研究hS100A9的生物学功能及其作用机制提供了良好的条件。
[1]Roth J,Vogl T,Sunderkotter C,et al.Chemotactic activity of S100A8 and S100A9[J].J Immunol,2003,171:5651-5659.
[2]Hiratsuka S,Watanabe A,Aburatani H,et al.Tumour-mediated upregulation of chemoattractants and recruitment of myeloid cells pre-determines lung metastasis[J].Nat Cell Biol,2006,8(12):1369-1375.
[3]Sinha P,Okoro C,Foell D,et al.Proinflammatory S100 proteins regulate the accumulation of myeloid-derived suppressor cells[J].J Immunol,2008,181(7):4666-4675.
[4]Donato R.Intracellular and extracellular roles of S100 proteins[J].Microsc Res Tech,2003,60:540-551.
[5]Sedaghat F,Notopoulos A.S100 protein family and its application in clinical practice[J].Hippokratia,2008,12(4):198-204.
[6]Rammes A,Roth J,Goebeler M,et al.Myeloid-related protein(MRP)8 and MRP14,calcium-binding proteins of the S100 family,are secreted by activated monocytes via a novel,tubulin-dependent pathway[J].J Biol Chem,1997,272:9496-9502.
[7]Frosch M,Strey A,Vogl T,et al.Myeloid-related proteins 8 and 14 are specifically secreted during interaction of phagocytes and activated endothelium and are useful markers for monitoring disease activity in pauciarticular-onset juvenile rheumatoid arthritis[J].Arthritis Rheum,2000,43:628-637.
[8]Mantovani A,Schioppa T,Porta C,et al.Role of tumor-associated macrophages in tumor progression and invasion[J].Cancer Metastasis Rev,2006,25:315-322.
[9]Allavena P,Sica A,Solinas G,et al.The inflammatory micro-environment in tumor progression:the role of tumor-associated macrophages[J].Crit Rev Oncol Hematol,2008,66(1):1-9.
[10]Li Hequan,Han Yanmei,Guo Qiuli,et al.Cancer-expanded myeloid-derived suppressor cells induce anergy of nk cells through membrane-bound TGF-β11[J].J Immunol,2009,182:240-249.
[11]Sinha P,Clements V K,Bun S K,et al.Cross-talk between myeloid derived suppressor cells and macrophages subverts tumor immunity toward a type 2 response[J].J Immunol,2007,179:977-983.
[12]Sinha P.Proinflammatory S100 proteins regulate the accumulation of myeloid-derived suppressor cells[J].J Immunol,2008,181:4666-4675.
[13]Li Cong,Zhang Fang,Lin Meihong,et al.Induction of S100A9 gene expression by cytokine oncostatin M in breast cancer cells through the STAT3 signaling cascade[J].Breast Cancer Res Treat,2004,87:123-134.
