表达谱芯片分析PPAR-α调控脂肪代谢过程作用机理的研究
2011-05-03侯晓亮毕重朋
侯晓亮,毕重朋
(1.东北农业大学动物营养研究所,哈尔滨 150030;2.黑龙江民族职业学院,哈尔滨 150081)
哺乳动物的脂肪代谢为三大物质代谢之一,其信号转导途径具有复杂而精细的调控网络,主要参与了机体的能量供应及储存、生物膜的构成及其他一些重要的生命过程。脂肪代谢主要包括甘油三酯(TG)代谢、胆固醇及其酯的代谢、磷脂和糖脂代谢等。
在这些代谢过程中,大量的蛋白酶、受体、转录因子等参与其中,又受一些信号转导途径的调控,形成了复杂而精细的调控网络,以维持细胞乃至整个机体的脂代谢平衡。小肠对于饲料养分的选择性吸收往往是被一些运输蛋白和代谢酶类所介导的,这些物质被统称为“肠道屏障蛋白”。其中,过氧化物酶体增殖物激活受体α(PPAR-α)是一种在基因表达水平上调节脂肪代谢作用的重要受体,且大量富集于肠内表达。
基因芯片技术是20世纪90年代以来生命科学领域中的重大科技进步之一,是集分子生物学、化学、微电子学、计算机科学、统计学和生物信息学等诸多学科为一体的高新技术。近年来基因芯片技术不断得到完善,并在发病机理、诊断治疗、药物筛选与研发、染色体缺陷等诸多领域显示出了巨大的应用价值。在动物体的研究中,主要通过对小鼠、大鼠和畜禽等试验来探索基因功能、新药筛选、疾病的临床诊断和检测等。随着基因芯片技术的广泛应用以及相关芯片实验数据在公共数据库中的公布,为从基因组层面上研究转录因子PPAR-α调控脂肪代谢过程机理提供了理论参考。
1 试验材料
从NCBI中的GEO数据库搜索并获得与小鼠脂肪代谢相关的基因芯片数据,序列号为GSE9533,芯片平台为Affymetrix公司的小鼠全基因组Mouse 430_2芯片[1]。该系列芯片总样本数为35个,从中选取与转录因子PPAR-α的激活剂WY14643相关的后8个样本数据,包括野生型样本4个(样本号分别为GSM241420~GSM241423),PPAR-α 敲出型样本4个(样本号分别为GSM241424~GSM241427)。该芯片为分别选取纯种的野生型(129S1/SvIm J)和PPAR-α敲出型(129S4/SvJae)小鼠作为试验对象,并在其饲料中添加WY14643,饲养6 h后,分别取各组中4只小鼠小肠组织的RNA样本,用MOE 430v2.0GeneChip™阵列标记。
2 试验方法
2.1 显著性差异表达
研究PPAR-α的缺失对小鼠基因组结构的改变情况,对该芯片的显著性差异表达基因进行分析。运用RobustMultichip Averaging(RMA)算法对所选取的8个样本数据进行背景校正和标准化操作[2];针对Case-Control的试验设计,利用非配对t检验方法比对处理组与对照组样本基因表达量,筛选与PPAR-α转录因子存在着显著性相关的基因,其中将显著性水平阈值设为0.05(P=0.05),倍数改变值(Fold Change)设定为2。上述操作均在R程序结合Bioconductor软件包的环境下实现的[3]。
2.2 聚类分析和通路分析
运用2×3的自组织聚类法(SOM)对上述差异表达基因进行聚类分析;为了确定所筛选出来的显著性差异表达基因所参与的通路,采用费舍尔精确性检验(Fisher exact test)原理并结合KEGG数据库及DAVID网络数据库工具对差显基因进行功能注释和通路分析[4-5]。
3 试验结果
3.1 显著性差异表达基因分析
通过显著性差异表达分析,利用各基因的P值和倍数改变量得到显著性差异表达基因数为158个,其中上调的基因有7个,下调的基因有151个。即表明与PPAR-α的缺失存在显著性正相关的基因有7个,负相关的基因有151个。
3.2 聚类分析
通过对非配对t检验方法所得到的158个显著性差异表达基因的聚类分析,可以得到6种聚类。其中,第一聚类包含23个基因,表达量值取以2为底的对数变化范围从-1到2;第二聚类包含20个基因,表达量值取以2为底的对数变化范围从-3到2;第三聚类包含38个基因,表达量值取以2为底的对数变化范围从-2.5到2.5;第四聚类包含35个基因,表达量值取以2为底的对数变化范围从-2到2;第五聚类包含21个基因,表达量值取以2为底的对数变化范围从-3到2.5;第六聚类包含21个基因,表达量值取以2为底的对数变化范围从-4到4.5。
3.3 通路分析
设定显著性水平阈值为0.01,得到与PPAR-α显著性相关的通路有10个,见附表。
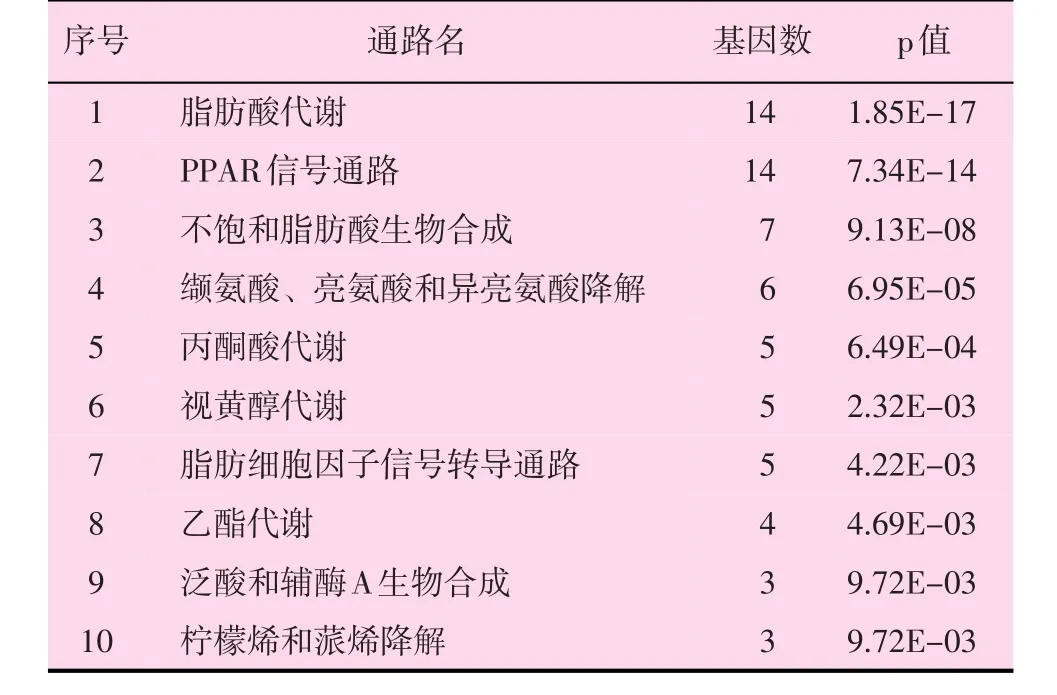
附表 与PPAR-α显著性相关通路列表
如附表所示,与PPAR-α显著性相关的通路包括最显著的为脂肪酸代谢通路,显著性水平为1.85E-17,包含14个差异显著性基因;其次,依次包含PPAR信号通路、不饱和脂肪酸生物合成、缬氨酸、亮氨酸和异亮氨酸降解、丙酮酸代谢、视黄醇代谢、脂肪细胞因子信号转导通路、乙酯代谢、泛酸和辅酶A生物合成以及柠檬烯和蒎烯降解这9个通路。
4 讨论
哺乳动物的小肠是消化和吸收饲料以及营养物质的主要场所。小肠上皮组织对这些营养物质分子的吸收主要是通过多个跨膜转运体来实现,主要包含溶质载体和ATP结合盒这两个转运超家族[6-7]。很多研究表明,营养物质影响基因表达作用主要是通过激活或者抑制特定的转录因子来实现的[8-9]。其中,过氧化物酶体增殖物激活受体(PPARs)是一类重要的受体,其能够在基因表达水平上调节膳食中脂肪酸及其衍生物代谢作用[10]。同时,PPAR s含三个亚型即α、β和γ,各自具有不同的特点以及生物学功能。PPAR-α已经被证实在小肠中表达量较高[11-12]。然而,目前对于PPAR-α在小肠中调节脂肪代谢的分子遗传学机制的研究报道较少。
本研究基于表达谱芯片数据分析结果表明,PPAR-α在小鼠小肠组织细胞中调控脂肪代谢过程是通过一系列的相关通路及其关键基因起作用的。脂肪细胞分化与糖和脂肪代谢、机体能量平衡、肥胖、Ⅱ型糖尿病、脂肪肝、高血脂及乳腺癌等有着十分密切的关系。在医学领域,对脂肪细胞分化机制及其调控的研究对于了解、预防和治疗这些重大疾病具有重大的理论和现实意义。在动物科学领域,研究动物脂肪细胞分化的调控机理,结合脂肪代谢调控的研究成果,增加脂肪在肌肉内的沉积,减少皮下和内脏的脂肪积累,以实现对动物脂肪沉积的调控,从而改善肉品品质。
目前,PPAR-α作为脂肪代谢过程中重要的转录因子已成为研究的热点[13]。本文通过对在小鼠小肠中与转录因子PPAR-α相关芯片的分析,得到了在脂肪酸代谢过程中与PPAR-α相关的靶基因Gyk、Hmgcr等,并获得了在PPAR-α调控脂肪代谢过程中显著性参与的一些通路,如PPAR信号通路和脂肪酸代谢通路等。这些都有助于从基因组层面上更好地了解PPAR-α调控小肠脂肪代谢过程作用的机理,从而为实现上述目标提供了重要的分子生物学基础。
[1]Kim S,Huang LW,Snow K J,etal.Amousemodel of conditional lipodystrophy[J].Proc Natl Acad Sci USA,2007,104(42):16 627-16 632.
[2]Gautier L,Cope L,Bolstad BM,etal.Affy-analysis of Affymetrix GeneChip data at the probe level[J].Bioinformatics,2004,20(3):307-315.
[3]Reimers M,Carey V J.Bioconductor:an open source framework for bioinformatics and computational biology[J].Methods Enzymol,2006,411:119-134.
[4]Huang DW,Sherman B T,LempickiRA.Systematic and integrative analysis of large gene lists using DAVID bioinformatics resources[J].NatProtoc,2009,4(1):44-57.
[5]Dennis G J,Sherman B T,Hosack D A,et al.DAVID:Database for annotation,visualization,and integrated discovery[J].Genome Biol,2003,4(5):3.
[6]Borst P,Elferink RO.Mammalian ABC transporters in health and disease[J].Annu Rev Biochem,2002,71:537-592.
[7]Hediger M A,Romero M F,Peng JB,et al.The ABCs of solute carriers:physiological,pathological and therapeutic implications of human membrane transport proteins Introduction[J].Pflugers Arch,2004,447(5):465-468.
[8]Desvergne B,Michalik L,WahliW.Transcriptional regulation of metabolism[J].PhysiolRev,2006,86(2):465-514.
[9]Muller M,Kersten S.Nutrigenomics:goals and strategies[J].Nat Rev Genet,2003,4(4):315-322.
[10]Michalik L,Auwerx J,Berger JP,et al.International Union of pharmacology LXI peroxisome proliferator-activated receptors[J].PharmacolRev,2006,58(4):726-741.
[11]BungerM,Vanden BHM,VanderM J,etal.Genome-wideanalysis of PPAR alpha activation in murine small intestine[J].Physiol Genomics,2007,30(2):192-204.
[12]De Vogel-den BHM,BungerM,DeGPJ,etal.PPARalpha-mediated effectsofdietary lipidson intestinalbarrier geneexpression[J].BMCGenomics,2008,19(9):231.
[13]Briand F,Naik SU,Fuki I,et al.Both the peroxisome proliferator-activated receptor delta agonist,GW 0742,and ezetimibe promote reverse cholesterol transport in mice by reducing intestinal reabsorption of HDL-derived cholesterol[J].Clin Transl Sci,2009,2(2):127-133.
