液相色谱法测定小鼠脑组织中ATP、ADP及AMP含量
2011-04-28吴燕川李尧华谢胜男何士大
吴燕川 李尧华 谢胜男 李 昕 于 顺 何士大
(1.首都医科大学宣武医院中心实验室,神经变性病教育部重点实验室,北京 100053;2.首都医科大学宣武医院神经生物学研究室,北京 100053)
三磷酸腺苷(adenosine triphosphates,ATP)是生物机体的能量来源,在细胞代谢活动中占有重要地位。腺苷酸指三磷酸腺苷(ATP)、二磷酸腺苷(adenosine diphosphates,ADP)和一磷酸腺苷(adenosinemonophosphate,AMP)的总称。腺苷酸(ATP+ADP+AMP)浓度是描述细胞代谢的主要参数,在急性重复低氧小鼠脑组织中,测定脑组织中腺苷酸的含量具有重要意义。高效液相色谱-可变波长检测法(high performance liquid chromatogram-variable wavelength detector,HPLC-VWD)是目前测定嘌呤、嘧啶复合物含量变化的主要方法之一[1-7]。文献[1,4-5]报道测定腺苷酸的方法在流动相组成方面存在可优化之处,本实验通过改良的HPLC-VWD方法,测定急性重复低氧暴露小鼠脑组织中的三磷酸腺苷、二磷酸腺苷、一磷酸腺苷的含量。
1 材料和方法
1.1 仪器与试剂
Agilent1200高效液相色谱仪(安捷伦公司,美国),系统组成:G1322A脱气机,G1311A四元泵,G1329A自动进样器,G1316A柱温箱,G1314B可变波长检测器,Agilent1200工作站。JY92-Ⅱ超声波细胞粉碎机(上海新芝生物技术研究所)。
ATP、ADP、AMP标准品均为分析纯(Sigma公司,美国),甲醇为色谱纯(Fisher公司),磷酸二氢钾、磷酸氢二钾、高氯酸等均为国产分析纯。
1.2 色谱条件
SUPELCO Discovery○RC18反相色谱柱(15 mm×4.6 mm,5 μm)及填充材料相同的预柱(12.5 mm ×4.6 mm,5 μm)。流动相:磷酸盐缓冲液(30 mmol/L,pH 5.85,缓冲对为 K2HPO4-KH2PO4,含 5% 甲醇),先用 0.45 μm 滤膜过滤,再用 0.22 μm 的滤膜抽滤,现用现配。检测波长:254 nm;流速:1.0 mL/min;柱温:30℃;进样量20 μL;定量方法:采用外标法定量。
1.3 动物模型的制作
选用6~8周BALB/c近交系雄性小鼠,体质量18~22 g,清洁级,由军事医学科学院实验动物研究中心〔SCXK-(军)许可证号:2002-001〕提供。将20只小鼠按照数字表法随机分成4组,每组5只,分别进行重复低氧暴露 0、1、3、5 次,命名为 H0、H1、H3、H5组。在18℃~20℃条件下将小鼠放入含有新鲜空气的125 mL广口瓶中,用橡皮塞塞紧并计时。随着小鼠的呼吸,氧气逐渐减少,当小鼠第1次出现哮喘呼吸后,立即结束低氧处理,此为低氧1次(H1组)。将小鼠取出,待小鼠恢复翻正反射后(约需1~3 min),将其放入一个新的广口瓶中,塞紧橡皮塞。依此方法,给小鼠连续缺氧处理5次,记录每次从密闭开始到喘呼吸出现的时间。该时间称为小鼠低氧耐受时间。
1.4 重复低氧暴露小鼠脑组织中磷酸腺苷的提取
当小鼠达到缺氧耐受极限时,立即拿出,在冰台上迅速断头取脑并称质量,按5 μL/mg的比例加入冰预冷的0.4 mol/L高氯酸,于超声波细胞粉碎机中粉碎、匀浆;4 ℃,10 000×g离心,10 min,2次;取上清液,用5 mol/L的KOH调pH值至6.0~6.5,取上清,用 0.22 μm 滤膜过滤,待测。
1.5 统计学方法
应用SPSS 10.0统计软件对数据进行统计分析(One-way ANOVA)。组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 标准曲线、线性关系及检测限
用超级纯净水将ATP、ADP、AMP的标准品分别配成1 g/L的储备液,再用超级纯净水稀释成10、20、40、60、80、100 mg/L 的浓度,制作标准曲线。每个腺苷酸以其浓度为横坐标C,以其面积为纵坐标A进行线性回归分析,得到腺苷酸回归方程与相关系数分别为:① ATP:A=28.924C+14.144,γ =0.999 90;②ADP:A=31.504C - 12.608,γ =0.999 92;③ AMP:A=46.539C -5.255,γ =0.999 95。ATP、ADP、AMP标准品色谱图及脑组织中腺苷酸样品色谱图详见图1。倍信噪比为3,检出限为1 μg。

图1 ATP、ADP、AMP的标准品及组织样品色谱图Fig.1 The chromatogram of adenine nucleotides standard and tissue sample
2.2 精密度测定实验
将腺苷酸标准品混合液40 mg/L一天8 h内不定时进样5次,进行色谱分析,测得日内精密度;配以相同浓度的 ATP、ADP、AMP,每天进样测定,共 5 d,测得日间精密度。详见表1。
2.3 回收率实验
于已知浓度的脑组织中分别加入浓度为20、40及60 mg/L的腺苷酸标准品混合液,测定后扣除样品中原有含量,得到ATP、ADP、AMP的平均回收率(n=5)。详见表2。

表1 ATP、ADP和AMP日内、日间精密度Tab.1 The precision of ATP、ADP and AMP (%)

表2 回收率试验结果Tab.2 The results of recovery rate
2.4 各组实验测定结果
测定20只低氧暴露小鼠脑组织中ATP、ADP及AMP的含量,共4组,每组5只。详见表3。
表3 低氧暴露小鼠脑组织中腺苷酸含量检测结果Tab.3 Concentration of adenosine phosphates in the mouse brain()
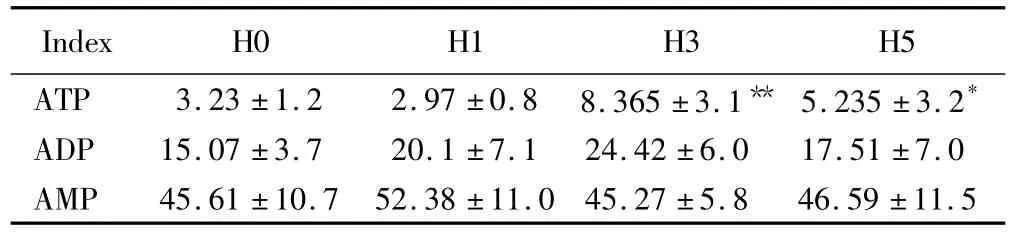
表3 低氧暴露小鼠脑组织中腺苷酸含量检测结果Tab.3 Concentration of adenosine phosphates in the mouse brain()
*P <0.05,** P <0.01 vs H0 group;ATP:adenosine triphosphate;ADP:adenosine diphosphate;AMP:adenosine monophosphate.
Index H0 H1 H3 H5 ATP 3.23 ±1.2 2.97 ±0.8 8.365 ±3.1** 5.235 ±3.2*ADP 15.07 ±3.7 20.1 ±7.1 24.42 ±6.0 17.51 ±7.0 AMP 45.61 ±10.7 52.38 ±11.0 45.27 ±5.8 46.59 ±11.5
其中H3及H5组与H0组ATP比较,差异有统计学意义(P <0.01,P <0.05,n=5)。
3 讨论
流动相的洁净程度对HPLC实验的顺利进行至关重要,不洁的流动相会使系统压力增加、基线噪音增大,产生漂移,甚至终止进样。本实验使用国产分析纯磷酸盐缓冲液做流动相中的无机盐成分,由于相对于进口产品,国产分析纯试剂价格很便宜但含杂质比较多,因此在进样前对所配流动相用0.45 μm滤膜过滤,再用0.22 μm的滤膜抽滤的双重过滤方法,使整个实验过程中系统压力一直很平稳,确保了实验顺利进行。有文献[1,4,7]报道流动相中使用了乙腈。乙腈是一种价格昂贵且毒性较大的试剂。本实验采用甲醇替代乙腈,既经济又能很好地分离3种腺苷酸。文献[5]报道使用无有机溶剂的流动相,虽然可以降低实验费用,但本实验室的Supelco Discovery C18反相柱不是纯水相柱,纯水相的流动相会降低柱性能,使柱子中固定相硅胶受损,对反相柱寿命影响很大。本实验比较过含5%和含10%甲醇的流动相进行分离分析,结果提示含5%的流动相可使3种物质在10 min内就能很好地分离,可操作性强。
生物体产生的ATP是其各种生命活动所需能量的直接来源,有氧情况下产生的ATP是其能量的主要来源。ATP去磷酸化转化为ADP和AMP,从而释放能量供生物体利用。低氧预适应是一种细胞内源性保护机制,这种机制在短暂、亚致死性的重复性低氧刺激下可增强组织对继发严重低氧的耐受程度[8]。动物整体低氧耐受时间是衡量脑组织低氧耐受的一个重要指标,急性重复低氧模型的典型表现是低氧耐受时间随低氧次数增加呈线性递增[9]。在有氧受到限制的条件下,脑组织中ATP的含量一过性降低,随低氧暴露次数增加,ATP含量升高,重复低氧暴露可使脑组织中ATP水平有所升高[10],本实验方法测得的大鼠脑组织中ATP与以往文献[10]报道结果一致,表明本方法测定的数据可信。
目前磷酸腺苷的测定方法还有薄层扫描法[11]及酶学[12]等方法,但整个实验操作过程很繁琐。高效液相色谱-可变波长检测法应是一种经济、简便、重现性好,结果准确可信的测定磷酸腺苷的方法,可适用于低氧损伤的基础与临床相关研究。
[1]Marklund N,Salci K,Ronquist G,et al.Energy metabolic changes in the early post-injury period following traumatic brain injury in rats[J].Neurochem Res,2006,31(8):1085-1093.
[2]潘峰,孙玮,王一健,等.反相高效液相色谱分析大鼠脑组织腺苷酸[J].解放军预防医学杂志,2001,19(5):343-345.
[3]Beátaá Sperlágh,E Sylvester Vizi.Extracellular interconversion of nucleotides reveals an ecto-adenylate kinase activity in the rat hippocampus[J].Neurochem Res,2007,32(11):1978-1989.
[4]Chen Y,Xing D,Wang W,et al.Development of an ionpair HPLC method for investigation of energy charge changes in cerebral ischemia of mice and hypoxia of Neuro-2a cell line[J].Biomed Chromatogr,2007,21(6):628-634.
[5]Miao Y,Wang C L,Yin H J,et al.High performance liquid chromatogram(HPLC)determination of adenosine phosphates in rat myocardium[J].Beijing Da Xue Xue Bao,2005,37(2):201-202.
[6]Al-Awadi F M,Khan I.Blood purine and energy status in rats with colitis[J].Dig Dis Sci,2001,46(2):443-448.
[7]Sperlágh B,Zs Mergl,Zs Jurányi,et al.Local regulation of vasopressin and oxytocin secretion by extracellular ATP in the isolated posterior lobe of the rat hypophysis[J].J En-docrinology,1999,160(3):343-350.
[8]Tsai B M,Wang M,March K L,et al.Preconditioning:evoluti on of basic mechanisms to potential therapeutic strategies[J].Shock,2004,21(3):195-209.
[9]邵国,高翠英,吕国蔚.氯化钴预处理对缺氧预适应小鼠缺氧耐受的影响[J].首都医科大学学报,2005,26(3):288-290.
[10]谢胜男,李昕,李尧华,等.急性重复低氧对小鼠脑组织血氧饱和度、线粒体功能以及ATP水平的影响[J].中国病理生理杂志,2008,24(4):755-758.
[11]郭丙炎,吴胜丹,王岚,等.三磷酸腺苷二钠及其制剂含量测定方法的改进[J].中国药品标准,2002,3(5):28-29.
[12]陈六生,葛才保,张力.细胞外三磷腺苷(eATP)测定方法的建立[J].现代检验医学杂志,2007,22(2):72-73.
