晚期内体的分选转运参与Ⅱ型腺相关病毒在IB3人支气管上皮转化细胞中的转导激活过程
2011-04-28闫韶飞文朝阳高尔静郑少鹏
闫韶飞 文朝阳 高尔静 牛 静 郑少鹏 丁 卫*
(1.首都医科大学基础医学院生物化学与分子生物学系,北京 100069;2.首都医科大学医学影像学分析测试中心,北京 100069)
腺相关病毒(adeno-associated virus,AAV)是基因治疗中发展比较成熟的病毒载体之一,其中Ⅱ型腺相关病毒(AAV2)的应用最为广泛[1]。近年来的研究[2-4]结果提示,腺相关病毒在宿主细胞内的转运过程是其转导激活并表达所携带外源基因时所需要的主要限速步骤之一。然而病毒在被细胞内吞后的分选(sorting)步骤通常是非常复杂的多阶段动态过程,并且常常具有很强的多态性。尽管在过去基于对细小病毒种属的研究中,曾有其在晚期内体分选的电镜证据等提示性结果,但对于腺相关病毒这一家族成员在特定细胞系中内体分选的情况,特别是应用现代荧光标记和成像技术的直接研究相对较少,且部分报道[3,5-7]存在分歧。
当前在针对细胞囊泡运输及其分选机制的主流研究中,RAB蛋白是公认的特异性最好的囊泡类型标志物。其中RAB7在成熟的晚期内体(late endosome,LE)表面有比较广泛的特异性分布,不仅参与了晚期内体的正常生物学功能,同时也可以用作晚期内体的示踪和分离标志物[8]。RAB11是细胞内循环内体 (recycling endosome,RE)的标志物,与RAB7阳性的晚期内体有着截然不同的形态和分布,2者较少存在交叉[9]。IB3细胞是取源于男性囊性肺纤维化患者的支气管上皮组织,经SV40腺病毒感染永生化后所得到的细胞系。IB3细胞对AAV2有较好的易感性,比较容易进行质粒的瞬时转染实验[10]。正常培养条件下,细胞生长比较铺展,比较适于进行高分辨力的显微图像分析。此外,IB3细胞的内体丰富,细胞内转运途径活跃,在病毒分离实验的回收效率较好。因此,本研究中采用了该细胞系为研究对象,利用形态学和细胞生物学的不同方法针对AAV的细胞内转运进行了相关的实验。
1 材料和方法
1.1 材料和试剂
IB3细胞从美国模式培养物保藏所(American Type Culture Collection,ATCC)获得,用含10%胎牛血清(fetal bovine serum,FBS)的 DMEM培养基进行培养。腺相关病毒AV2.luc由本实验室依照经典的三质粒包装系统通过转染293T宿主细胞制备,经氯化铯梯度离心进行纯化,透析后由qPCR方法确定病毒滴度后分装备用。PCR引物和探针购自美国IDT公司。Rab7和Rab11的GFP和HA标签质粒由美国爱荷华大学Dr.Engelhardt实验室馈赠。HA单克隆抗体购自罗氏公司。FITC-Dextran购于Invitrogen公司。60%碘克沙醇储存原液和Dynabeads分别为Invitrogen和挪威Nycomed公司产品。RAB7的小干扰RNA(sc29460)由美国Santa Cruz公司提供。其他化学试剂如未经特殊说明均购自美国Sigma-Aldrich公司。
1.2 腺相关病毒的荧光标记与共聚焦显微成像
将总量为1×1 011颗粒的纯化腺相关病毒AV2.luc解冻后重悬于0.5 mL PBS,并与新鲜配制的等体积含有适量AF568荧光染料的100 mmol/L NaHCO3(pH 9.3)混合,室温孵育30 min,其间每10 min充分混匀1次,以10 mmol/L Tris-Cl(pH 8.0)终止反应。标记后的病毒通过分子筛柱层析去除过量染料,用超滤离心管浓缩后,通过qPCR进行滴度测定,分装备用。
IB3细胞被接种到0.13 mm盖玻片上,待生长至50%汇合,用Lipofectamine 2000将GFP-Rab7或GFPRab11质粒转染至IB3细胞,24 h后将细胞进行10 min 4℃预冷,与约10 000病毒颗粒/细胞的AF568-AV2.luc在4℃下孵育20 min,随后移至37℃ 培养2 h。感染后,细胞用冰预冷的PBS漂洗4次,经4%多聚甲醛固定,以DAPI复染细胞核,使用Leica共聚焦显微镜进行观察和成像。
1.3 密度梯度离心和免疫亲和沉淀法分离含有感染后病毒颗粒的细胞内体
将IB3细胞接种于100 mm的培养皿中,在37℃和5%CO2条件下培养至细胞70%汇合。用经典的磷酸钙转染方法导入HA-RAB7或用于其他对照组实验的过表达质粒,继续培养24 h后。在4℃下将感染复数m.o.i(multiplicity of infection)为10 000 病毒/细胞的AV2.luc病毒与细胞孵育30 min后,转入37℃继续培养2 h。感染后的细胞短暂胰酶消化收集后,用冰预冷的匀浆缓冲液(250 mmol/L蔗糖,10 mmol/L三乙醇胺,EDTA和PMSF各1 mmol/L)重悬,在冰上研磨。通过相差显微镜观察去核的细胞比例达60%~80%时,800 g低速条件下离心10 min,得到PNS(perinuclear supernatant)上清。将1.5 mL的PNS混合碘克沙醇调整到32%的终浓度并加载到SW55Ti离心管底部,依次覆盖24%的碘克沙醇1.5 mL和20%碘克沙醇1.5 mL,最后充满匀浆缓冲液。经过4℃,124 000 g离心1 h,从离心管顶部依次收集11个组分,每份收集物约为0.5 mL。将第2~4组分合并,与预先包被 HA抗体和经过1%BSA封闭的Dynabeads磁珠混合,室温震荡孵育4~6 h,以磁铁吸附固定磁珠,收集上清并标记为unbound;磁珠经PBS漂洗2次后,用1.5 mol/L NaCl洗脱,标记为 bound,其中的回收病毒经Taqman定量PCR测定滴度后,作相应的稀释,可用于二次感染实验。
1.4 Taqman定量PCR方法进行腺相关病毒的滴度测定
含有AV2.luc的细胞内体用不含核酸酶的蛋白激酶K经55℃消化过夜,然后煮沸10 min终止反应。TaqMan qPCR的引物和探针由Primer Express V1.5软件设计,针对荧光素酶编码区引物和探针序列分别为 P1:5'-TTTTTG AAGCGA AGGTTG TGG-3',P2:5'-CACACA CAGTTC GCCTCT TTG-3';probe:5'-ATCTGG ATACCG GGAAAA CGCTGG GCGTTA AT-3',其中5'和3'末端分别带有6羧基荧光素(FAM)和6羧基四甲基荧光红(TAMRA)标记。体积为25 μL的PCR反应体系组成为:待测样本或AV2.luc标准稀释样品 10 μL;引物和探针共 2.5 μL,终浓度分别为500和100 nmol/L;通用型PCR Master Mix(ABI公司)12.5 μL。定量检测由 ABI-7700设备完成,PCR反应条件为:95℃预变性10 min后开始双步法扩增(95℃ 15 s、60℃ 60 s),共40个循环。
1.5 荧光素酶活性测定
IB3细胞以40%~50%的汇合密度接种于48孔板中,在含10%FBS的DMEM中培养24 h后,回收的AV2.luc以500病毒颗粒/细胞的剂量感染48 h后,用裂解液溶解,根据Promega公司试剂盒推荐实验条件,使用Lumat 9500B仪器进行荧光酶的活性测定。
接种于24孔培养板的IB3细胞分别进行不同的质粒或小RNA转染24 h后,或经过10 μmol/L BFA处理12 h后,以1 000病毒颗粒/细胞的AV2.luc感染细胞48 h后,依照同样的方法,测定荧光素酶的活性。
2 结果
本研究首先利用荧光标记技术通过形态学分析发现了RAB7与AAV2在IB3细胞中显著的共定位现象,继而建立了用于回收感染后经过细胞转运进入RAB7囊泡中AAV2的分离和纯化方法。通过将回收的病毒用于对细胞的二次感染实验,发现其转导IB3细胞的活性发生了改变。最后,通过RNA干扰和化学药物处理的手段改变RAB7介导的内体分选途径,验证了RAB7所参与的晚期内体成熟过程在腺相关病毒的细胞内转运和转导激活步骤中发挥了重要的作用。上述结果,分别由如下图1至图4顺序显示。
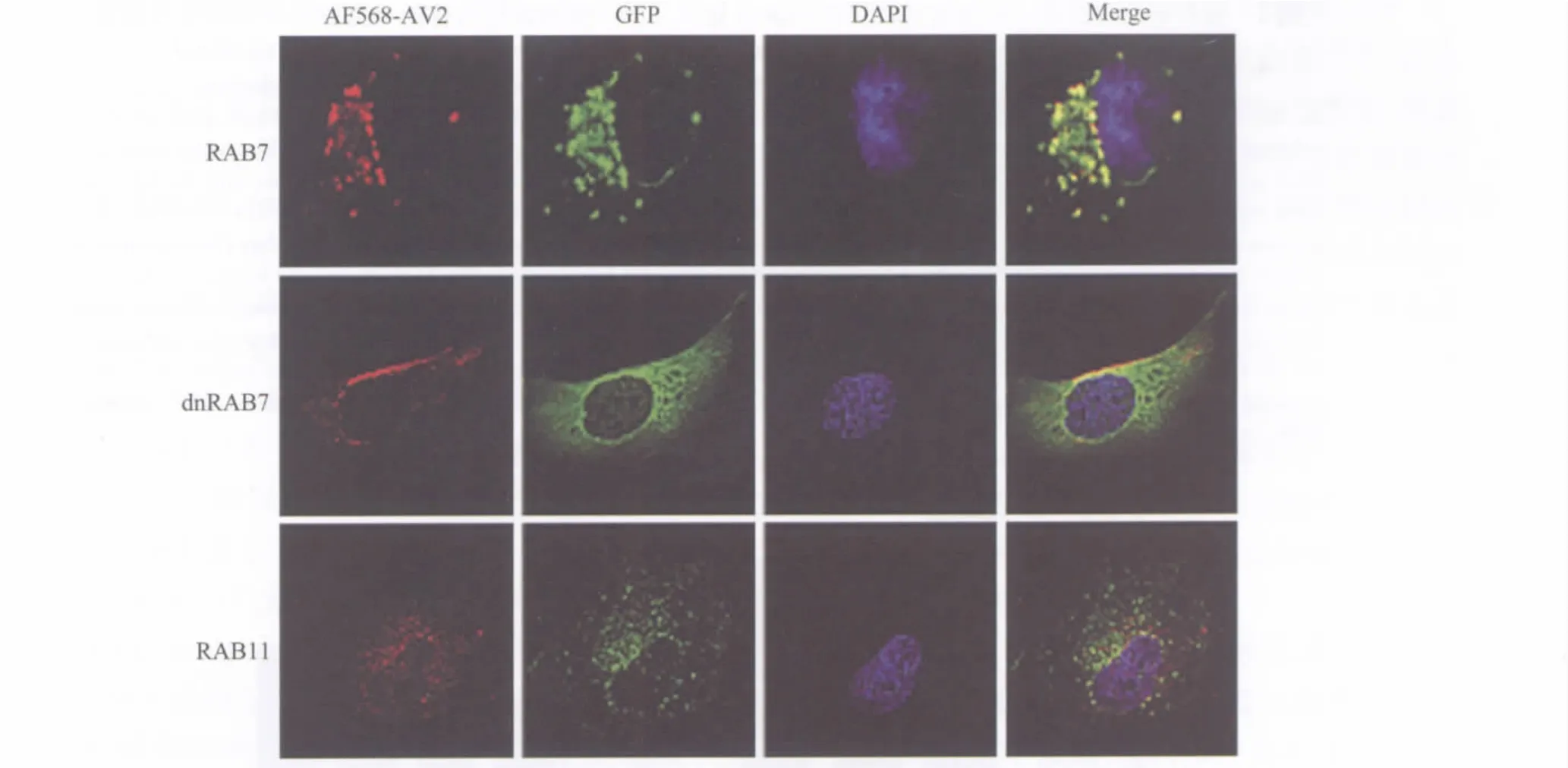
图1 AlexaFluor568标记的Ⅱ型腺相关病毒与细胞内GFP-RAB蛋白在IB3细胞内的共定位分析Fig.1 The intracellular localization of AlexFluor568-labeled adeno-associated virus in IB3 cells transfected with GFP-RAB fusion proteins
3 讨论
病毒的荧光标记技术为以细胞影像学手段研究感染动力学提供了极大的方便,并且在腺相关病毒的研究中有过一些尝试[11-12]。随着激光共聚焦技术的发展,为进一步认识AAV在细胞内亚细胞结构中的分布和定位提供了可能。
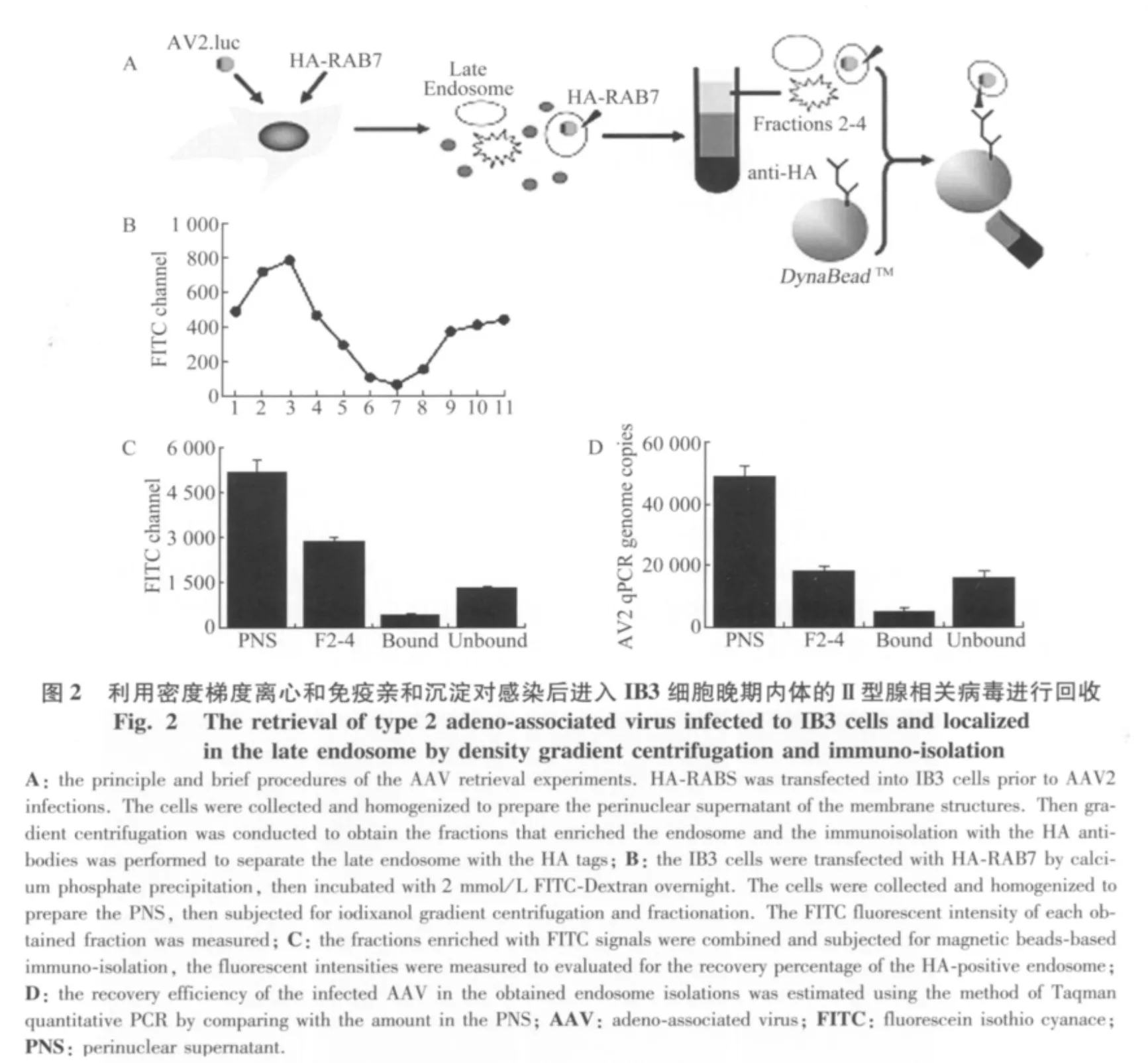
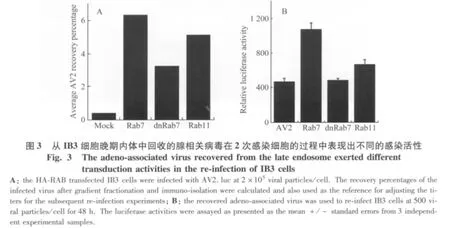
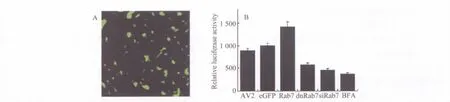
图4 对晚期内体成熟过程的干扰降低Ⅱ型腺相关病毒转导在IB3细胞中的转导活性Fig.4 The interference of the maturation of the late endosome impaired the transduction activation of adeno-associated virus in IB3 cells
RAB家族成员是一类与Ras具有较高同源性的小相对分子质量GTP酶,其种类繁多且在进化中有较高的保守性,目前在哺乳动物细胞中已发现多达70余种。RAB在细胞的内吞、分泌、囊泡的成熟、融合和运输等一系列细胞内转运过程中发挥着极为重要的作用,不同类型的囊泡表面通常会携带不同种类的RAB蛋白及其效应分子,其相对的特异性分布被形象地称为是细胞内膜和囊泡系统的“邮政编码(zip code)”[13-14]。各种 RAB在 N端的 GFP融合蛋白均基本保留了野生型RAB蛋白的正常活性,因而成为细胞生物学研究中的重要工具。针对RAB蛋白在结合GTP的模序部分而设计的突变体,使其失去水解GTP成为GDP的酶学活性,可以产生相应RAB的显性抑制变异体形式(dominant-negative variant),其在细胞内的过表达可以用来对相应野生型RAB的正常功能进行逆向分析和验证。此外,针对不同RAB的RNA干扰技术和一些影响细胞转运系统的药物处理也是研究RAB功能的有效手段[3]。如:布雷菲德菌素(Brefeldin A,BFA)是一种真菌代谢产物,常被用作细胞内蛋白转运的抑制剂。BFA能够可逆性地阻断蛋白质在内质网和高尔基体的运送,可以通过抑制一些GTP水解酶的GTP交换因子,从而影响细胞内膜形成转运囊泡(transport vesicles)。许多实验[6]证据表明,经过BFA处理后的细胞其内体的成熟过程受到严重的干扰和影响较高相对分子质量的葡聚糖Dextran在晚期内体中可以有较强的富集现象,而FITC等荧光标记的Dextran可以作为“负荷物(cargo)”用于晚期内体的加载(loading)或示踪(tracing)实验。本研究首先通过共聚焦显微成像分析确认了AAV2在RAB7阳性的囊泡中有比较广泛的分布,这与以其他细胞模型的部分早期报道[5-6]一致。并且本研究的结果提示,在IB3细胞中RAB7与标记病毒的共定位程度大大高于RAB11的情况,RAB7的过表达或显性抑制均可能对AAV在感染后细胞内的分布产生较大的影响。
包括腺相关病毒在内的细小病毒家族成员在转导活化的过程中很大程度上依赖于宿主细胞的受体依赖性内吞途径,尽管一系列的研究证据,如温度、ATP、Dynamin和细胞骨架系统对病毒转导的影响等[15-16],以及包括免疫电镜图像数据,均比较支持类似的推论,但是利用生化分离技术回收感染后的病毒颗粒并且重新评价其感染活力的尝试由于具有相当的挑战性而比较缺乏[17]。本研究首先利用了具有高度特异性和亲和力的HA生化标签,通过转染HA-RAB过表达功能性融合蛋白,优化了针对晚期内体的病毒回收和分离技术,获得了比较稳定可靠的结果。随后将回收的病毒用于2次感染实验,发现在RAB7阳性晚期内体中的AAV具有较高的感染活力。在进一步的验证性实验中发现,干扰RAB7参与的晚期内体成熟过程,可以导致AAV2对IB3细胞转导活性的降低。
虽然AAV能够以完整的病毒颗粒形式进入宿主细胞核中,但也有研究[2-3,18]表明病毒在胞质中的结构改变、衣壳蛋白化学修饰、从内体中的逃逸,甚至彻底的脱衣壳过程,同样对病毒的激活至关重要。也有报道[19-20]认为,晚期内体的弱酸性环境,有利于暴露AAV衣壳蛋白中的保守性磷脂酶A活性片段,从而帮助病毒脱离内体的包被,加速细胞核转运和脱衣壳过程。本研究的结果大体与类似的假说推论相符合,但是回收病毒在2次感染中的活性增加程度相对有限,表明晚期内体所造成的病毒性质改变未必非常显著,并且有可能存在较大的异质性。此外,从本研究的结果中并不能推测回收病毒所具有的不同转导活性究竟是由于衣壳蛋白的器质性改变,还是由于回收病毒中复合了细胞膜、受体分子或其他有助于病毒感染的成分。尽管如此,本研究对于分别从RAB7和RAB11囊泡分离的AAV在感染活性上存在差异的结果,为此前类似的发现和报道提供了更为直接的证据[5-7]。只是2者在程度上的差别可能与感染的滴度或细胞类型的不同有关[5]。
关注AAV在细胞内的转运过程及其调节因素不仅可以加深和丰富对基因工程病毒载体的认识,推动其感染动力学的基础研究,为载体的进一步改良提供线索[21],并且很可能在AAV的临床应用中有着更加现实的意义,成为优化病毒使用适应证和方案的考虑因素之一。
[1]Mitchell A M,Nicolson S C,Warischalk J K,et al.AAV's anatomy:roadmap for optimizing vectors for translational success[J].Curr Gene Ther,2010,10(5):319-340.
[2]Johnson J S,Samulski R J.Enhancement of adeno-associated virus infection by mobilizing capsids into and out of the nucleolus[J].J Virol,2009,83(6):2632-2644.
[3]Ding W,Zhang L,Yan Z,et al.Intracellular trafficking of adeno-associated viral vectors[J].Gene Ther,2005,12(11):873-880.
[4]Sanlioglu S,Monick M M,Luleci G,et al.Rate limiting steps of AAV transduction and implications for human gene therapy[J].Curr Gene Ther,2001,1(2):137-147.
[5]Ding W,Zhang L N,Yeaman C,et al.rAAV2 traffics through both the late and the recycling endosomes in a dosedependent fashion[J].Mol Ther,2006,13(4):671-682.
[6]Douar A M,Poulard K,Stockholm D,et al.Intracellular trafficking of adeno-associated virus vectors:routing to the late endosomal compartment and proteasome degradation[J].J Virol,2001,75(4):1824-1833.
[7]Duan D,Yue Y,Yan Z,et al.Endosomal processing limits gene transfer to polarized airway epithelia by adeno-associated virus[J].J Clin Invest,2000,105(11):1573-1587.
[8]Zhang M,Chen L,Wang S,et al.Rab7:roles in membrane trafficking and disease[J].Biosci Rep,2009,29(3):193-209.
[9]Hsu V W,Prekeris R.Transport at the recycling endosome[J].Curr Opin Cell Biol,2010,22(4):528-534.
[10]Yan Z,Zak R,Zhang Y,et al.Distinct classes of protea-some-modulating agents cooperatively augment recombinant adeno-associated virus type 2 and type 5-mediated transduction from the apical surfaces of human airway epithelia[J].J Virol,2004,78(6):2863-2874.
[11]Seisenberger G,Ried M U,Endress T,et al.Real-time single-molecule imaging of the infection pathway of an adeno-associated virus[J].Science,2001,294(5548):1929-1932.
[12]Bartlett J S,Wilcher R,Samulski R J.Infectious entry pathway of adeno-associated virus and adeno-associated virus vectors[J].J Virol,2000,74(6):2777-2785.
[13]Brighouse A,Dacks J B,Field M C.Rab protein evolution and the history of the eukaryotic endomembrane system[J].Cell Mol Life Sci,2010,67(20):3449-3465.
[14]Stenmark H.Rab GTPases as coordinators of vesicle traffic[J].Nat Rev Mol Cell Biol,2009,10(8):513-525.
[15]Hansen J,Qing K,Srivastava A.Adeno-associated virus type 2-mediated gene transfer:altered endocytic processing enhances transduction efficiency in murine fibroblasts[J].J Virol,2001,75(9):4080-4090.
[16]Duan D,Li Q,Kao A W,et al.Dynamin is required for recombinant adeno-associated virus type 2 infection[J].J Virol,1999,73(12):10371-10376.
[17]Hansen J,Qing K,Srivastava A.Infection of purified nuclei by adeno-associated virus 2[J].Mol Ther,2001,4(4):289-296.
[18]Hirosue S,Senn K,Clement N,et al.Effect of inhibition of dynein function and microtubule-altering drugs on AAV2 transduction[J].Virology,2007,367(1):10-18.
[19]Grieger J C,Johnson J S,Gurda-Whitaker B,et al.Surface-exposed adeno-associated virus Vp1-NLS capsid fusion protein rescues infectivity of noninfectious wild-type Vp2/Vp3 and Vp3-only capsids but not that of fivefold pore mutant virions[J].J Virol,2007,81(15):7833-7843.
[20]Girod A,Wobus C E,Zadori Z,et al.The VP1 capsid protein of adeno-associated virus type 2 is carrying a phospholipase A2 domain required for virus infectivity[J].J Gen Virol,2002,83(Pt 5):973-978.
[21]Chung C Y,Koprich J B,Hallett P J,et al.Functional enhancement and protection of dopaminergic terminals by RAB3B overexpression[J].Proc Natl Acad Sci U S A,2009,106(52):22474-22479.
