从钼酸盐溶液中分离微量钨的机理研究
2011-04-27肖连生曹佐英
肖 超,肖连生,曹佐英
(中南大学冶金科学与工程学院,湖南长沙 410083)
0 概述
钨钼是极为重要的战略有色金属,常常共生于矿物中,由于钨钼的性质极为相似,所以钨钼分离一直是分离科学领域的难题。目前从钨酸盐中除钼较为成熟,而且在工业中广为应用的方法还是利用钼容易硫代化形成硫代钼酸根,而钨依然以钨酸根形式存在,扩大钨钼性质差异,然后采用萃取、离子交换或者选择沉淀等方法除钼。从钼酸盐中分离微量钨同样是钼冶金中的难题,却没有成熟的分离理论和工艺。据报导从钼酸盐中分离钨方法有:萃取法[1]、沉淀吸附法[2]、离子交换法[3]等。比较上述方法,沉淀吸附法是目前报导较多的方法,但是其操作麻烦、需要控制条件较多、钼钨分离系数不是很大、除钨过程钼的损失比较大;溶剂萃取或者离子交换法都能够深度除钨,但是离子交换法在钼钨分离深度、环境友好程度均优于溶剂萃取法。就目前钼中除钨技术在工业中的应用看,离子交换法应该会成为主流工艺。
目前从钼酸盐溶液中除钨,主要原理是利用钨、钼同多酸形成条件的差异。但是,却鲜有文献从热力学方面对其分离理论进行研究。为了深入理解钼中除钨原理,更好地开发钼中除钨技术,本文通过热力学分析,在特定 pH值段绘制了W-H2O系和Mo -H2O系的 CX/C0-pH图,建立了钨钼分离的理论,同时通过试验,验证该理论的合理性。
1 钨钼溶液热力学分析
1.1 W-H2O系的热力学分析
钨的离子形态极为复杂,对其研究目前还没有一个定论,大体来说,在溶液 pH>9左右,钨以WO24-存在,随着溶液 pH值的减低钨离子逐渐酸化、聚合,依次形成不同聚合度的多聚钨酸根离子[4]。由于钨聚合阴离子的形态还没有研究透彻,其对应的热力学数据更是缺乏或者不准确。本文主要研究的是钨、钼同多酸聚合能力的差异,所有着重考察聚合为同多酸的过程。本文查阅总钨浓度为 0.005 mol/L(即WO3为 1.15 g/L)时,聚合的反应,对应的热力学数据[5]见表 1。
表 1 聚合平衡式及平衡常数 (25℃)

表 1 聚合平衡式及平衡常数 (25℃)
序号 反应平衡 平衡常数pK 1 12WO2-4 +14H+=H2W12O10-42 +6H2O 111.5 2 6WO2-4 +6H+=H2W6O6-22+2H2O 48.4 3 7WO2-4 +9H+=HW7O-24+4H2O 71.24 4 WO2-4+H+=HWO-4 3.62 5 WO2-4 +8H+=W7O6-24+4H2O 65.19 6 WO2-4 +2H+=WO3(H2O)(aq) 8.7
据已有的文献[5]可知:当溶液 pH>9.0时,钨主要以存在;当溶液 pH<5.5时,基本转化为聚钨酸根离子。所以,在此我们考察溶液 pH于 10~5.5范围钨的离子形态。根据表 1提供的热力学平衡关系可知,进行热力学计算,由于溶液钨离子浓度低,所以采用浓度代替活度。由热力学理论,可得出以下数学关系式:
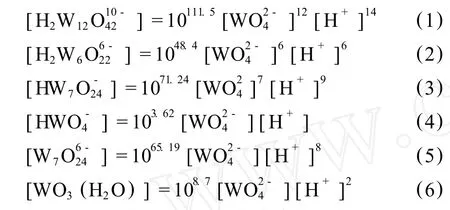
由以上化学方程式可知溶液中总钨浓度:
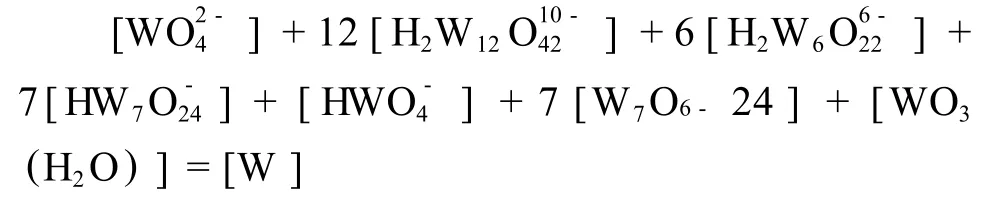
当溶液总钨浓度[W]=0.005 mol/L,根据以上数据求得溶液 pH值范围为 10~5.5时,钨离子存在形态与溶液 pH值的关系,如图 1所示。
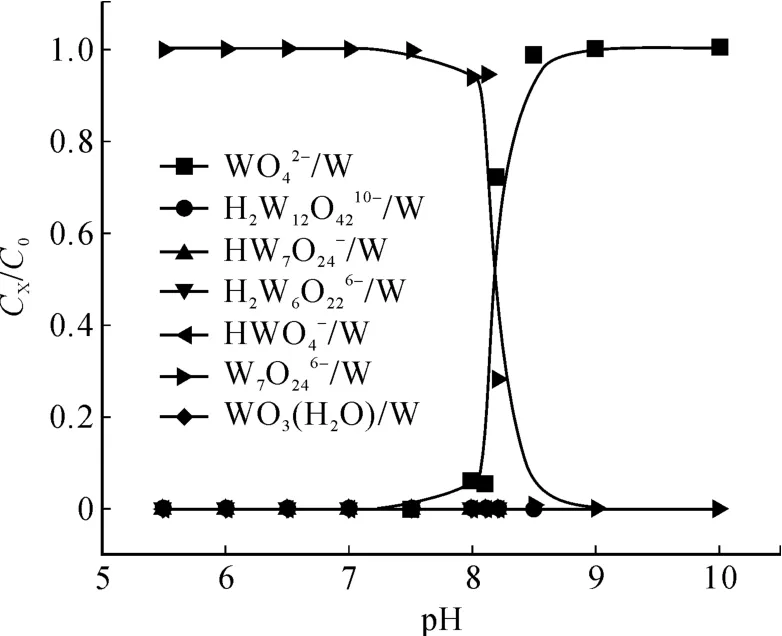
图1 0.005 mol/L钨的 CX/C0-pH曲线
1.2 Mo-H2O系的热力学分析
钼在溶液中的热力学情况同样复杂[7],当溶液的 pH>9时,钼在溶液中以存在,当pH<6时,钼基本上以聚离子存在,所以考察钼于 pH为 10~5.5时,钼离子存在的形式。本文查阅总钼浓度为 2 mol/L(即Mo为 192 g/L)时聚合的反应,对应的热力学数据[8]见表 2。
由表 2提供的热力学平衡关系可知,进行热力学计算,由于溶液钼离子活度系数没有详细的数据,所以采用浓度代替活度。由热力学理论,可得出以下数学关系式:
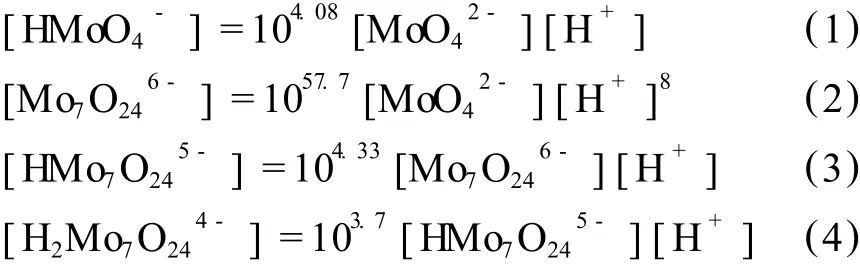
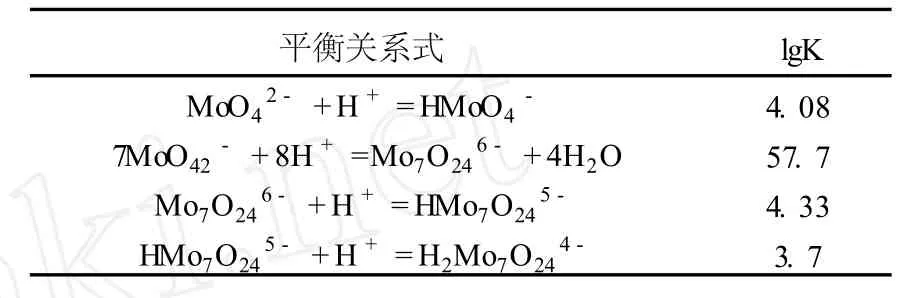
表 2 MoO2-4聚合平衡式与对应的平衡常数 (25℃)
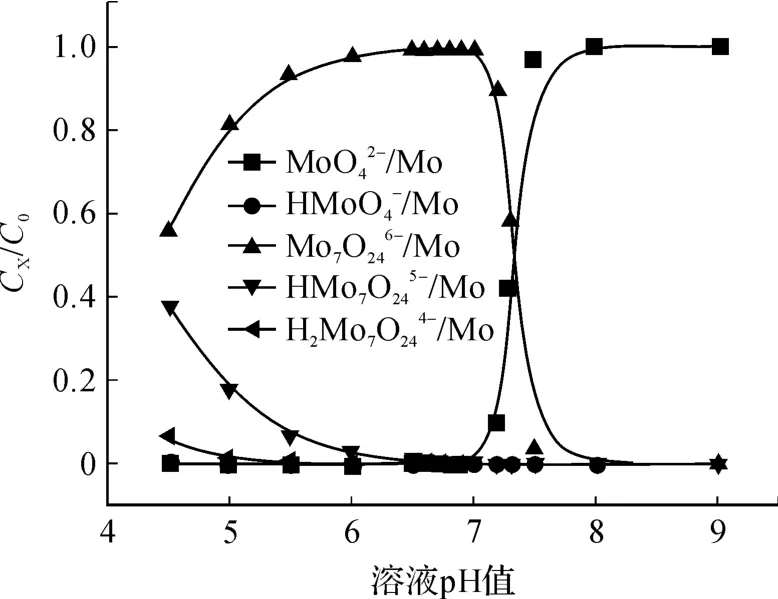
图2 2 mo l/L钼的 CX/C0-pH图
2 钨钼分离原理
2.1 钨钼离子存在形态
由钨的热力学计算可知:当溶液中总钨浓度为0.005 mol/L时,在 pH为 8.5时W开始聚合;在pH值为 8.0时 90%的W聚合为 W7O246-。由钼的热力学分析可以得出:当溶液中总钼浓度为2 mol/L时,于 pH为 8.0时开始聚合,pH为7.0时,90%的聚合为。如果将含钨、钼溶液的 pH值从碱性向酸性调整时,显然钨首先聚合为,而钼在 pH为 7.5之前主要仍以存在。
2.2 典型体系钨钼分离机理
以工业中常见的钼酸盐溶液中除钨体系为参照,设定溶液中钼为2 mol/L,钨为0.005 mol/L,钨、钼存在形态分别以为研究对象,研究该体系钼中除钨的机理。
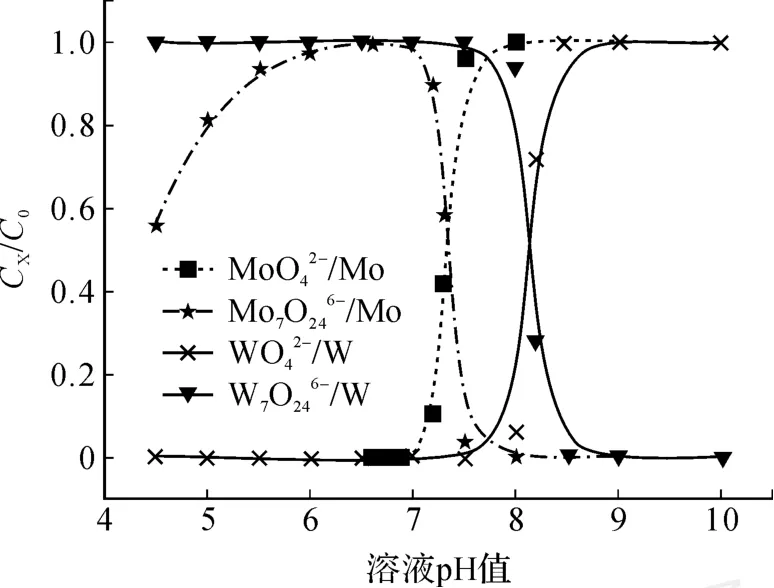
图 3 钼酸盐中分离钨原理
3 离子交换法从钼酸盐中吸附钨
试验采用工业含钨钼酸铵溶液为除钨试验对象,每次取某碱性树脂 15 mL,加入 80 mL调好 pH值的含钨钼酸铵溶液,静态吸附 2 h,试验结果见表 3。
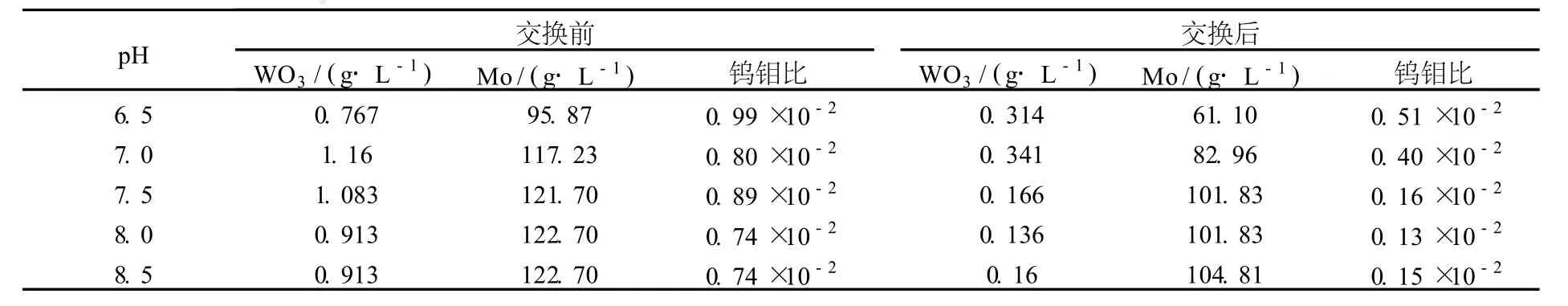
表 3 某碱性树脂静态交换试验结果
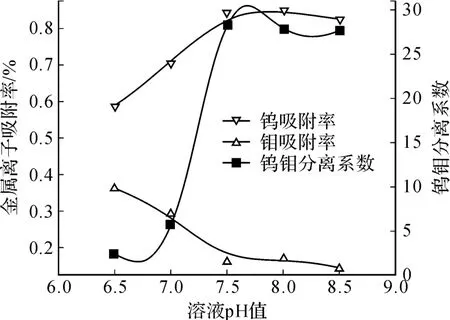
图 4 溶液 pH值对钼酸盐中除钨的影响
试验结果表明,钨在 pH值于 7.5~8.0吸附率最高,当溶液 pH>8.0时,部分钨开始以WO42-存在;当溶液 pH<7.5时,钼开始以存在,由于溶液中钼的浓度远高于钨,所以 pH<7.5时钨钼聚阴离子发生竞争吸附,钨的吸附率也开始快速降低;钼随着溶液 pH值的增大,吸附率减低,该规律与钼离子形态变化规律一致;且当溶液 pH>7.5时,钼的吸附率基本保持不变,因为此时溶液中的钼绝大部分以存在,且不再随着溶液 pH值的增大而改变;在溶液 pH值为 7.5~8.0之间,钨钼分离系数达到最大值,与之前热力学理论分析得出结论一致。
4 结论
(2)钼在 pH>7.5时主要以MoO42-存在,钼于pH为 7.0时绝大多数聚合为Mo7O246-。
(3)通过热力学分析,可以利用钨钼同多酸聚合条件差异进行钨钼分离,其中,采用离子交换法分离钨钼的机理为:6RCl+⇋R6W7O24+6Cl-和 3R2MoO4⇋R6W7O24+。
(4)最佳的分离 pH值点为 7.5,工业生产可以取 pH范围为 7.5~8.0,理论与试验结果相符合。
[1] Peng-ge Ning,Hong-bin Cao,Yi Zhang.Selective extraction and deep removal of tungsten from sodium molybdate solution by primary amine N1923[J].Separation and Purification Technology,2009,70:27-33.
[2] 吕莹,孙放.Fe(OH)3吸附法从高钨钼酸钠溶液中分离钨钼的研究 [J].稀有金属与硬质合金,2005,3:1-3.
[3] 肖连生,龚柏藩.一种从高浓度钼酸盐溶液中深度净化除去微量钨的方法:中国.CN101264933[P].2008 -9-17.
[4] John W.van Put.Crystallisation and processing of ammonium paratungstate(APT)[J].Refractory Metals &HardMaterial,1995,13(6):1-76.
[5] A.Koutsospyros,W.Braida,C.Christodoulatos,D. Der matas,N.Strigul.A review of tungsten:from environmental obscurity to scrutiny[J].Journal of Hazardous Materials.20 06,136:1-19.
[6] 陆淑引(译).离子平衡及其数学处理[M].天津:南开大学出版社,1989:378-381.
