钼精矿氧化焙烧机理研究
2011-04-27王连勇张井凡蔡九菊孙华成
王连勇,张井凡,蔡九菊,孙华成,刘 勇
(1.东北大学国家环境保护生态工业重点实验室,辽宁沈阳 110004) (2.深圳市盛鑫源环保科技技术有限公司,广东深圳 518000)
目前,国内外应用的所有硫化钼精矿约有 96%首先要通过焙烧转化成工业氧化钼,才能进一步提取可溶性钼盐,进而冶炼成为钼金属或其合金,且大部分用于钢铁冶金。钼精矿的焙烧是氧化焙烧,是显著的放热反应过程,完全可以自热完成,焙烧过程不需要消耗热能。但焙烧钼精矿的生产过程中,无论是早期简易的反射炉焙烧、还是目前广泛应用的回转窑焙烧、多膛炉焙烧、甚至包括未实现工业应用的闪速炉焙烧及添加助剂焙烧等都需要采用外热源提供焙烧热量以保证反应的顺利进行。焙烧热量一般由煤、油、各种煤气、天然气、电等外热源提供[1~5]。可见,现有实际生产中的钼精矿焙烧工艺未能合理应用钼精矿焙烧反应放出的大量热量,相关设计者和生产者对钼精矿氧化焙烧机理理解不甚透彻。因此,有必要深入研究钼精矿氧化焙烧机理。
热分析动力学是应用热分析技术研究物质的物理变化或化学反应机理的一种方法。由于测定可在等温或变温(通常是线性升温)条件下进行,故它被认为具有快速、简便、样品用量少等优点[6]。因此,笔者将热分析动力学研究方法用在钼精矿氧化焙烧过程中,旨在了解钼精矿的氧化焙烧机理,为钼精矿氧化焙烧设备的优化设计及数值模拟提供理论依据。
1 实验
1.1 实验仪器及原料
实验采用的热重分析仪是由德国耐驰公司生产的 409PC热重分析仪,试样选用河南栾川品位为45%的钼精矿。
1.2 实验条件
样品用量 10 mg;样品粒度≤80目;实验气氛:氧气浓度 10%,20%,30%;升温速率 10,20, 30 K/min;升温范围 20~650℃。
2 实验结果与分析
2.1 典型工况与分析
通过实验发现,在不同的氧气浓度、粒度、升温速率条件下,钼精矿的失重曲线和热差示扫描曲线表现出相似的变化规律,图 1是在升温速率为10 K/min,氧气浓度为20%条件下的钼精矿 TG、DSC曲线。
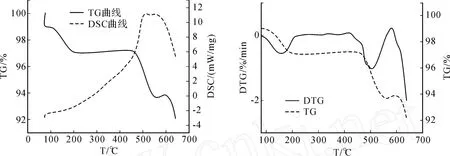
图 1 钼精矿氧化焙烧的 TG/DSC曲线和失重微分(DTG)曲线
由图 1可以看出,钼精矿氧化成MoO3的过程大致分为 4个阶段进行:
第1阶段,钼精矿预热干燥,此阶段温度段为20~200℃,钼精矿中的水分和浮选油挥发掉,此阶段需要吸收热量。
第2阶段,空气中的氧分子向钼精矿颗粒的表面扩散,供给钼精矿氧化时所需要的氧,同时,辉钼精矿在表面原子力的作用下,对空气中的氧产生吸附,扩散和吸附的速度取决于空气的流速和温度等。
第3阶段,吸附的氧与MoS2发生反应,主要生成物为MoO2,这一阶段温度范围是 400~550℃,此过程放出大量热量,占到反应总放热的 85%以上,反应方程式为MoS2+3O2→MoO2+2SO2。
第4阶段,生成的MoO2继续与氧发生反应生成MoO3,钼精矿中的其他硫化物杂质与氧发生反应生成氧化物和部分硫酸盐,同时也有相当一部分硫酸盐发生离解。这一阶段主要发生的反应为:
2MoO2+O2→2MoO3。
上述4个阶段为钼精矿氧化反应的全过程,它是连续发生的,是不可分割的。它的速度要受到氧的浓度、气流速度、温度等因素的影响。
2.2 氧气浓度的影响
升温速率控制在 10 k/min,样品粒度≤80目,研究氧气浓度对焙烧反应的影响,结果如图 2所示。
从图 2中可以看出,在 3种气氛下曲线形状大致相似,稍微的差别在于曲线斜率有点不同。随着氧气浓度的增加,参与反应的物料量增加,有利于生钼精矿的氧化焙烧。至反应结束时,浓度为 30%氧气氛围下反应转化率最高,反应进行最为彻底。
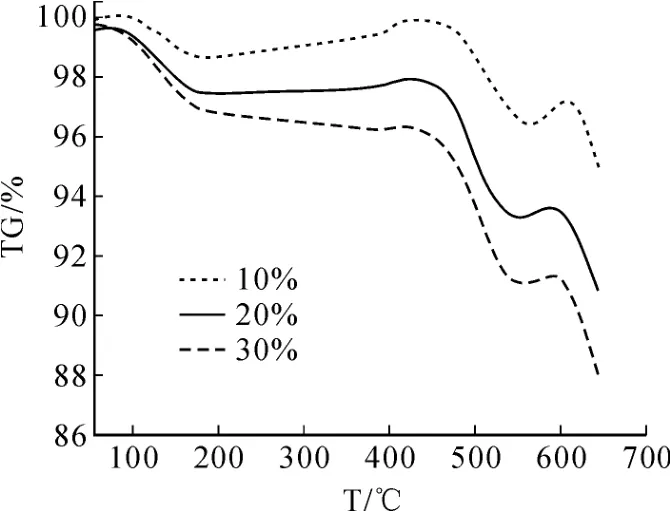
图2 不同氧气浓度下钼精矿的 TG曲线
2.3 升温速率的影响
氧气浓度控制在 20%,样品粒度≤80目,研究升温速率对焙烧反应的影响,结果如图 3所示。
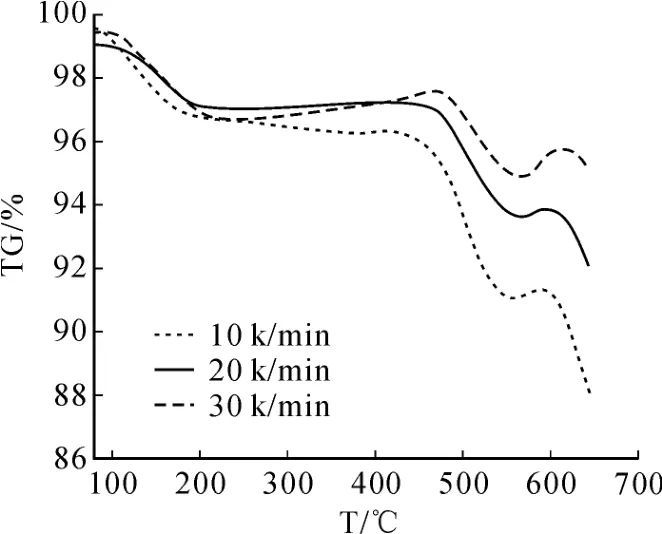
图3 不同升温速率下钼精矿的 TG曲线
由图 3可见,TG曲线峰顶温度和最大反应速率不随着升温速率增加而变化,升温速率不影响反应着火点,400℃左右时钼精矿氧化反应开始,550℃左右时主要的化学反应为 MoO2氧化生成MoO3。随着升温速率增加,钼精矿反应转化率降低。
3 反应动力学基本原理与计算方法
通常,在动力学求解过程中往往会遇到以下2个问题:(1)在实验升温过程中,由于样品内部发生热传导,导致颗粒内部产生温度梯度,这说明样品在测量过程中并非处于热平衡状态下,如果将加热速率外推为零,计算出此时反应的有关参数即可视为反应体系处于热平衡状态下的行为。(2)一个样品在不同转化率条件下,其动力学参数往往呈现规律性的变化,如果获得转化率为零时的有关参数,则可认为它是体系处于原始状态时的参数。
3.1 Coats-Redfern积分法[7]
由非等温动力学基本方程积分处理得
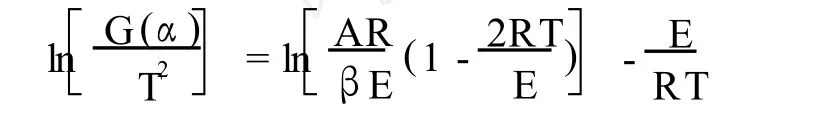
式中:G(α)为反应机理函数;A为指前因子;β为升温速率;E为活化能;R为气体常数;α为转化率。
将升温机理函数代入上式,并进行线性拟合,根据拟合曲线的斜率和截距可以计算动力学参数。并运用外推法将升温速率外推为零,计算此时的动力学参数将会极大减小反应条件的影响,使计算值趋于真实值。外推公式为:
E=a2+b2α+c2α2+d2α3…(Eα→0=a2)
3.2 Flynn-W all-O zawa积分法[8]
Flynn-Wall-Ozawa法是一种近似积分法,其方程为:
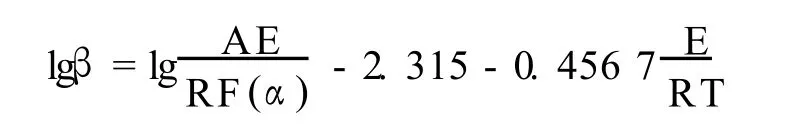
此方法的优点是避免假设机理函数所带来的误差。由拟合直线的斜率可以直接求解不同转化率条件下的活化能值。将转化率外推为零,即可计算出理想热平衡状态下的活化能值。外推公式为:
E=a1+b1β+c1β2+d1β3…(Eβ→0=a1)
将 2种方法外推得出的活化能值进行比较,数值相近者所代表的机理函数即为最概然机理函数。
3.3 反应动力学模型
将钼精矿焙烧反应两阶段看成是由 2个独立的过程,将在 2个温度区间内发生的重量变化过程,看成是 2种组分分别在这 2个温度区间内发生的独立的反应过程,以DTG曲线上峰值的初始和结束的温度点,确定反应的温度区间,主要研究这 2个主要失重过程的动力学性质。运用双外推法得出钼精矿两阶段焙烧的反应动力学模型为:
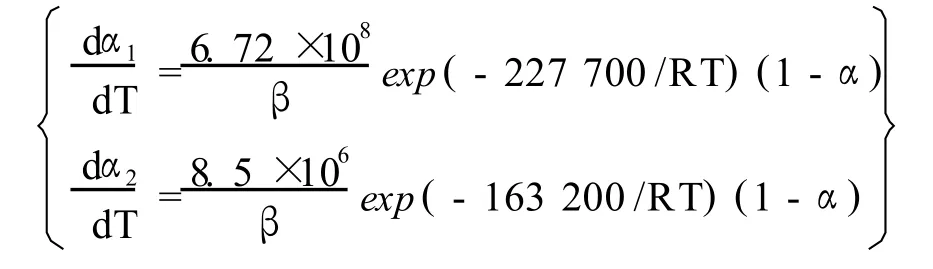
4 结论
(1)氧化焙烧过程是剧烈放热反应,且放出的热量主要集中在生成MoO2的过程中,生成MoO3的过程中放出热量很少,所以,为了维持整个焙烧系统的热工况稳定,焙烧工艺合理的用热制度应当是适当利用反应段 (生成MoO2)富余热量,补充后期脱硫(生成MoO3)所需热量。
(2)提高氧气浓度有利于钼精矿焙烧反应的进行,但氧气浓度不影响反应着火点,钼精矿在450℃左右时发生氧化反应生成 MoO2,550℃左右时MoO2又被氧化生成MoO3。
(3)升温速率变大同样会使钼精矿反应转化率降低,反应速率下降,但失重率峰值所对应的温度基本保持不变。
(4)钼精矿两阶段焙烧反应动力学模型为:
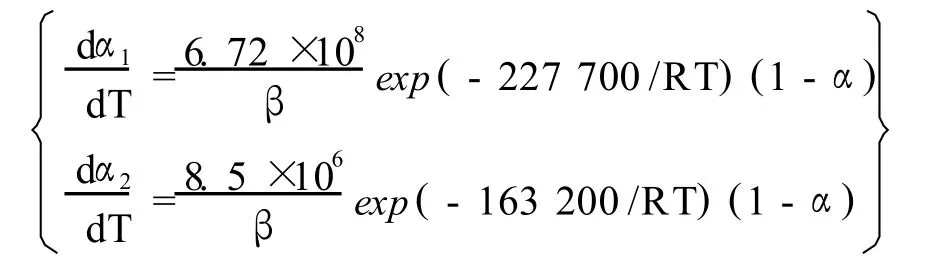
[1] 向铁根.钼冶金[M].长沙:中南大学出版社,2002:1-10.
[2] 稀有金属编辑委员会著.稀有金属手册 (下册)[M].北京:冶金工业出版社,1995:34-40.
[3] 徐润泽.粉末冶金结构材料学[M].长沙:中南工业大学出版社,1998:50-53.
[4] 张启修,赵秦生.钨钼冶金[M].北京:冶金工业出版社,2005:5-10.
[5] 黄海芳.钼精矿焙烧的污染浪费及对策[J].铁合金, 2002,1(1):33-37.
[6] 郭汉贤.应用化工动力学[M].北京:化学工业出版社2003:1-10.
[7] Cai J M,BiL S.Precision of the Coats and RedfernMethod for the Determination of the Activation Energy without Neglecting the Low-temperature End of the Temperature Intergral[J].Energy Fuels,2008,22(4):2172-2174.
[8] 郭汉贤.应用化工动力学[M].北京:化学工业出版社2003:253-261.
