冠心病患者血浆8-表氧-前列腺素F2α和胰岛素抵抗的变化及临床意义
2011-04-26黄宇理包宗明
黄宇理 ,包宗明
冠状动脉粥样硬化性心脏病(coronary heart disease,CHD,冠心病)是由多因素所致的一种常见心血管疾病。研究表明,氧化应激参与并促进动脉粥样硬化(atherosclerosis,AS)的发生发展,而8-表氧-前列腺素 F2α(8-iso-prostaglandin F2α,8-iso-PGF2α)是反映体内氧化损伤的理想标志物[1]。胰岛素抵抗(insulin resistance,IR)是冠心病发病的一个重要危险因素[2],其在冠心病病变发展及临床表现严重程度方面起到作用。本研究通过测定冠心病患者血浆8-iso-PGF2α水平,稳态模型胰岛素抵抗指数(HOMAIR),进一步探讨两者在CHD发生发展中的作用。
1 资料与方法
1.1 病例选择 选取2007年6月~2009年6月因胸闷、胸痛等症状在蚌埠医学院第一附属医院心血管科行冠状动脉(冠脉)造影检查确诊的CHD患者130例。根据美国心脏病学会(ACC)/美国心脏病协会(AHA)制定的诊断标准分为三组:稳定型心绞痛组(SAP组,n=43),男22例,女21例,年龄53~74(63.7 ±5.4)岁;不稳定型心绞痛组(UAP 组,n=41),男23例,女18例,年龄46~78(61.2±11.0)岁;急性心肌梗死组(AMI组,n=46),男26例,女20例,年龄45~81(65.7 ±11.4)岁,符合 AMI诊断标准[3]。对照组为疑似CHD的胸闷、胸痛患者,经冠脉造影排除CHD者(n=68),男26例,女42例,年龄45 ~79(62.7 ±9.3)岁。
1.2 冠脉造影结果分析及冠脉狭窄评分 依照ACC/AHA标准以左主干、左前降支、左回旋支及右冠脉中至少有一支血管狭窄程度>50%者可确诊冠心病,并分为单支、双支和三支冠脉病变,采用Gensini积分系统[4],对每支冠脉狭窄程度进行评分。
1.3 采用稳态模型方法评价胰岛素抵抗状况[5]稳态模型胰岛素抵抗指数(HOMA-IR)=空腹胰岛素(FINS)×空腹血糖(FPG)/22.5。
1.4 研究方法 所有研究对象均于入院后第2 d早8时空腹抽肘静脉血2管(一管为肝素钠管抗凝,一管为普通管),静置20 min,3000 r/min离心15 min,肝素钠管分离血浆分别测定血浆8-iso-PGF2α、FPG,其中FPG由全自动生化仪(日本奥林巴斯5400)测定;普通管分离血清测定FINS。人血浆8-iso-PGF2α试剂盒由武汉博士得生物工程有限公司提供;碘(125I)-胰岛素放射免疫分析药盒由天津市协和医药科技有限公司提供。
1.5 统计学处理 统计数据采用SPSS 11.0统计软件包分析完成,计量资料用均数±标准差(±s)表示,不符合正态分布者先作变量变换后,用(±s)表示,多组均数的比较采用单因素方差分析,组间均数比较采用q检验。计数资料用例数和百分数表示,组间比较采用χ2检验。8-iso-PGF2α与HOMA-IR关系采用 Pearson's或Spearman's相关性分析。以冠心病的是否发生为因变量,血浆8-iso-PGF2α、HOMA-IR为自变量,进行二分类Logistic回归分析。P<0.05为差异有显著性。
2 结果
2.1 各组一般临床资料对比检验 各组年龄、性别构成、高血压、糖尿病、高脂血症、吸烟例数比较均无统计学意义。

表1 各组一般临床资料比较[n(%)]
2.2 不同类型冠心病各组间血浆8-iso-PGF2α、HOMA-IR水平比较(表2)AMI组血浆8-iso-PGF2α、HOMA-IR水平明显高于UAP组、SAP组、对照组;UAP组高于SAP组、对照组;SAP组高于对照组(P均<0.05),各组间的差异有统计学意义。
2.3 冠心病患者冠脉不同狭窄程度血浆8-iso-PGF2α水平、HOMA-IR水平比较(表3) 冠脉单支、双支、三支病变患者血浆8-iso-PGF2α水平、HOMA-IR表达水平随冠脉病变狭窄程度加重而增高,各组间的差异均有统计学意义(P<0.05)。
2.4 血浆8-iso-PGF2α、HOMA-IR 与冠心病发病相关性分析(表4) 以血浆8-iso-PGF2α、HOMA-IR为自变量,以冠心病是否发生为因变量进行Logistic回归分析,结果表明血浆8-iso-PGF2α、HOMA-IR是冠心病的独立危险因子(P均<0.01)。
2.5 血浆8-iso-PGF2α与 HOMA-IR表达水平的相关性分析 血浆8-iso-PGF2α与HOMA-IR的表达水平呈正相关(r=0.896,P <0.05)。
3 讨论
表2 不同类型冠心病患者与对照组血浆8-iso-PGF2α、HOMA-IR比较(±s)

表2 不同类型冠心病患者与对照组血浆8-iso-PGF2α、HOMA-IR比较(±s)
注:与对照组比较,aP <0.05;与 SAP 组比较,bP <0.05;与 UAP 组比较,cP <0.05
检测指标 对照组(n=68) SAP组(n=43) UAP组(n=41) AMI组(n=46)8-iso-PGF2α(ng/ml) 7.25 ±6.41 25.16 ±18.78a 41.83 ±27.69ab 122.89 ±57.38abc FPG(mmol/L) 5.31 ±2.33 6.11 ±1.20 6.37 ±1.99 6.87 ±3.16 FINS(mIU/L) 7.55 ±4.40 9.60 ±3.89 14.08 ±9.46 16.85 ±10.08 HOMA-IR 1.78 ±1.13 2.61 ±1.07a 3.99 ±2.10ab 5.15 ±2.41abc

表3 冠心病患者不同病变支数血浆8-iso-PGF2α、HOMA-IR水平比较(x¯±s)
冠心病患者机体内存在氧化与抗氧化平衡失调,氧化应激不仅参与AS发生发展的各个阶段,而且对预后起主导作用[6]。血管壁内过多生成的氧自由基能使内皮下间隙的低密度脂蛋白(LDL)氧化修饰生成氧化低密度脂蛋白(ox-LDL),这是AS病理过程中最重要的早期事件。氧化应激通过促进炎症因子的表达造成细胞凋亡、血管新生和内皮损伤,从而影响斑块稳定性[7]。同时氧化应激导致大量自由基产生,生物膜的脂质过氧化[8]。8-iso-PGF2α是花生四烯酸另一代谢途径—氧自由基催化的脂质过氧化产物,不依赖环氧化酶和脂氧化酶,众多研究已证实这一代谢途径不受药物影响,也不受饮食中脂质成份影响[9],而只与氧自由基有关,因此认为8-iso-PGF2α是反映脂质过氧化的特异性和可靠指标[10]。使用ELISA法测定8-iso-PGF2α含量与使用气相色谱法测定结果有正相关性,且方法简便。8-iso-PGF2α不仅是一种强效的冠状动脉收缩剂,还可促进以胶原为基础的细胞外基质降解,导致纤维帽变薄和斑块破裂,从而造成动脉粥样硬化病变的不稳定。近来研究表明,冠心病各阶段均有8-iso-PGF2α大量生成,在病变斑块处有大量8-iso-PGF2α聚集,动脉硬化患者常伴内皮细胞功能受损,且这种受损出现在病变明显发生之前。这类患者血浆及尿中可检测8-iso-PGF2α明显升高[11],这种血管壁上的粥样硬化损伤是针对膜磷质氧化发生的特异炎症反应。
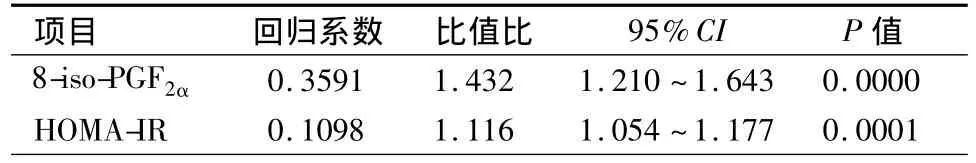
表4 冠心病发生Logistic回归分析
IR在冠心病发生发展及临床表现严重程度方面作用不可忽视,冠状动脉粥样硬化的发生与IR有关。本研究显示,冠心病患者血浆8-iso-PGF2α、HOMA-IR水平明显升高(P<0.05),差异有统计学意义;其中UAP组、AMI组两项指标水平高于SAP组(P<0.05)。进一步分析冠心病患者血浆8-iso-PGF2α、HOMA-IR水平与冠脉病变支数均存在关系,冠脉病变程度越重,上述指标水平越高。血浆8-iso-PGF2α、HOMA-IR水平的联合检测对初步判断冠脉病变严重程度有一定帮助。
本研究提示血浆8-iso-PGF2α与HOMA-IR与冠心病发病密切相关(P<0.05),Logistic分析显示了8-iso-PGF2α与HOMA-IR是冠心病患者的危险因素,二者可能参与冠脉斑块的形成与发展,并促进CHD的发生发展。体外研究提示8-iso-PGF2α导致IR的机制可能与干扰胰岛素与胰岛素受体结合后的信号传导减弱有关[12]。人体在IR状况下,线粒体呼吸链中有大量氧自由基生成,可进而启动氧化应激反应。IR易致冠脉痉挛,此时大量的氧自由基及其相关代谢产物8-iso-PGF2α在缺血区周围聚集,引起心肌细胞损伤及心肌超微结构改变,进一步促进粥样硬化斑块破裂或出血,从而促成急性冠脉事件的发生。由此说明氧化应激及其代谢产物8-iso-PGF2α导致并促进IR,而IR又启动加强氧化应激反应发生发展,从而形成恶性循环,两者互为因果,通过多种途径共同促进粥样斑块的发生发展及影响斑块的稳定性。故血浆8-iso-PGF2α及HOMA-IR可考虑作为冠心病危险分层及评估CHD病变程度的参考指标,并可在一定程度上反映冠脉粥样斑块的稳定程度;同时也可为采取措施改善IR,降低胰岛素水平,合理应用抗氧化剂治疗,延缓动脉硬化,治疗CHD提供判断标准。然而冠心病的发生发展还存在其它错综复杂的因素,血浆8-iso-PGF2α及 HOMA-IR作为监测CHD发生发展及预后的作用机制还需进一步深入研究。
[1] Antelava N,Pachkooria K,Kezeli T,et al.Major pathogenic links of atherosclerosis[J].Georgian Med News,2005,128(3):72-79.
[2] Yanase M,Takatsu F,Taqawa T,et al.Insulin resistance and fasting hyperinsulinemia are risk factors for new cardiovascular events in patients with prior coronary artery disease and normal glucose tolerance[J].Circ J,2004,68(1):47-52.
[3]曹国良,乔永芳.心肌损伤标记物与急性心肌梗死[J].实用诊断与治疗杂志,2003,17(5):374-376.
[4] Gensini GG.A more meaningful scoreing system for determing the severity of coronary heart disease[J].Am J Cardiol,1983,51(3):606.
[5] Abbasi F,Reaven GM.Evalusation of the quantitative insulin sensitivity check index as an estimate of insulin sensitivity in humans[J].Metabolism,2002,51(3):235-237.
[6] Rankin JW,Andreae MC,Oliver Chen CY,et al.Effect of raisin consumption on oxidative stress and inflammation in obesity[J].Diabetes Obes Metab,2008,10(11):1086-1096.
[7] Brasen JH,Leppanen O,Inkala M,et al.Extracellular superoxide dismutase accelerates endothelial recovery and inhibits in-stent restenosis in stented atherosclerotic Watanabe heritable hyperlipidemic rabbit aorta[J].J Am Coll Cardiol,2007,50(2):2249-2253.
[8] Zhou JF,Wang XY,shangguan XJ,et al.Increased oxidative stress in bodies of women with pregnancy-induced hypertension[J].Biomed Environ Sci,2005,18(5):207-212.
[9]王秋林,王浩毅,王树人.氧化应激状态的评价[J].中国病理生理杂志,2005,21(10):2069-2074.
[10] Morrow JD.Quantification of isoprostanes as indices of oxidant stress and the risk of atherosclerosis in humans[J].Arterioscler Thromb Vasc Biol,2005,25(2):279-286.
[11] Elesber AA,Best PJ,Lennon RJ,et al.Plasma 8-iso-prostaglandin F2alpha,a marker of oxidative stress,is increased in patients with acute myocardial infarction[J].Free Radic Res,2006,40(4):385-391.
[12] Chu PL,Chiu YL,Lin JW,et al.Effects of low-and high-flux dialyzers on oxidative stress and insulin resistance[J].Blood Purif,2008,26(2):213-220.
