他汀类药物抑制腹主动脉瘤扩张速率的Meta分析
2011-04-26裘毅钢张蓉费宇行
裘毅钢,张蓉,费宇行
腹主动脉瘤(abdominal aortic aneurysm,AAA)是一种常见的危及生命的动脉退行性疾病,多发生于老年男性,一旦破裂死亡率极高。目前认为腹主动脉瘤直径超过5.5 cm时需行手术治疗,但对于直径小于5.5 cm的小AAA,除了随访监测动脉瘤直径外,临床尚无一种有效的治疗措施阻止或延缓其继续增大。近年来对AAA的发病机制已有崭新的认识:多因素致病、复杂的局部血管退行性病变包括慢性炎症、炎症细胞的浸润、细胞外基质的重塑已成共识。研究证实,炎症反应贯穿于动脉瘤形成、扩张直至破裂的全过程[1],在动脉瘤的发病机制中起到关键作用。他汀类降脂药具有多效性,最近的动物研究提示他汀类药物能抑制动脉瘤的发展[2],近年来有研究者在临床上将他汀类药物用于治疗小AAA患者,发现其对小AAA有治疗或阻止的作用[3-5];但也有试验结果没有发现统计学差异[6]。为了进一步探讨他汀类药物对小AAA的扩张速率的抑制作用,我们对相关临床对照研究进行Meta分析。
1 资料与方法
1.1 纳入标准 研究对象:明确诊断腹主动脉瘤(AAA直径≤55 mm)的患者;治疗组使用他汀治疗,对照组不使用他汀。研究类型为设计良好的临床对照研究(包括队列研究及随机对照研究),文中报告数据完整或根据报告结果能推算出分析所需数据;设计严谨、实验方法可靠,统计方法恰当,并提供病例组和对照组的人数,提供随访时间。研究指标:他汀类降脂药治疗与主动脉瘤直径扩张速率的关系。剔除标准:重复报告的文献;报告信息太少以至无法利用的研究;未提供病例及对照来源;资料分析方法有误或未提供;未提供AAA扩张速率及95%CI或可转化为扩张速率及95%CI的数据;综述文献等。
1.2 文献检索 采用电子检索和手工检索进行文献初检,电子检索数据库有Pubmed、中国期刊全文数据库(CNKI)、Cochrane图书馆、中国循证医学Cochrane中心数据库(CEBM/CCD),检索时间均为各数据库建库起至2010年11月。外文文献以“abdominal aorticaneurysm;hydroxymethylglutaryl-CoA reductase inhibitors;statin;lipid-lowering drugs”为检索词,不限定语种。中文以“腹主动脉瘤、羟甲基戊二酰CoA还原酶抑制剂、他汀、降血脂药”为检索词,限定语言种类为中文。手工检索主要专业期刊以免出现检索遗漏。
1.3 资料分析 2个评价者首先独立阅读文章题目和摘要,对符合纳入标准的文献阅读全文,筛选出来后进行分类评价。评价者间使用Kappa值计算一致性,不同意见讨论解决。提取的资料包括:研究的一般情况,随访前后主动脉瘤直径变化值。采用Cochrane协作网提供的Revman 5.0统计软件分析纳入研究的临床同质性,采用q检验分析各研究之间的统计学异质性,当P>0.05时选择固定效应模型,当P<0.05时选择随机效应模型。合并统计量用95%CI表示。
2 结果
2.1 文献筛选流程及纳入研究的基本情况 最初共检索出相关文献91篇,通过阅读题目、摘要或全文,依照纳入和排除标准进行筛选,剔除与本研究目的不符、重复发表的文献,并通过追查参考文献,最后共纳入6篇[3-8]关于他汀类药物治疗与主动脉瘤扩张速率的文献。筛选流程(图1)。纳入的6篇文献均为非随机的临床队列研究,共纳入1413例患者,其中他汀类药物治疗组665例,对照组748例。随访时间2~5年,观察指标为腹主动脉瘤直径的扩张率(mm/年),治疗组和对照组在年龄、性别等方面的差异无统计学差异性,具有可比性,各研究基本情况(表1)。
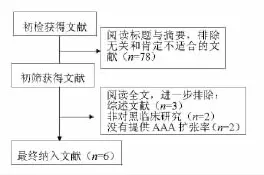
图1 文献筛选流程
2.2 数据处理及发表性偏倚的评估
2.2.1 数据处理 入选的6篇文献中,仅有2篇直接提供了他汀类药物治疗组和对照组AAA扩张速率的均数和标准差,3篇提供了两组扩张速率的均数差及95%CI,1篇提供了两组扩张速率的OR值及95%CI。根据 Cochrane Handbook 5.0.1 第7 章提供的方法[9],得出各个研究中两组扩张速率的均数差(Mean Difference,MD)及标准差(SD)。
2.2.2 发表性偏倚的评估 阳性结果的研究易发表,阴性的不易发表或者研究者本身就放弃做进一步研究,这就可能导致最终对Meta分析结果产生影响。绘制了漏斗图判断有无显著性发表偏倚(图2),所有的点基本呈对称分布,因而判断不存在发表偏倚。为了进一步检验发表性偏倚,进一步按照如下公式计算失安全系数:Nfx0.05=(∑Z/1.64)2-k,其中k为纳入研究的个数,Z为各独立研究的Z值[10]。经计算失安全系数为146.53,提示发表偏倚的影响较小。
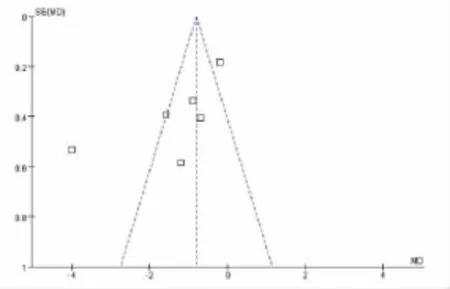
图2 发表性偏倚评估的漏斗图
2.3 数据合并 以他汀类药物治疗组和对照组之间扩张速率的均数差为合并统计量,对其进行异质性检验,I2=63.80,P <0.001,因此采用随机效应模式进行数据合并。合并后的AAA扩张率差异为-1.47 mm/年,95%CI(-2.51 ~-0.44),整体效果检验 Z=2.79,P <0.01,即他汀类药物治疗组与对照组的AAA扩张速率存在显著差异(图3)。
2.4 敏感性分析 全部文献采用固定效应模型合并的 AAA 扩张速率差异为-0.84 mm/年,95%CI(-1.10 ~-0.58),P <0.001。Suhkhija等[4]研究的结果对分析结果的影响较大,在排除该文献后对剩余5篇文献文献重新进行异质性检验I2=12.91,P=0.01,用随机效应模型合并后的AAA扩张率差异为-0.85 mm/年,95%CI(-1.40 ~ -0.30),P <0.01。另Karlsson等[4]的研究未提供明确的随访年限,剔除该篇文献后异质性检验I2=63.76,P <0.001,用随机效应模型合并后AAA扩张速率差异为-1.61mm/年,95%CI(-2.93 ~ -0.28),P <0.05。可见采用不同效应模型分析及排除对分析结果影响较大的文献后,合并结果间均无统计学差异,说明Meta分析结果稳定性较好。
3 讨论
随着人口老龄化,AAA的发病率有逐年增高的趋势。腹主动脉的最大直径是预测动脉瘤破裂的最重要的因素,当患者的AAA直径超过5.5 cm时破裂的风险将大大增加,需要外科手术或腔内隔绝术阻止动脉瘤破裂;而直径小于5.5 cm的小AAA虽然破裂的风险较低,但除了随访监测动脉瘤直径外,尚无一种有效的治疗措施阻止或延缓其继续增大。近年来两个大型的随机对照临床试验报道了外科手术并不能改善小AAA患者的生存率[11-12]。因此发现一种非侵入性治疗手段抑制小的腹主动脉瘤的扩张速率是十分必要的。
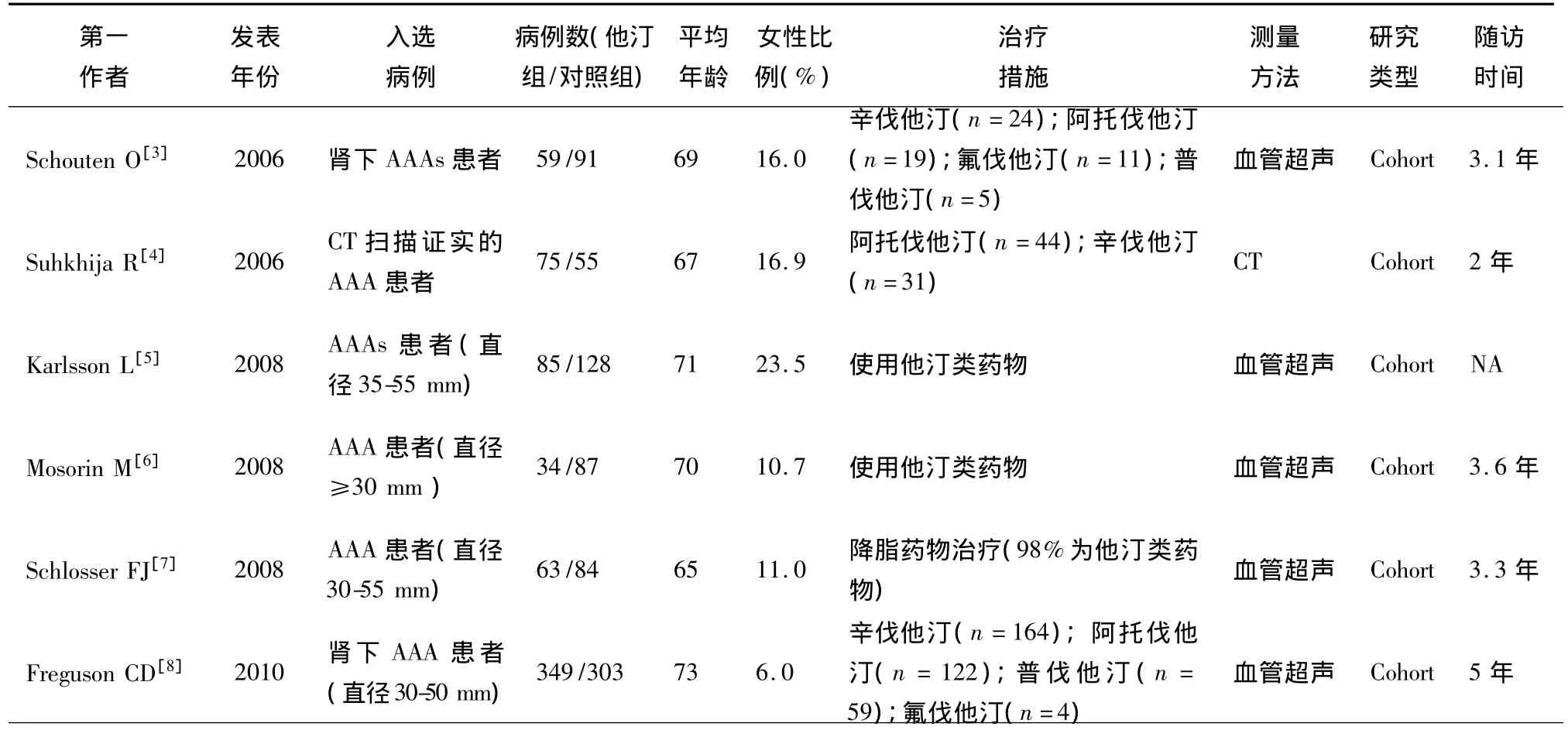
表1 纳入研究的基本情况
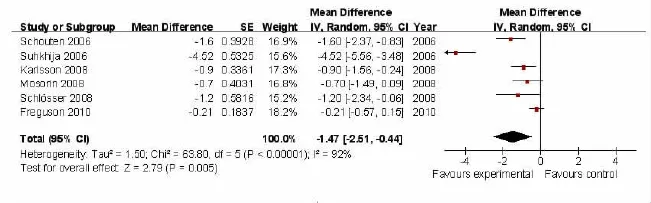
图3 他汀类药物治疗与AAA扩张速率的森林图
许多研究已经证实,炎症反应在AAA的发病过程中起了关键的作用。在动物模型中发现,在AAA形成早期腹主动脉尚未扩张之前,局部血管壁就有大量的炎症细胞聚集,并且抑制炎症反应能够阻止减缓动脉瘤的形成[13]。他汀类降脂药具有多效性,不仅能够降低血脂水平,而且具有抗炎作用,能够减缓动脉粥样硬化的进展,改善心血管疾病的预后。在动物实验中发现,用辛伐他汀治疗不仅减少主动脉瘤的直径,而且降低弹性蛋白酶注射后动脉瘤形成的百分比[14]。
本研究meta分析共纳入了6项使用他汀治疗对AAA扩张速率影响的临床队列研究,两个组AAA的扩张速率差异从-0.21 mm/年至-4.52 mm/年。分析结果显示:与对照组相比,他汀类药物治疗能够减缓AAA的扩张速率达-1.47 mm/年,且具有统计学差异性。此外Suhkhija等[4]还发现:他汀治疗不仅能够减缓AAA的扩张速率,而且他汀治疗组AAA患者的死亡率远低于对照组(4/75 vs.9/55,P<0.05)。在行外科手术治疗的AAA患者中,术前使用他汀治疗显著降低了手术后并发症的发生(4.4%vs.14.7%,P <0.05)以及手术后死亡率(0.0%vs.5.9%,P <0.05)[15]。他汀类药物的这种作用可能与抑制炎症反应以及降低基质金属蛋白酶(matrix metalloproteinases,MMPs)和丝氨酸蛋白酶蛋白水解酶类的产生,减少主动脉壁细胞外基质的破坏有关[16-17]。在体外试验中发现,西立伐他汀能够抑制AAA血管壁中巨噬细胞和中性粒细胞的激活,减少MMP-9的产生[18];并且他汀类药物以浓度依赖的方式显著降低血管壁局部总MMP-9浓度及MMP-9的激活水平[19],进而抑制AAA的直径扩张。
羟甲基戊二酰CoA还原酶抑制剂是目前临床上使用较为广泛的药物,本研究结果显示他汀类降脂药能够延缓AAA的扩张速率,对于临床指导小的AAA患者的药物治疗具有一定的意义。但分析结果存在一定的局限性:首先,分析纳入的6项研究均为队列研究,而非随机对照研究;其次,各试验中研究对象、样本含量、使用他汀类降脂的种类、剂量和疗程的差异导致各结果间有一定的异质性;最后,部分试验没有直接提供随访前后AAA扩张速率的差值和标准差,而是根据Cochrane Handbook建议的方法间接获得,这均在一定程度上影响了上述结论的可靠性。因此需要更多的设计良好的大规模随机对照临床试验来证实他汀治疗AAA的有效性及安全性。
[1] Shimizu K,Mitchell RN,Libby P.Inflammation and cellular immune responses in abdominal aortic aneurysms[J].Arterioscler Thromb Vasc Biol,2006,26(5):987-994.
[2] Steinmetz EF,Buckley C,Shames ML,et al.Treatment withsimvastatin suppresses the development of experimental abdominal aortic aneurysms in normal and hypercholesterolemic mice[J].Ann Surg,2005,241(1):92-101.
[3] Schouten O,van Laanen JH,Boersma E,et al.Statins are associated with a reduced infrarenal abdominal aortic aneurysm growth[J].Eur J Vasc Endovasc Surg,2006,32(1):21-26.
[4] Suhkhija R,Aronow WS,Sandhu R,et al.Mortality and size of abdominal aortic aneurysm at long-term follow-up of patients not treated surgically and treated with and without statins[J].Am J Cardiol,2006,97(2):279-280.
[5] Karlsson L,Bergqvist D,Lindback J,et al.Expansion of smalldiameter abdominal aortic aneurysms is not reflected by the release of inflammatory mediators IL-6,MMP-9 and CRP in plasma[J].Eur J Vasc Endovasc Surg,2009,37(4):420-424.
[6] Mosorin M,Niemela E,Heikkinen J,et al.The use of statins and fate of small abdominal aortic aneurysms[J].Interact Cardiovasc Thorac Surg,2008,7(4):578-581.
[7] Schlosser FJ,Tangelder MJ,Verhagen HJ,et al.Growth predictors and prognosis of small abdominal aortic aneurysms[J].J Vasc Surg,2008,47(6):1127-1133.
[8] Ferguson CD,Clancy P,Bourke B,et al.Association of statin prescription withsmall abdominal aortic aneurysm progression[J].Am Heart J,2010,159(2):307-313.
[9] Higgins JP,Deeks JJ.Chapter 7:Selecting studies and collecting data.Cochrane handbook for systematic reviews of interventions version 5.0.1(updated September 2008)[EB].The Cochrane Collaboration,2008.www.cochrane-handbook.org.
[10]麦劲壮,李河,方积乾,等.Meta分析中失安全系数的估计[J].循证医学,2006,6(5):297-303.
[11] The UK Small Aneurysm Trial Participants.Mortality results for randomized controlled trial of early elective surgery or ultrasonographic surveillance for small abdominal aortic aneurysms[J].Lancet,1998,352(9141):1649-1655.
[12] Lederle FA,Wilson SE,Johnson GR,et al.Immediate repair compared withsurveillance of small abdominal aortic aneurysms[J].N Engl J Med,2002,346(19):1437-1444.
[13] Halpern VJ,Nackman GB,Gandhi RH,et al.The elastase infusion model of experimental aortic aneurysms:synchrony of induction of endogenous proteinases with matrix destruction and inflammatory cell response[J].J Vasc Surg,1994,20(1):51-60.
[14] Kalyanasundaram A,Elmore JR,Manazer JR,et al.Simvastatin suppresses experimental aortic aneurysm expansion[J].J Vasc Surg,2006,43(1):117-124.
[15] McNally MM,Agle SC,Parker FM,et al.Preoperative statin therapy is associated with improved outcomes and resource utilization in patients undergoing aortic aneurysm repair[J].J Vasc Surg,2010,51(6):1390-1396.
[16] Shiraya S,Miyake T,Aoki M,et al.Inhibition of development of experimental aortic abdominal aneurysm in rat model by atorvastatin through inhibition of macrophage migration[J].Atherosclerosis,2009,202(1):34-40.
[17] Evans J,Powell JT,Schwalbe E,et al.Simvastatin attenuates the activity of matrix metalloprotease-9 in aneurysmal aortic tissue[J].Eur J Vasc Endovasc Surg,2007,34(3):302-303.
[18] Nagashima H,Aoka Y,Sakomura Y,et al.A 3-hydroxy-3-methylglutaryl coenzyme A reductase inhibitor,cerivastatin,suppresses production of matrix metalloproteinase-9 in human abdominal aortic aneurysm wall[J].J Vasc Surg,2002,36(1):158-163.
[19] Bernd M,Alexander O,Hubert S,et al.Effect of statin therapy on serum activity of proteinases and cytokines in patients with abdominal aortic aneurysm[J].Vascular Health and Risk Management,2008,4(6):1433-1437.
