转DREB1A基因多年生黑麦草
2011-04-25包永霞韩烈保
包永霞,李 雪,满 达,韩烈保,4
(1.北京林业大学草坪研究所,北京 100083;2.北京鼎国昌盛生物技术有限责任公司,北京 100083;3.北京林业大学总务与产业管理处,北京 100083;4.长江大学园艺园林学院,湖北 荆州 434025)
盐害是21世纪世界农业面临的重要问题[1]。水资源短缺和土地盐渍化是限制植物生长的重要因子,土壤次生盐化问题已经成为影响我国北方地区禾草使用价值的重要限制因素[2]。充分开发利用盐化土壤,种植经济价值较高的耐盐植物是农业生产面临的重大课题[3]。为了解决以上问题,通过基因工程手段选育耐盐碱草坪草新品种,改良和利用盐化土壤具有广阔的发展前景。
DREB是一类参与应答植物非生物胁迫的主要调控蛋白,植物在低温、高盐及干旱逆境胁迫下,DREB基因被诱导表达,表达产物与DRE特异结合,启动下游与抗逆性相关的功能基因的表达,基因产物累积,调节植物体内各种生理生化反应,最终使植物的抗逆性得到提高[4]。多年生黑麦草(Loliumperenne)是一种应用广泛的冷季型草坪草,但对于干旱的耐受力较弱,对盐的耐受力中等。本研究主要分析转DREB1A基因的多年生黑麦草T1代萌发期对不同质量分数NaCl溶液的抗性,以期筛选耐盐转基因植株以及耐盐指标,为盐害地区土壤的利用和改良提供新的植物资源和理论指导。
1 材料与方法
1.1供试材料 通过建立多年生黑麦草(爱神特品种)高频再生体系,应用基因枪转化法将DREB1A基因导入胚性愈伤组织,获得了转基因植株;通过自由杂交方式获得转基因T1代[5]。转基因亲本植株的抗旱性初步研究结果证明,转基因植株的抗旱性比非转化植株有明显提高[5-6]。
本研究供试材料分别为DREB1A7株系互为父母本杂交得到的T1代种子(DREB1A7);DREB1A27株系互为父母本杂交得到的T1代种子(DREB1A27);DREB1A82株系互为父母本杂交得到的T1代种子(DREB1A82);多年生黑麦草非转化植株子一代种子(CK)作对照。
1.2方法 将双层滤纸铺在直径为9.0 cm的培养皿中作发芽床,每皿均匀摆放50粒成熟饱满、大小均匀的种子,分别用不同质量分数(0、0.3%、0.6%、0.9%、1.2%、1.5%)的化学纯 NaCl 盐溶液进行处理。置于光照培养箱中变温培养(25 ℃ 16 h/16 ℃ 8 h)。每日定量补水,保持发芽床湿润,种子萌发以胚根伸出种皮0.2 cm作为发芽标志[7],记录萌发种子数,共记录20 d。每处理3次重复。
1.2.1相对发芽势和相对发芽率 第7天萌发数占供试种子数的百分比为相对发芽势;第10天萌发数占供试种子数的百分比为相对发芽率[5]。
1.2.2胚芽长和胚根长 第20天用直尺测量萌发后幼苗叶片、根系绝对长度。
1.2.3细胞膜透性 第20天取新鲜叶片0.1 g,剪碎置于具塞刻度试管中,加10 mL无离子水,在BS-2F恒温振荡培养箱(箱内温度25 ℃,400 r/min)振荡4 h后,用DJS-11A电导仪测其电导率Rc0,然后置于沸水中5 min,待冷却后测其电导率Rc1,最后计算其相对电导率[8]。
1.2.4叶绿素含量 参照李合生等[9]的方法测定叶绿素含量。
1.2.5叶片含水量和叶片相对含水量 采用组织烘干法[10],称取叶片鲜质量(mf),然后将叶片放入干燥箱中80 ℃下烘48 h,称干质量(md)。
叶片含水量=(mf-md)/mf×100%。
参照华东师大植物生理教研室[11]的方法测定叶片相对含水量(RWC)。
1.2.6数据分析 采用SPSS 17.0数据统计分析软件。
2 结果与分析
2.1盐胁迫对种子相对发芽势和相对发芽率的影响 相对发芽势随盐质量分数的增加而下降。0.3%质量分数下,各材料的相对发芽势均开始不同程度地下降。对照组变化幅度大,与转基因组的差异显著,0.6%质量分数下DREB1A82表现出较强抗性;DREB1A7和DREB1A27相对发芽势下降程度居中;CK的相对发芽势下降到6%。0.9%质量分数下只有DREB1A82表现出好的抗性,DREB1A7和DREB1A27相对发芽势不到4%,CK的相对发芽势下降到0。1.2%~1.5%质量分数时所有材料相对发芽势均下降到0(图1)。
0.3%~0.6%质量分数下,各材料的相对发芽率均开始不同程度地下降,其中对照组下降程度明显。0.9%质量分数下DREB1A82和DREB1A27表现出良好抗性;DREB1A7相对发芽率下降程度居中;CK的相对发芽率下降到0。但是,1.2%质量分数下DREB1A7仍表现出好的抗性,DREB1A82和DREB1A27相对发芽率骤降至4%。DREB1A7对1.5%质量分数盐胁迫有较强的抗性;DREB1A27在1.5%质量分数下仍有8%的相对发芽率(图2)。

图1 盐胁迫对转DREB1A基因多年生黑麦草T1代与非转化植株子一代相对发芽势的影响
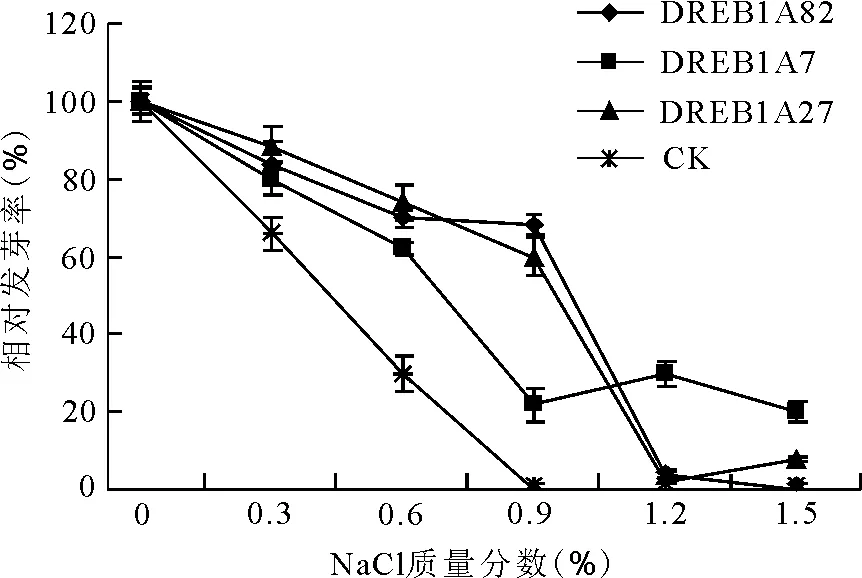
图2 盐胁迫对转DREB1A基因多年生黑麦草T1代与非转化植株子一代相对发芽率的影响
2.2盐胁迫对胚芽长、胚根长的影响 随着盐质量分数的增加供试材料胚芽长整体上呈逐渐降低趋势,转基因组在0~0.9%质量分数下下降程度不明显,对照组在0.6%~0.9%质量分数下胚芽长下降程度与转基因组存在极显著差异。1.2%~1.5%质量分数下,除DREBIA82外,转基因组表现良好抗性,对照组的胚芽长均为0(图3)。
所有供试材料在0~0.9%质量分数下胚根长受抑制程度不明显,对照组胚根长对盐质量分数有良好抗性,甚至比转基因植株抗盐。1.2%~1.5%质量分数下转基因组和对照组均没有长出胚根(图4)。
2.3盐胁迫对细胞膜透性的影响 各材料细胞膜透性与盐质量分数成正比,转基因组和对照组细胞膜透性增大的程度不同,对照组在0.6%~1.5%质量分数盐胁迫下的细胞膜透性始终比转基因组高(图5)。
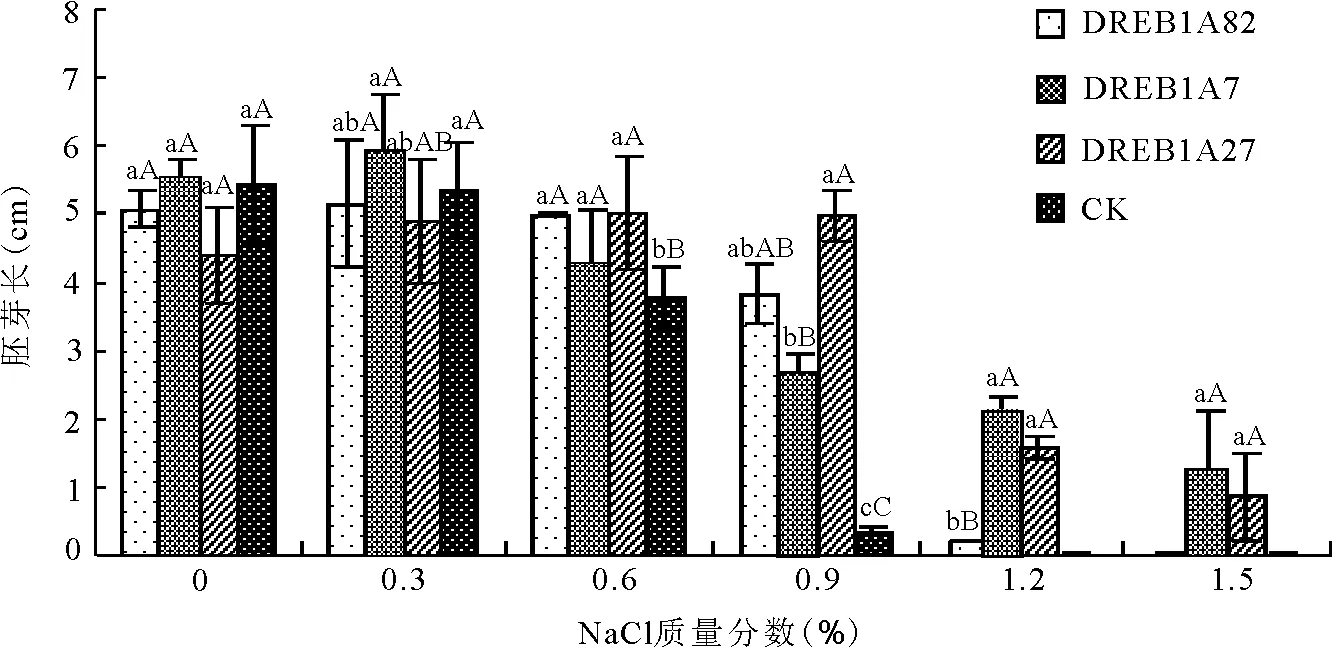
图3 盐胁迫对转DREB1A基因多年生黑麦草T1代与非转化植株子一代胚芽长的影响

图4 盐胁迫对转DREB1A基因多年生黑麦草T1代与非转化植株子一代胚根长的影响
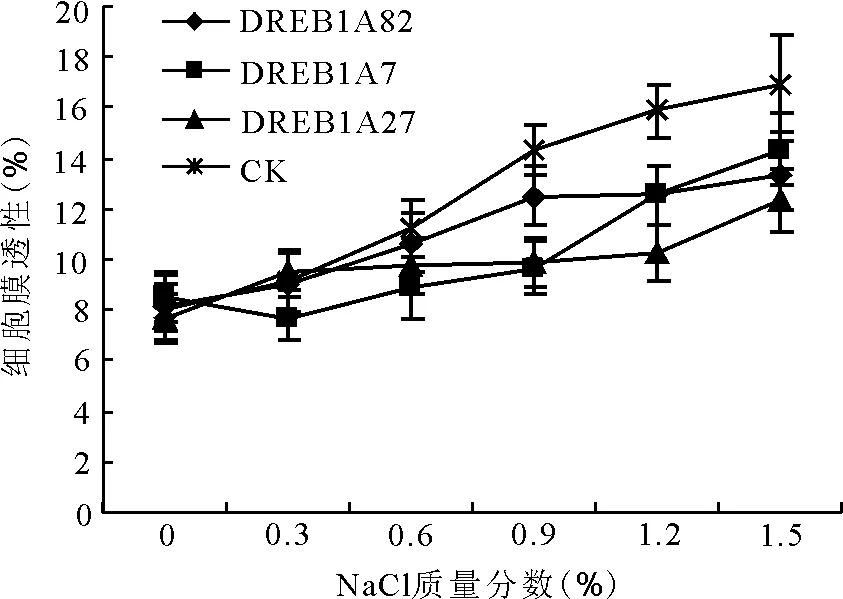
图5 盐胁迫对转DREB1A基因多年生黑麦草T1代与非转化植株子一代细胞膜透性的影响
2.4盐胁迫对叶片叶绿素含量的影响 随着盐质量分数的增加叶片叶绿素含量整体上呈逐渐降低趋势,转基因组随盐质量分数递增,缓慢下降。1.2%~1.5%质量分数下转基因组仍具有较高含量的叶绿素。对照组在0~0.6%质量分数下叶绿素含量下降幅度与转基因组基本一致。0.9%~1.5%质量分数下大幅度下降,与转基因组的下降幅度呈现极显著差异(P<0.01)(图6)。
2.5盐胁迫对叶片含水量和相对含水量的影响 叶片含水量在低质量分数时变化不明显,但在高质量分数时随着盐溶液质量分数的不断增加呈现出下降趋势,对照组在0.6%质量分数下开始有明显下降,在0.9%质量分数下骤降为0。转基因组在0~0.9%质量分数下均没有明显变化,1.2%质量分数下骤降至0(图7)。
转基因组的叶片相对含水量在低质量分数时逐渐上升,但变化程度不明显,在高质量分数(1.2%)时呈明显下降趋势。对照组在0.6%质量分数下开始有明显下降,在0.9%质量分数时下降为0(图8)。
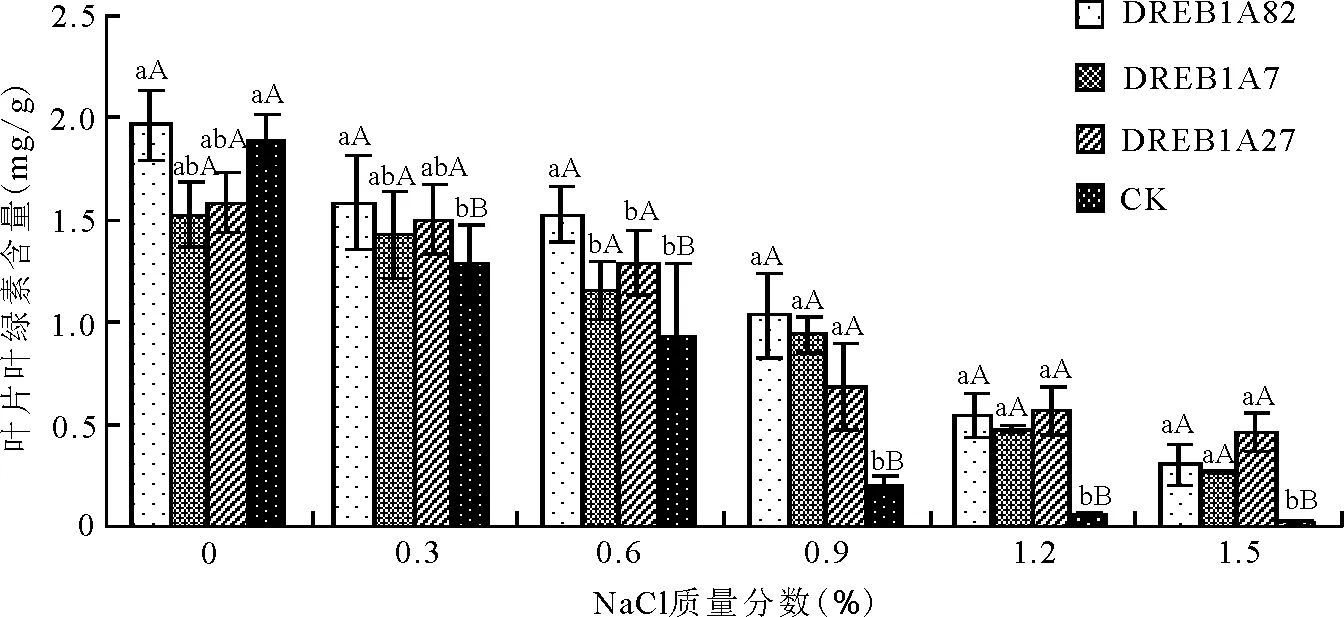
图6 盐胁迫对转DREB1A基因多年生黑麦草T1代与非转化植株子一代叶片叶绿素含量的影响
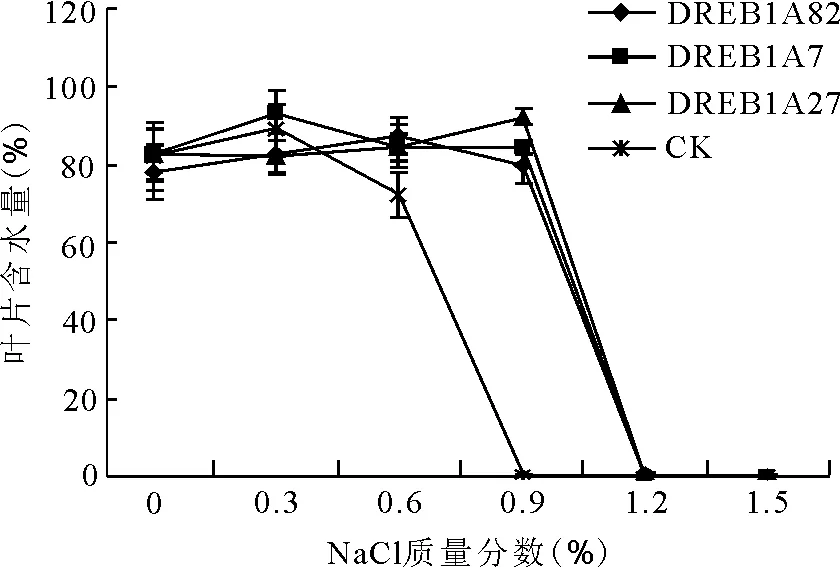
图7 盐胁迫对转DREB1A基因多年生黑麦草T1代与非转化植株子一代叶片含水量的影响
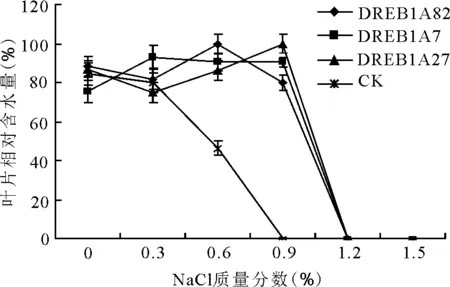
图8 盐胁迫对转DREB1A基因多年生黑麦草T1代与非转化植株子一代叶片相对含水量的影响
3 讨论
盐分在植物的各个时期都有危害[12]。盐逆境降低草坪草种子的发芽率,使萌发延迟[13]。本研究结果表明,相对发芽势、相对发芽率均随着盐质量分数的不断增加而下降,表明盐溶液对种子萌发有一定抑制作用。但是,转基因组在高质量分数盐胁迫下仍具有较高的发芽率,而对照组只有在低质量分数盐胁迫下有部分种子萌发。盐逆境还会抑制幼苗生长[13],抑制植物组织和器官的生长和分化。盐胁迫对对照组的胚芽长有严重抑制作用;转基因组表现良好的抗性,其胚芽长受抑制程度较低。低质量分数盐胁迫对胚根长的抑制不明显,高质量分数盐胁迫下几乎所有材料均无胚根长出。转基因组和对照组的胚根长在各质量分数盐胁迫下无明显差异和变化规律。
盐胁迫下植株体内的叶绿素酶活性增强,促进叶绿素b的降解,使得植株叶片的叶绿素含量降低[14]。随盐质量分数递增,叶绿素含量呈降低趋势。转基因组在高质量分数盐胁迫下仍具有较高含量的叶绿素,呈良好抗性。除此之外,抗逆境还会使细胞内自由基引发膜脂过氧化,造成细胞膜系统的损伤,膜透性增加[15]。本研究证明,转基因组在盐胁迫下膜的结构相对稳定,透性变化较小,受到伤害较轻,因而抗盐性比对照组强。
4 结论
1) 相对发芽势、相对发芽率、胚芽长、细胞膜透性、叶片叶绿素含量、叶片含水量和相对含水量都可作为转DREB1A基因多年生黑麦草T1代耐盐植株筛选的参考指标。
2) 除胚根长以外的所有指标在0.9%盐质量分数下,转基因组和对照组之间的差异均达到显著水平(P<0.05)。所以,0.9%的盐质量分数可作为转基因多年生黑麦草T1代耐盐种子筛选的参考质量分数。
3) 转基因植株对盐胁迫有较强的抗性,对高质量分数(0.9%~1.5%)盐胁迫也有一定抗性,与对照组相比有显著性差异。转DREB1A基因多年生黑麦草T1代种子可作为盐害地区改良与利用的植物新资源。
[1]Flowers T J.Salinisation and horticultural production[J].Scientia Horticulturae,1999,78:1-4.
[2]Yokoi S,Bressan R A,Hasegawa P M.Salt stress tolerance of plants[R].JIRCAS Working Report,2002:25-33.
[3]耿贵,周建朝,陈丽,等.氯化钠胁迫下甜菜不同品种(系) 种子发芽率和幼苗生长的差异[J].中国糖料,2004(2):14-18.
[4]刘强,张贵友,陈受宜.植物转录因子的结构与调控作用[J].科学通报,2000,4(14):1465-1474.
[5]李雪.多年生黑麦草抗旱性遗传改良及其安全性评价研究[D].北京:北京林业大学,2008.
[6]Han L B,Li X,Liu J,etal.Drought-tolerant transgenic perennial ryegrass (LoliumperenneL.) obtained via particle bombardment gene transformation of cbf3/dreb1a gene[J].Acta Horticulturae,2008,783:273-282.
[7]沈禹颖,阎顺国.盐分对碱茅草种子萌发的影响[J].草业科学,1991,8(3):22-25.
[8]张宪政,陈凤玉,王荣富.植物生理学实验技术[M].沈阳:辽宁科学技术出版社,1994.
[9]李合生,孙群,赵世杰,等.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:134-137.
[10]郝再彬.植物生理学实验技术[M].哈尔滨:哈尔滨出版社,2002.
[11]华东师大植物生理教研室.植物生理学实验指导[M].北京:人民教育出版社,1980:54-57.
[12]葛玉英,朱延明,吕德康,等.野生大豆碱胁迫反应的研究[J].草业科学,2009,26(2):47-52.
[13]张秀云.草坪草耐盐性研究进展[J].草原与草坪,2000(2):8-11.
[14]Adams D B,Adams W W.Photoprotection and other responses of plants to high light stress[J].Annual Review of Plant Physiology and Plant Mo1ecular Biology,1992,43:599-626.
[15]燕丽萍,夏阳,梁慧敏,等.转BADH基因苜蓿T1代遗传稳定性和抗盐性研究[J].草业学报,2009,18(6):65-71.
