菊苣根乙醇提取工艺优化及除草活性测定
2011-04-25刘玉燕杜金鸿王佺珍
刘玉燕,杜金鸿,陈 果,王佺珍,崔 健
(1.西北农林科技大学动物科技学院草业科学系,陕西 杨凌 712100;2.西北农林科技大学生命科学学院植物科学系,陕西 杨凌 712100)
菊苣(Cichoriumintybus)是菊科菊苣属多年生草本植物,可药食兼用,食用主要体现为优质牧草,许多家畜喜食[1],而菊苣药效功能的研究有抑制肿瘤[2]、消炎[3]和保肝作用[4]等。美国食品及药物管理局普遍认为菊苣提取物是安全的[5]。超声波提取方法应用广泛,是快速提取的有效方法之一[6]。影响超声波提取的主要因素有功率、频率、温度和时间,加之试验中的其他因素,较难掌握各因素作用大小或重要性,因此需进行条件优化[7]。正交设计包含多种因素,能优化整体过程而不影响结果[8],而且还可以减少不稳定的所有内在因素[9]。
植物源农药的有效成分是自然存在的,易于降解,在环境中积累毒性的可能性不大,是对人和动物毒性比较低,对生态环境影响小的安全农药[10]。农田杂草生长和繁衍迅速,严重影响作物的产量,故天然除草剂是开发植物源农药的重要内容之一[11]。菊苣应用广泛且药效功能多样,但是鲜见有关开发菊苣提取物植物源农药的研究报道。本研究的目的是利用无毒的水和低毒的乙醇配制成不同体积分数的乙醇溶液作为溶剂,结合超声波辅助提取,对菊苣根粗提物的提取条件进行优化,排序各因素影响的重要性;观测菊苣根粗提物的除草活性,开发菊苣植物源除草剂。
1 材料与方法
1.1材料 2009年9月新鲜收获5年龄普那菊苣根,采样地点在陕西杨凌西北农林科技大学试验地,菊苣根清洗干净,切成3~5 mm薄片,置于50℃烘箱中烘烤至质量恒定[6],粉碎,过40目筛(颗粒直径小于0.35 mm)[12-13],菊苣根干粉放入密封袋中保存。稗草(Echinochloacrusgali)种子是2008年收集于田埂边或路边,野生种;反枝苋(Amaranthusretroflexus)种子是2009年收集于西北农林科技大学草业科学系试验田,栽培品种。无水乙醇和蒸馏水由西北农林科技大学后勤集团试验材料供应部提供。
1.2仪器 电热恒温鼓风干燥箱(DHG-9140A),中草药粉碎机(FW177),NC超声波发生器(KQ-500DE),旋转蒸发器(RE52-98A),循环水式多用真空泵(SHB-Ⅲ),AY220电子分析天枰,YP1200电子天平,智能植物培养箱(ZPW-400)。
1.3试验设计 观察乙醇体积分数、料液比、超声温度、浸泡时间、浸泡重复次数、超声时间、超声输入功率和超声重复次数8个因素对超声波辅助提取的影响(除频率外,因为本试验考察都是单因素,而文献报道超声双频或变频对提取效果更好[14],因此频率不在本试验考察范围内),前3个因素各有4个水平,即乙醇体积分数(因素A)分别是0、50%、75%和100%;料液比(g/mL,因素B)分别为1∶8、1∶16、1∶24和1∶32;超声温度(因素C)分别为20℃(功率高时用冰块维持水温)、35℃、 50℃和65℃。剩下的因素均分成2个水平,包括乙醇溶液浸泡时间(因素D)24或48 h;浸泡重复次数(因素E)1次或2次,其中浸泡2次时,即收集滤液,滤渣重复操作一次;超声时间(因素F)30或120 min;超声输入功率(因素G)200或400 W;以及超声重复次数(因素H)1次或2次。8个因素及其水平等级分配见表1,第J列是为空列准备的,用于解释正交法的误差统计[15]。
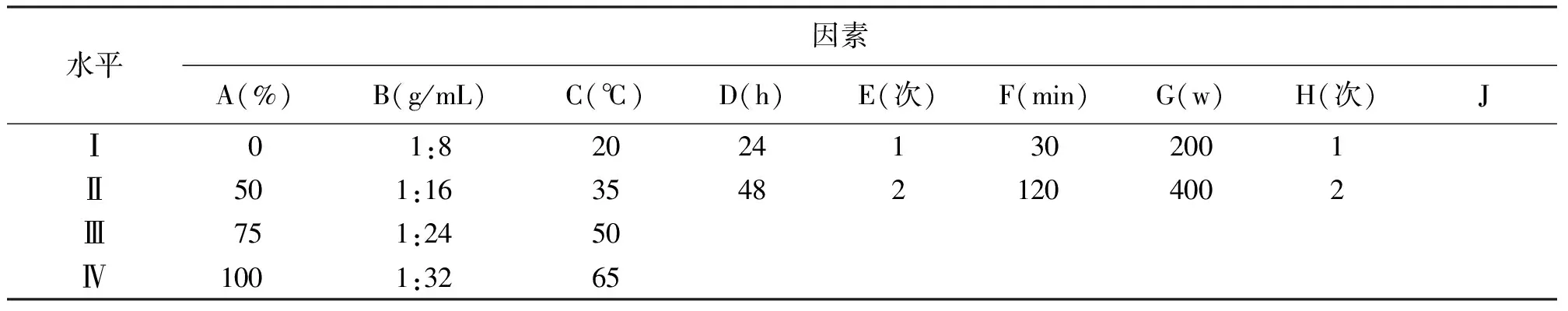
表1 混合正交L16(43×26)因素位级
1.4菊苣根粗提物制备 根据正交矩阵L16(43×26),试验将进行16种不同处理(表2),每次取250 g菊苣根粉末(过40目筛)分配于数个1 000 mL广口瓶中,加相应体积分数的乙醇溶液并用玻棒搅拌,室温浸泡。超声重复2次,第1次在整个浸泡时间的中点处中断。超声后过滤混合液,收集滤液于40℃旋转蒸发仪上浓缩至浸膏状[16],计算提取率:

1.5除草活性测定 配制5个不同梯度的菊苣根粗提物溶液,测定不同质量浓度下菊苣根粗提物对稗草和反枝苋的发芽抑制作用,质量浓度依次为40.5、13.5、4.5、1.5和0.5 g/L[17]。除草剂2,4-二氯基苯氧酸(2,4-D)用作阳性对照组,其质量浓度为1 g/L[18],蒸馏水作空白对照组(以下简称对照组)。
稗草和反枝苋种子均剔除杂物和其他草种,15%的次氯酸钠溶液表面消毒20 min后[18],立即用无菌蒸馏水冲洗数遍。随机取10粒种子[17]均匀摆放在附2层滤纸[19-20]的培养皿中(Φ 9 cm),16种处理的每一浓度设4个重复。综合Seal等[17]和Kordali等[20]的方法,反枝苋每皿添加溶液6 mL,稗草8 mL,阳性对照组和对照组分别加相应体积的2,4-D 溶液和蒸馏水。种子置于(25±2)℃[21],光照12 h,湿度80%[18]的培养箱中培养。反枝苋发芽比稗草迅速,因此,前者观察5 d[21],后者观察7 d[22]。记录每天的发芽个数,杂草的萌发指数[23]:
式中,Dt为发芽时间(d);Gt为与Dt相对应的每天发芽种子数。菊苣根粗提物对杂草的抑制率[18]:

1.6数据分析 使用Excel 2003、SPSS 17.0软件对数据进行统计分析。
2 结果与分析
2.1超声波辅助对菊苣根提取的工艺优化 菊苣根粗提物的16个提取率列于表2,根据正交试验分析方法[15]计算各水平提取率之和、和极差,得出最优条件和各因素的重要性次序,方差分析各因素的影响差异性(表3)。空列(J)极差为0.5,约占除J之外第2小极差(F)的7.24%和第3小极差(B)的4.42%(<5%),说明试验在允许误差范围之内,结果得出提取的最优条件组合为乙醇体积分数0,料液比1∶8,超声温度65℃,浸泡24 h,浸泡重复2次,超声30 min,超声输入功率400 W和超声重复2次;8个因素的重要性次序,按递减顺序是:乙醇体积分数、浸泡重复次数、超声输入功率、浸泡时间、超声重复次数、超声温度、料液比、超声时间;各因素对菊苣根提取率的影响均差异显著(P<0.05),其中乙醇体积分数、浸泡时间、浸泡重复次数,超声输入功率和超声重复次数对菊苣提取率的影响极显著(P<0.01)。
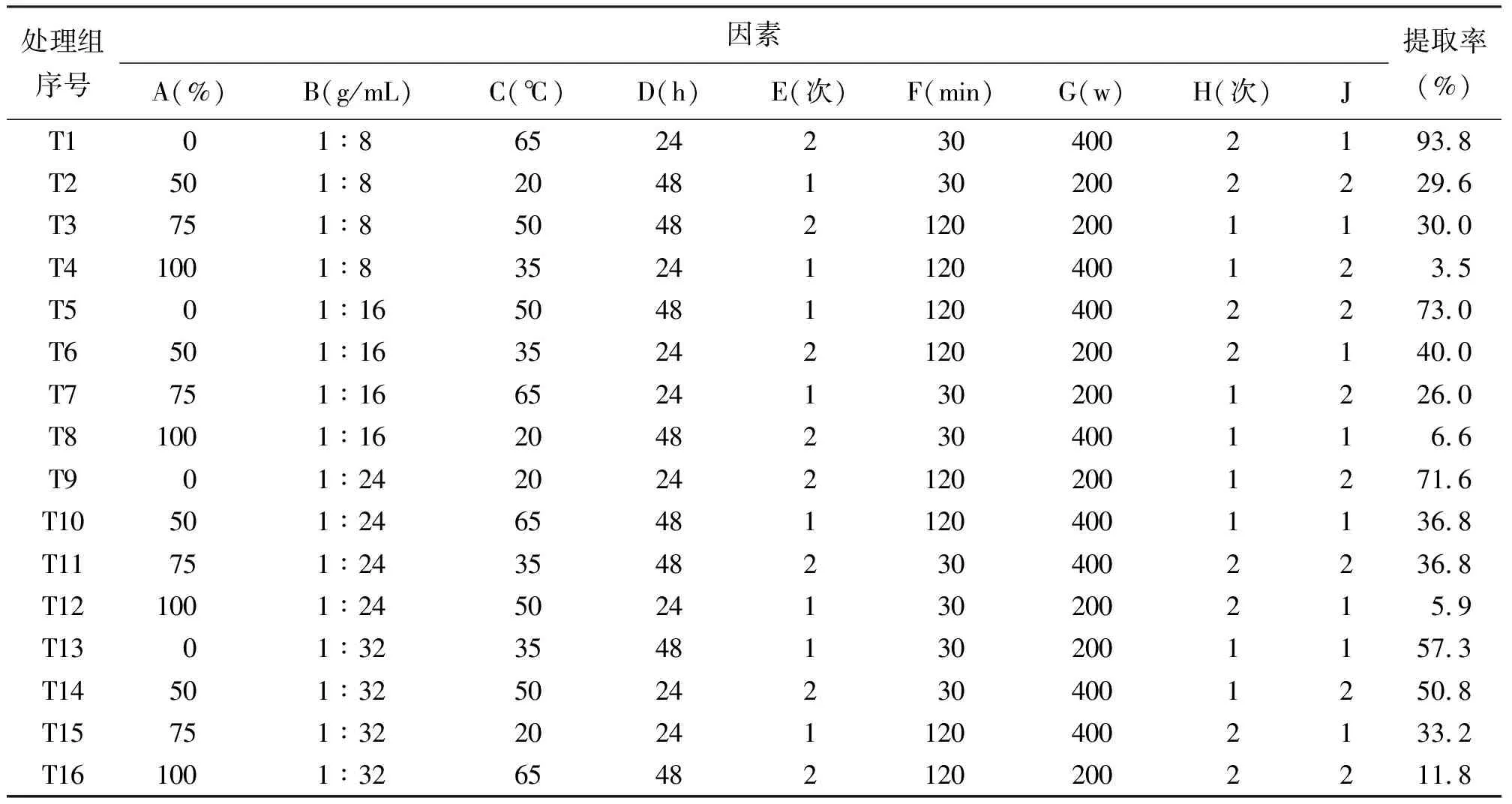
表2 矩阵L16(43×26)对试验因素和水平的分配及结果(提取率)
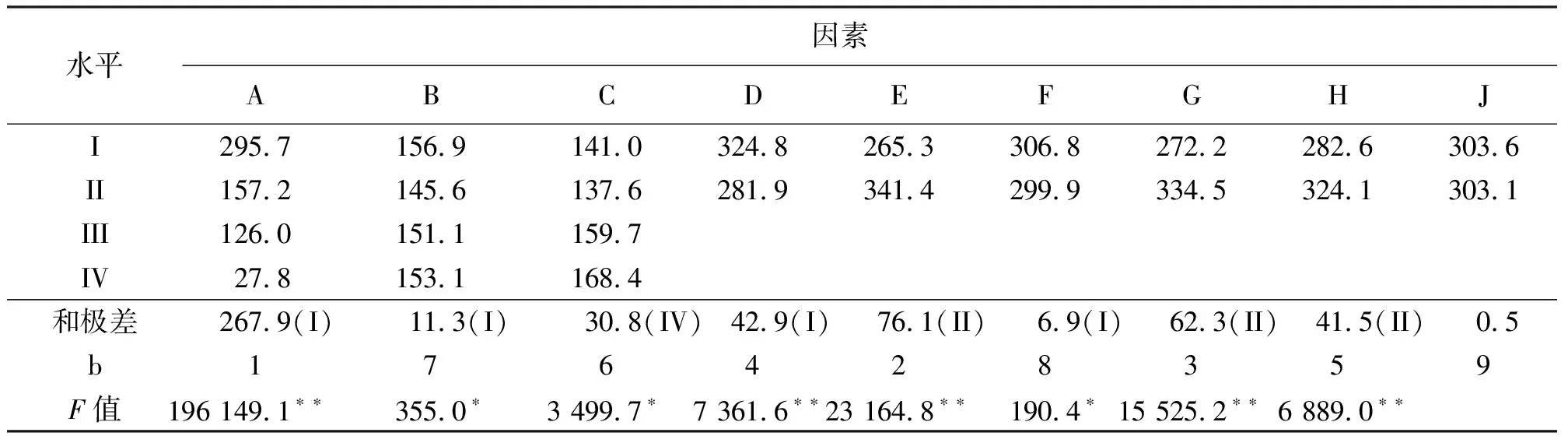
表3 8个因素的条件优化、重要性次序和方差分析结果
2.2菊苣根粗提物对稗草萌发指数的影响 菊苣根粗提物对稗草萌发指数抑制率的影响见表4。22.9%是菊苣根粗提物对稗草抑制率显著性的标记(表中以粗黑体显示),抑制率高于22.9%表明其抑制作用显著(P<0.05),故16种处理的菊苣根粗提物对稗草萌发指数均有抑制作用。抑制作用对菊苣根粗提物的质量浓度有依赖性,不同质量浓度下菊苣根粗提物的抑制效果分别是:40.5 g/L时16种处理的抑制率均高于对应组的其他质量浓度;13.5 g/L时各处理的抑制作用显著(P<0.05);4.5、1.5和0.5 g/L时除少数抑制作用不显著外,其他均抑制显著(P<0.05)。菊苣根粗提物40.5 g/L时,除T5、T9、T11和T14外,其他均与2,4-D差异不显著(P>0.05),表明菊苣根粗提物在该质量浓度下显著抑制稗草发芽。
2.3菊苣根粗提物对反枝苋萌发指数的影响 表5反映了菊苣根粗提物对反枝苋萌发指数抑制率的影响。17.91%为菊苣根粗提物对反枝苋抑制作用显著性的标记(表中以粗黑体表示),抑制率在17.91%以上表明其抑制作用显著(P<0.05),菊苣根粗提物对反枝苋的促进作用较稗草强,但促进作用主要出现在较小质量浓度中。随质量浓度减小,抑制作用减弱,40.5 g/L时16种处理的抑制率均高于对应组的其他质量浓度,抑制效果显著(P<0.05);其次13.5 g/L时各处理组的抑制率均高于其余3个低质量浓度,除T14和T15外,其他抑制作用均显著(P<0.05);质量浓度为4.5 g/L时,除T2、T3、T4、T8、T12和T16外,其余无抑制作用或有利发芽;0.5 g/L时仅T2、T8、T12和1.5 g/L时T4、T8、T12抑制显著。T4、T8、T12和T16的质量浓度为13.5 g/L,T4、T8和T12的质量浓度为4.5 g/L时的抑制率依然与2,4-D有等效(P>0.05)结果。

表4 菊苣根粗提物对稗草萌发指数的抑制率及与2,4-D的比较
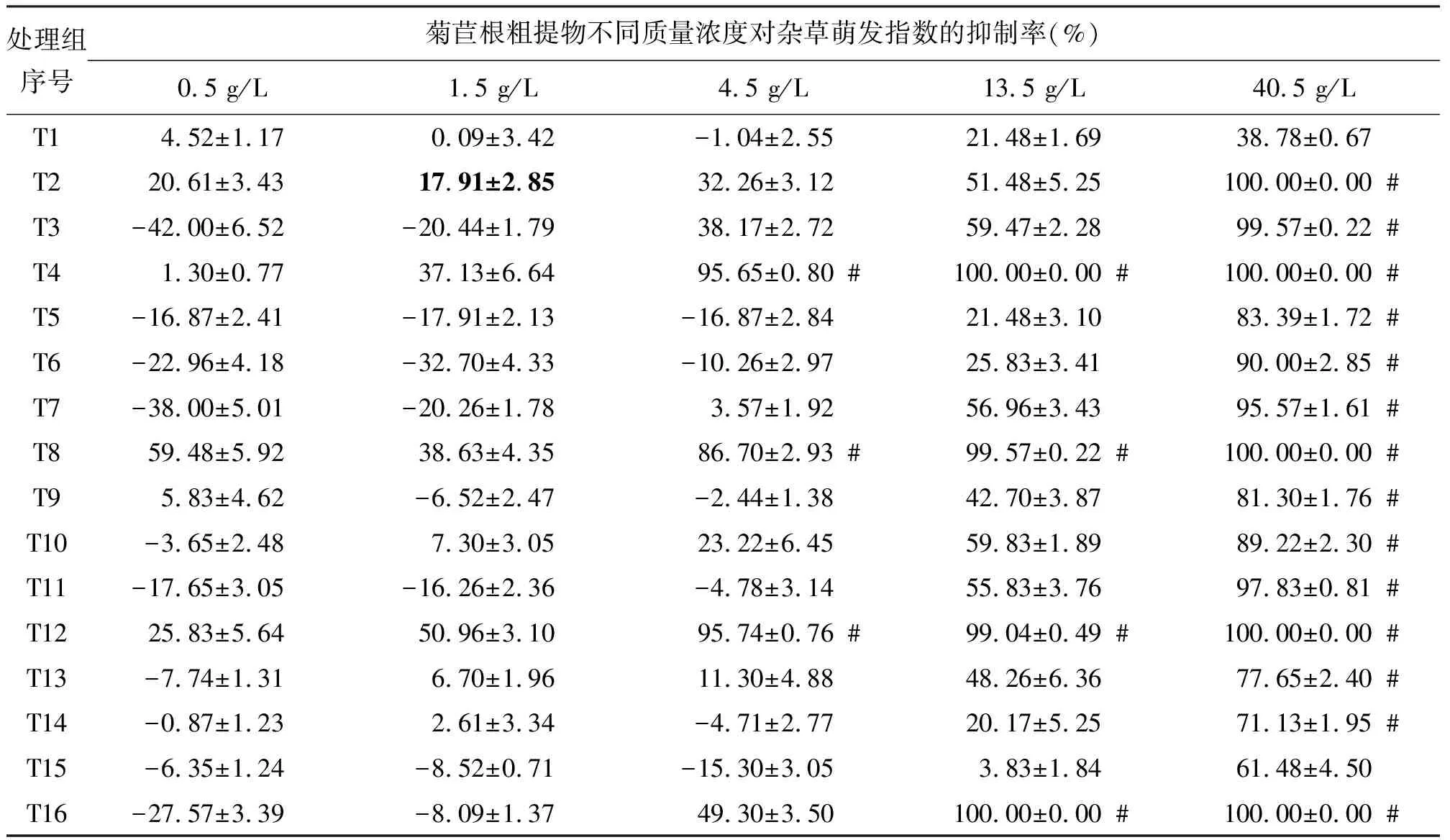
表5 菊苣根粗提物对反枝苋萌发指数的抑制率及与2,4-D的比较
3 讨论与结论
超声波辅助提取的文献在近几年研究较多,且多数研究了最佳提取条件的组合,如超声波辅助提取淫羊藿(Epimediumbrevicornu)叶片中的朝霍定C[24],超声波辅助提取姜味草(Micromeriabiflora)中的熊果酸和齐墩果酸[25]等,本研究的目的之一也是利用超声波辅助提取,考察多因素对菊苣根粗提物的影响,进而对各因素进行条件优化。空列的极差明显小于其他因素的极差,充分显示本试验设计的正确和合理。水是一种极性大、无污染的常用溶剂[26],用水做溶剂研究植物提取物活性的相关文献有:苍耳(Xanthiumsibiricum)水提取物对不同植物幼苗萌发的抑制作用[27];水提取肿柄菊(Tithoniadiversifolia)鲜茎和鲜根中的活性物质研究其化感作用[28];糙石芥(Moslascabra)水提取物已被证明有抵抗流感病毒的功效[29]等。乙醇是一种极性适中的重要溶剂,孙娈姿等[30]曾用3种溶剂包括无水乙醇提取菊苣根,发现无水乙醇对其试验中的几种草抑制最好。所以本研究结合水无污染、来源丰富、极性大和乙醇极性适中易溶于水等特点,将乙醇体积分数设为提取因素之一。菊苣根粗提物的提取结果显示:T1、T5、T9和T13的提取率普遍高于其他(表2),由正交表可看出该4个处理组均是乙醇体积分数为0,即水的提取条件最好。与某些文献报道结果有异,例如Khan等[31]得出80%乙醇溶液对橘子皮中的多酚提取最佳,分析原因可能有三,一是水的极性大,二是研究材料菊苣根中含大量糖,糖恰易溶于水,三是本试验研究的提取物是粗提物。其他条件优化参数均有相关文献报道,如超声温度65℃[32],浸泡时间24 h[33],浸泡2次[12],超声时间30 min[34]等。
近年来,植物活性物质的研究日益深入,应用广泛,已不仅仅停留于药用价值[35],而已推广到除草[20]、杀虫[36]和杀菌[18]等。植物源农药是人类历史上最古老的生物农药之一,化学农药的发展在一定程度上有赖于植物源农药,但是大量化学农药的不合理使用,导致农产品的污染日益严重[37],随着对植物源农药更进一步的认识,植物再度成为开发新的无污染天然农药的宝贵资源[38]。植物的各个器官或组织中均含有多种化合物,其中某些化合物就是用于保护自己、抑制他物的,例如生物碱[39],精油[18]等已被证实有除草功能,其中从草本植物中提取精油是植物资源开发利用价值之一[40]。根是植物的重要器官,也是研究提取活性物质的重要对象之一[41]。本研究结果显示,16种不同处理下的菊苣根粗提物对稗草和反枝苋均有除草活性,且部分处理组与2,4-D (1 g/L) 有等效功能。2,4-D是一种常见且重要的除草剂,但研究发现2,4-D对鱼类有毒性[42],随着对农药使用的严格要求,菊苣根提取物作为植物源除草剂比2,4-D有优势。
综上所述,本研究的试验设计合理,提取结果可靠,证明了超声波辅助提取是快速提取的有效工具之一。随着对环境无污染友好型农药研究的必然趋势,以及根据研究得出的菊苣根粗提物有除草活性的结果可见,菊苣根提取物具有开发作为天然除草剂的潜力。
[1] 王佺珍,崔健.牧草菊苣及其利用潜力Ⅱ利用价值和开发潜力[J].草业科学,2010,27(2):150-156.
[2] Hazra B,Sarkar R,Bhattacharyya S,etal.Tumour inhibitory activity of chicory root extract against Ehrlich ascites carcinoma in mice[J].Fitoterapia,2002,73(7/8):730-733.
[3] Cavin C,Delannoy M,Malnoe A,etal.Inhibition of the expression and activity of cyclooxygenase-2 by chicory extract[J].Biochemical and Biophysical Research Communications,2005,327(3):742-749.
[4] Hassan A,Rahman S,Deeba F,etal.Antimicrobial activity of some plant extracts having hepatoprotective effects[J].Journal of Medicinal Plants Research,2009,3(1):20-23.
[5] Schmidt B M,Ilic N,Poulev A,etal.Toxicological evaluation of a chicory root extract[J].Food and Chemical Toxicology,2007,45(7):1131-1139.
[6] Chen Q H,Fu M L,Liu J,etal.Optimization of ultrasonic-assisted extraction (UAE) of betulin from white birch bark using response surface methodology[J].Ultrasonic Sonochem,2009,16(5):599-604.
[7] Portugal F C M,Pinto M L,Nogueira J M F.Optimization of Polyurethane foams for enhanced stir bar sorptive extraction of Triazinic herbicides in water matrices[J].Talanta,2008,77(2):765-773.
[8] 中国现场统计研究会农业优化组.农业正交设计法[M].北京:冶金工业出版社,1994.
[9] Martin J A,Santos M,de Lope J.Orthogonal variant moments features in image analysis[J].Information Sciences,2010,180(6):846-860.
[10] 李典鹏,张厚瑞,陈海珊,等.植物源农药的研究利用[J].广西植物,2003,23(4):373-378.
[11] 郭永霞,孔祥清.天然除草活性化合物研究进展[J].植物保护,2005,31(6):11-16.
[12] Diouf P N,Stevanovic T,Boutin Y.The effect of extraction process on polyphenol content,triterpene composition and bioactivity of yellow birch (BetulaalleghaniensisBritton) extracts[J].Industrial Crops and Products,2009,30(2):297-303.
[13] 余永涛,王建华,付广建,等.毛瓣棘豆结荚期营养成分及其矿质元素含量[J],草业科学,2008,25(5):48-51.
[14] Guo X S,Zhang D,Wu J R.Quantitative evaluation of contact stiffness between pressed solid surfaces using dual-frequency ultrasound[J].Journal of Applied Physics,2010,108(3):(034902-1)-(034902-6).
[15] Hedayat A S,Sloane N J A,Stufken J.Orthogonal Arrays:Theory and Applications[M].New York:Springer-Verlay,1999:363.
[16] Jimoh F O,Adedapo A A,Afolayan A J.Comparison of the nutritional value and biological activities of the acetone,methanol and water extracts of the leaves ofSolanumnigrumandLeonotisleonorus[J].Food and Chemical Toxicology,2010,48(3):964-971.
[17] Seal A N,Pratley J E,Haig T J,etal.Plants with phytotoxic potential:Wollemi pine (Wollemianobilis)[J].Agriculture,Ecosystems & Environment,2010,135(1-2):52-57.
[18] Kordali S,Cakir A,Akcin T A,etal.Antifungal and herbicidal properties of essential oils and n-hexane extracts ofAchilleagypsicolaHub-Mor.andAchilleabiebersteiniiAfan.(Asteraceae)[J].Industrial Crops and Products,2009,29(2-3):562-570.
[19] 袁莉,于磊,王许军,等.不同年限紫花苜蓿的浸提液对棉花的化感作用及其化感物质含量[J].草业科学,2008,25(12):71-74.
[20] Kordali S,Cakir A,Ozer H,etal.Antifungal,phytotoxic and insecticidal properties of essential oil isolated from TurkishOriganumacutidensand its three components,carvacrol,thymol and p-cymene[J].Bioresource Technology,2008,99(18):8788-8795.
[21] Goncalves S,Ferraz M,Romano A.Phytotoxic properties ofDrosophyllumlusitanicumleaf extracts and its main compound plumbagin[J].Scientia Horticulturae,2009,122(1):96-101.
[22] Yang J A,Lu C Y.Possible mechanism associated with herbicidal activity of soybean meal hydrolysate (SMH)[J].Agricultural Sciences in China,2010,9(6):854-860.
[23] 胡晋.种子生物学[M].北京:高等教育出版社,2006.
[24] Zhang H F,Yang X H,Zhao L D,etal.Ultrasonic-assisted extraction of epimedin C from fresh leaves ofEpimediumand extraction mechanism[J].Innovative Food Science & Emerging Technologies,2009,10(1):54-60.
[25] Li K P,Pan T L,Bi Y G,etal.Ultrasonic-assisted solvent extraction of ursolic acid and oleanolic acid fromMicromeriabifloraBenth[J].Chemistry and Industry of Forest Products,2009,29(3):111-114.
[26] 卢晓江.中药提取工艺与设备[M].北京:化学工业出版社,2004.
[27] 高兴祥,李美,高宗军,等.苍耳对不同植物幼苗的化感作用研究[J].草业学报,2009,18(2):95-101.
[28] Otusanya O O,Ikonoh O W,Ilori O J.Allelopathic potentials ofTithoniadiversifolia(Hemsl) A.Gray:Effect on the germination,growth and chlorophyll accumulation ofCapsicumannumL.andLycopersiconesculentumMill[J].International Journal of Botany,2008,4(4):471-475.
[29] Yu C H,Yan Y L,Wu X N,etal.Anti-influenza virus effects of the aqueous extract fromMoslascabra[J].Journal of Ethnopharmacology,2010,127(2):280-285.
[30] 孙娈姿,呼天明,王佺珍.菊苣根提取物除草活性的研究[J].草地学报,2010,18(3):473-476.
[31] Khan M K,Abert-Vian M,Fabiano-Tixier A S,etal.Ultrasound-assisted extraction of polyphenols (flavanone glycosides) from orange (CitrussinensisL.) peel[J].Food Chemistry,2010,119(2):851-858.
[32] Abdeleraleil S A M,Abdel-Razeek N,Soliman S A.Herbicidal activity of three Sesquiterpene Lactones on Wild Oat (Avenafatua) and their possible mode of action[J].Weed Science,2009,57(1):6-9.
[33] Burghoff B,Marques J S,van Lankvelt B M,etal.Solvent impregnated resins for MTBE removal from aqueous environments[J].Reactive and Functional Polymers,2010,70(1):41-47.
[34] Zhang H F,Yang T S,Li Z Z,etal.Simultaneous extraction of epimedin A,B,C and icariin from Herba Epimedii by ultrasonic technique[J].Ultrasonics Sonochemistry,2008,15(4):376-385.
[35] Ali R,Athar M,Abdullah U,etal.Nutraceuticals as natural healers:Emerging evidences[J].African Journal of Biotechnology,2009,8(6):891-898.
[36] Xuan T D,Yuichi O,Junko C,etal.Kava root (PipermethysticumL.) as a potential natural herbicide and fungicide[J].Crop Protection,2003,22(6):873-881.
[37] 占胜利,朱朝华,邱庆军.植物源农药与农产品质量安全[J].广西热带农业,2008(3):21-23.
[38] 杨叶,吴智彪,黄圣明.农药发展中的问题及前景[J].华南热带农业大学学报,2003,9(2):26-31.
[39] 李家玉,王海斌,林志华,等.植物次生代谢物的结构、生物合成及其功能分析——生物碱[J].农业科学研究,2009,30(4):68-72.
[40] 魏小兰,张蕴薇.草本植物的非典型性应用[J].草业科学,2009,26(9):34-39.
[41] Sivakumar V,Anna J L,Vijayeeswarri J,etal.Ultrasound assisted enhancement in natural dye extraction from beetroot for industrial applications and natural dyeing of leather[J].Ultrasonic Sonochem,2009,16(6):782-789.
[42] Gabriel U U,Macaulay B K,Edori O S.Acute toxicity and behavioural responses of African Catfish,Clariasgariepinusto amine salt of 2,4-D[J].Chinese Journal of Applied and Environmental Biology,2010,16(3):347-352.
