苜蓿丝氨酸蛋白水解酶及青贮时对蛋白降解作用的研究
2011-04-25郭旭生
程 巍,郭旭生
(1.兰州大学草地农业科技学院,甘肃 兰州 730020; 2.兰州大学生命科学学院 干旱与草地生态教育部重点实验室,甘肃 兰州730000; 3.兰州大学青藏高原生态系统管理国际中心,甘肃 兰州 730000)
苜蓿(Medicagosativa)是我国北方地区主要的豆科牧草,以蛋白含量高[1]、适口性好而被称为“牧草之王”,其主要利用方式有干草调制和青贮两种。在我国华北地区,苜蓿第2茬收割时恰逢雨季,不利于干草的调制,而青贮则不受天气的限制,还可以保持苜蓿的青绿特性,是苜蓿利用较为理想的方法[2]。但苜蓿在青贮发酵过程中,因自身所含蛋白酶和微生物酶的作用,大部分真蛋白被分解成非蛋白氮(non-protein nitrogen,NPN),青贮后苜蓿中NPN含量为总氮的44%~87%[3]。与蛋白氮相比,大部分NPN在瘤胃中进一步快速降解形成大量的NH3,并经瘤胃壁吸收后在肝脏中合成尿素,大部分以尿氮的形式排出体外[4-5],这样青贮苜蓿不能体现高蛋白牧草的特性。另外,蛋白大量分解为NPN也会导致家畜对干物质采食量及日粮总氮利用率降低[6-7]。因此,明确NPN产生的原因,了解苜蓿在青贮过程中蛋白的降解机制并加以调控,是提高苜蓿等豆科牧草青贮饲料品质的关键问题[8-9]。
研究表明[10],苜蓿在青贮过程中,对蛋白水解起主要作用的是植物蛋白酶。就其种类而言,根据蛋白酶降解蛋白作用于肽链的位置,将蛋白酶分肽链外切酶和肽链内切酶两类。目前普遍认为[12]植物体蛋白质的降解是先由肽链内切酶起作用,内肽酶首先将蛋白质水解成小肽,小肽再由外肽酶将其水解成氨基酸,然后被运输或贮存到其他部位。所以,内肽酶活性增强可能是植物蛋白质含量下降的主要原因[13-14]。而前人[15]发现,植物中主要的内切酶为半胱氨酸或天门冬氨酸型内肽酶,在黑麦草(Loliumspp.)青贮时加入天冬氨酸肽酶、半胱氨酸肽酶以及金属肽酶抑制剂能够抑制青贮料中蛋白的降解程度[16-17]。
目前关于丝氨酸的研究中,人们发现了丝氨酸内肽酶在植物衰老过程中起促进作用[18],并认为丝氨酸内肽酶参与了植物超敏反应、信号转导等过程[19],但丝氨酸蛋白酶对蛋白降解的作用机理鲜有报道。本研究以绿汁发酵液的形式模拟青贮发酵的过程,旨在了解苜蓿中丝氨酸蛋白酶的特性,进而探讨丝氨酸蛋白酶对苜蓿青贮过程中蛋白水解形成NPN及其各组分的相关机制。
1 材料与方法
1.1试验材料 供试材料为紫花苜蓿品种阿尔冈金第2茬初花期材料(由加拿大引进),由兰州大学榆中校区草地农业科技学院苜蓿试验基地(35.946° N,104.037° E)提供。丝氨酸蛋白酶抑制剂——苯甲基磺酰氟[16](PMSF),由sigma公司生产。
1.2试验方法
1.2.1材料处理 于2009年6月末在试验地刈割取样,分装后将样品置于液氮中,运至实验室于-80℃保存。测定时分别取出分装好的样品,每个样品只解冻一次,不重复使用。
1.2.2酶液的提取 将5 g 样品放入研钵中,加入液氮研磨成粉状,之后加入20 mL 25 mmol/L的Tris-HCl缓冲液,pH值7.5,含有体积分数为1%的聚乙烯吡咯烷酮(polyvinylpolypyrrolidone,PVP)和0.1%的β-巯基乙醇。充分研磨后用4层纱布过滤并在4℃条件下20 000 g离心10 min。上清液通过Sephadex G-25(凝胶)柱脱盐[20]。收集滤液用于酶活性的测定。以上步骤均在4℃的条件下进行,酶液现做现用。
1.2.3丝氨酸蛋白酶活性的测定 酶反应体系由两部分组成:体积分数为0.2%的N-Succinyl-Ala-Ala-Pro-Phe-pNA底物溶液(溶于25 mmol/L Tris-HCl,pH值7.4)1 mL;在4℃下反应1 h的粗酶液+各浓度梯度的PMSF(溶解于二甲基亚砜,DMSO)抑制剂的混合液0.2 mL。将二者混合在37℃条件下反应2 h后,加入质量分数5%的三氯乙酸(TCA)2 mL,室温静置30 min后,15 000 g离心5 min,取上清液,紫外分光光度计在405 nm比色[20],酶活性的变化以吸光值表示。
测定前,将底物溶液置于20~90℃温度的水浴内先预热10 min,以保证反应开始的温度;之后加入酶液-抑制剂混合液,在所设温度的水浴中保温2 h。在pH值为3.0~8.4时,测定丝氨酸蛋白酶的活性(在pH值3~6使用的为磷酸氢二钠-磷酸二氢钠缓冲液;pH值6.6~8.4为Tris-HCl缓冲液)。
1.2.4绿汁发酵液的制作 将苜蓿剪碎放入榨汁机[21],加入苜蓿质量4倍的水榨汁,用4层纱布过滤后将滤液离心(1 000 g,1 min)。取上清液,加入同体积体积分数为1%的葡萄糖溶液后,将其分装于20 mL的螺口试管中分别加入抑制剂。处理组加入最终浓度为5 mmol/L的PMSF;对照组加入等量的抑制剂溶剂DMSO(使每份绿汁发酵液中含有相同比例的发酵液和DMSO),密封后在30℃恒温培养14 d。在发酵第0、0.5、1、2、3、5、7天和14天分别取样进行测定,每个处理重复3次。
1.2.5氮组分的测定 取未发酵的绿汁发酵液5 mL,用凯氏定氮法测定总氮含量的[22];用体积分数为5%三氯乙酸对绿汁发酵液进行沉淀,取1.5 mL上清液,用微量凯氏定氮法测定NPN的氮含量[23];采用茚三酮-硫酸肼比色法测定样品中游离氨基酸氮含量;苯酚-次氯酸钠比色法测定样品中氨态氮含量[24];按照公式计算样品中肽氮的含量。
肽氮含量=非蛋白氮含量-(游离氨基酸氮含量+氨态氮含量)。
可溶性蛋白含量的测定:以牛血清蛋白(BSA)为标准,用Lowry法[25]测定(北京索莱宝科技有限公司试剂盒)。
1.3数据处理 用SPSS (17.0版)的配对T检验进行数据统计。
2 结果与分析
2.1苜蓿丝氨酸蛋白酶的特性
2.1.1抑制剂浓度对酶活性的影响 随着PMSF浓度的增加,丝氨酸蛋白酶的活性逐渐下降,当PMSF在酶液中的浓度达到5 mmol/L时,苜蓿中丝氨酸蛋白酶的活性被完全抑制(图1)。
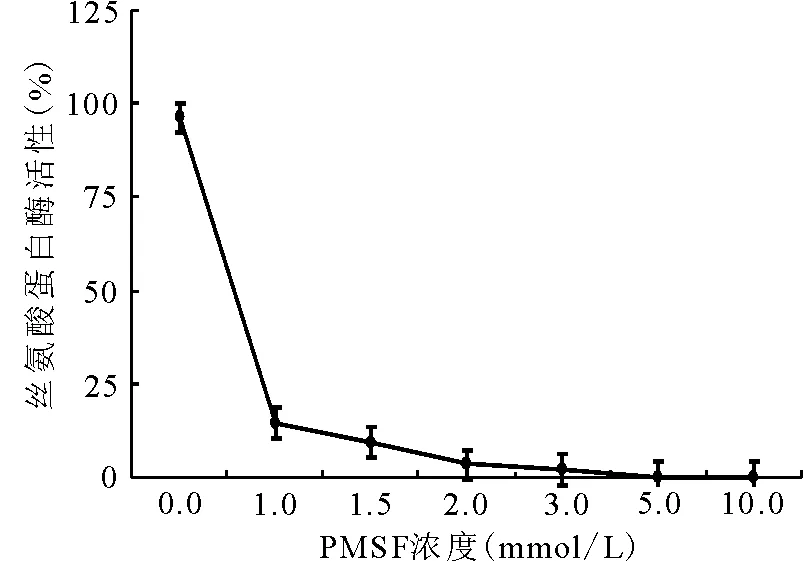
图1 不同PMSF浓度对丝氨酸蛋白酶活性的影响
2.1.2温度对酶活性的影响 丝氨酸水解酶的最适温度为45℃,之后随着温度的增高其活性逐渐降低(图2)。
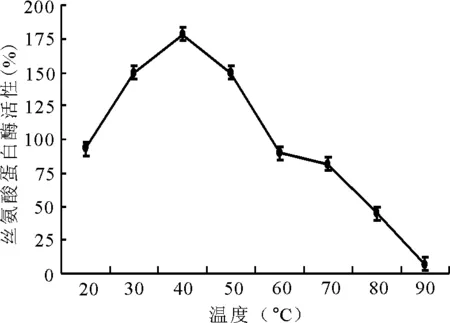
图2 不同温度对丝氨酸蛋白酶活性的影响
2.1.3pH值对酶活性的影响 随pH值的增加,酶活性呈“双峰”型变化,在pH值为6.6时,丝氨酸蛋白酶活性最高(图3)。
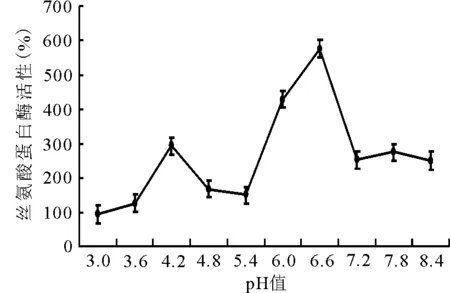
图3 不同pH值对丝氨酸蛋白酶活性的影响
2.2丝氨酸蛋白酶对苜蓿绿汁发酵液中氮组分的影响
2.2.1绿汁发酵液pH值的动态 对照组的pH值在绿汁发酵液发酵的第2天由6.3降为4.5左右,随后变幅较小(图4)。而PMSF处理组的pH值总体上缓慢下降,第14天时为4.9左右,极显著高于对照组(P<0.01)。
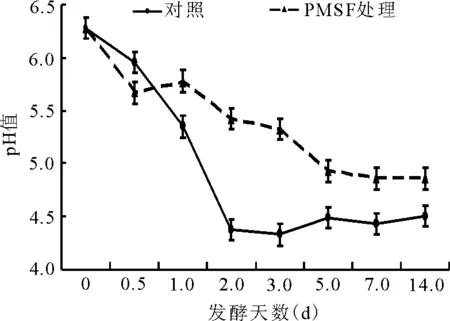
图4 绿汁发酵液pH值的动态
2.2.2非蛋白氮占总氮比例的动态 试验前期NPN含量变化较大(图5),对照组的NPN含量从156 g/kg升高到351 g/kg;而PMSF处理对NPN抑制作用始于12 h以后,至第14天,PMSF处理组NPN的含量极显著(P<0.01)低于对照组(图5)。
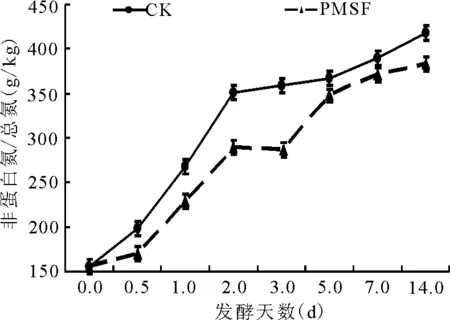
图5 总氮中非蛋白氮的动态
2.2.3氨态氮占总氮比例的动态 对照组的氨态氮始见于发酵后的12 h,随后于2 d内迅速升高;而PMSF添加处理组的氨态氮在第3天过后才开始形成,发酵至第14天,其含量仍极显著(P<0.01)低于对照组(图6)。
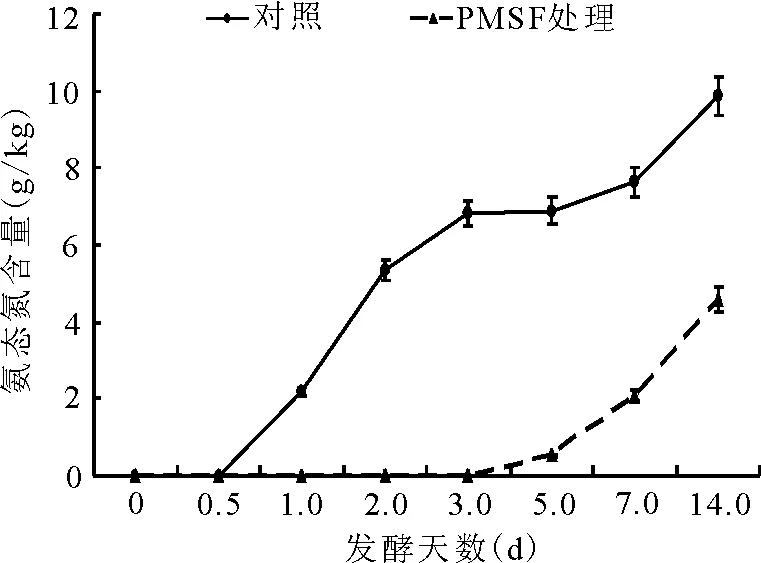
图6 总氮中氨态氮的动态
2.2.4游离氨基酸占总氮比例的动态 发酵初期(前2天)游离氨基酸含量增加缓慢,自第2天至第5天增加最多。对照组从72 g/kg增加至140 g/kg;而此期间,PMSF处理组的游离氨基酸含量始终低于对照组,至发酵第14天,PMSF处理组显著(P<0.01)低于对照组(图7)。
2.2.5肽氮占总氮比例的动态 肽氮总体的变化趋势为第1天增加,第2天减少;且前3 d内,PMSF处理组的肽氮含量小于对照组;3d后,两者的肽氮含量都是呈先增后减再增的状态。第14天,PMSF处理组的肽氮含量极显著(P<0.01)高于对照组(图8)。
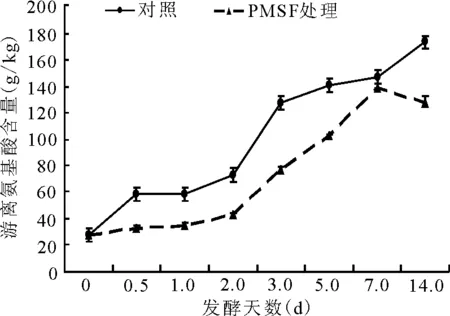
图7 总氮中游离氨基酸的动态
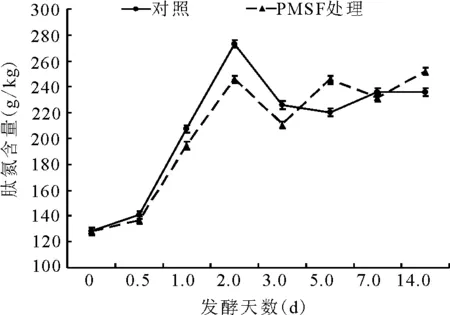
图8 总氮中肽氮的动态变化
2.3可溶性蛋白质的动态 对照组可溶性蛋白(BSP)含量在第1天内,由开始的8.1 g/L迅速减少至5.2 g/L,随后的13 d内逐渐减少;PMSF处理组的BSP含量在12 h下降后略有升高,而后趋于平缓下降。在第14天,PMSF处理组的可溶性蛋白的含量极显著(P<0.01)高于对照组(图9)。
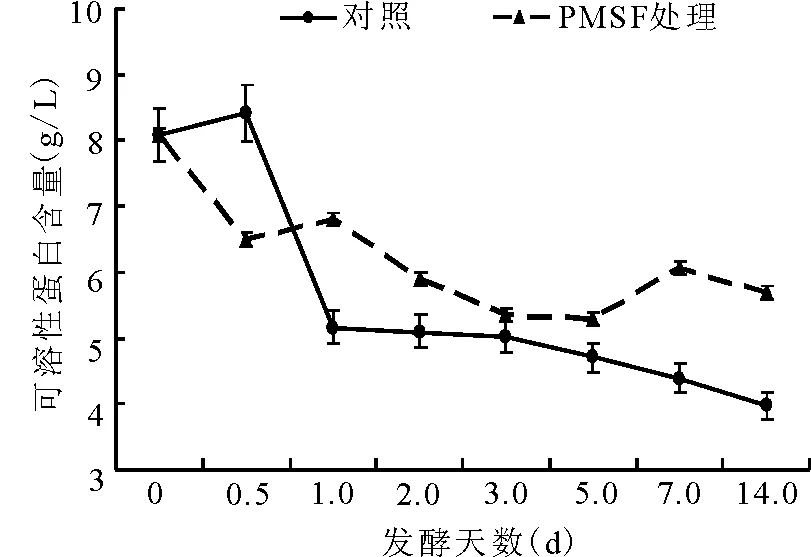
图9 可溶性蛋白含量的动态变化
3 讨论
苜蓿青贮发酵过程中可溶性蛋白被大量降解为非蛋白氮,对蛋白进一步在反刍动物瘤胃中降解利用带来不利影响。本研究表明,5 mmol/L的苯甲基磺酰氟可以完全抑制丝氨酸蛋白酶的活性,这与James等[26]测玉米(Zeamays)中所得出的结果相同,高于Arulmani等[27]在芽孢杆菌中使用2 mmol/L苯甲基磺酰氟完全抑制其活性的结论,这可能是由于不同物种中的丝氨酸蛋白酶含量不同所造成的。苯甲基磺酰氟处理组的可溶性蛋白含量均显著高于对照组,说明丝氨酸蛋白酶对蛋白降解有作用,且苯甲基磺酰氟抑制剂的添加阻止其对蛋白的降解作用。
在绿汁发酵液发酵的过程中pH值有上下浮动的现象,这可能是由于蛋白酶的降解,影响了青贮饲料pH值的稳定[26]。总体看来,在前3 d,pH值呈下降趋势,随后对照和苯甲基磺酰氟处理组的pH值基本呈平稳状态,到7 d以后pH值维持在4.5左右,这与前人在苜蓿青贮实验中的结果相似[28]。有研究表明[29-30],较低的pH值可以对蛋白的降解作用有抑制效果。丝氨酸蛋白酶的最适pH值为6.6,发酵2 d后对照的pH值为4.5,苯甲基磺酰氟处理的pH值在5.5左右,但是第2天时,苯甲基磺酰氟处理的非蛋白氮含量却低于对照组,说明丝氨酸蛋白酶是苜蓿发酵过程中对非蛋白氮起作用的内肽酶的一种,即使在蛋白酶活性更合适的pH值下也没有大量将蛋白分解成非蛋白氮。苯甲基磺酰氟添加处理组的非蛋白氮含量比对照减少8.2%;从肽氮的动态变化中可以看出,在第3天后,苯甲基磺酰氟处理的肽氮含量一直大于对照组;在发酵14 d后,肽氮的含量比对照增加7%左右,这说明丝氨酸蛋白酶在绿汁发酵液中对苜蓿蛋白降解成非蛋白氮和肽氮的过程中贡献率较少。但苯甲基磺酰氟处理的游离氨基酸含量一直低于对照组的含量,在第14天时其含量比对照组低27%;从氨态氮的动态变化中也能看到,直到发酵第3天后,在苯甲基磺酰氟处理组中才测到氨态氮的存在,而有研究[26]表明,在青贮发酵的过程中,微生物的作用可以产生大量氨态氮,而植物蛋白酶的作用相对较小,所以苯甲基磺酰氟添加处理组在3 d后出现的氨态氮,可能并非由于丝氨酸蛋白酶的作用,而是由于某些微生物的作用形成的。
内肽酶在苜蓿青贮发酵过程中对蛋白的降解作用是造成蛋白损失的重要部分,丝氨酸蛋白酶仅是其中一种,进一步研究苜蓿其他内肽酶的特性和对蛋白降解的作用机理,以及各种内肽酶之间的相互作用,可为探讨有效抑制苜蓿青贮蛋白降解的方法提供重要的科学依据。
[1] 李瑞琴,于安芬,水蓉,等.苜蓿蛋白质分组测定初探[J].草业科学,2009,26(5):99-102.
[2] 孙小龙,李平,周禾,等.苜蓿与玉米秸秆混贮的研究[J].草业学报,2009,18(5):86-92.
[3] Papadopoulos Y A,Mckersie B D.A comparison of protein degradation duriong wilting and ensiling of six forage species[J].Canadian Journal of Plant Science,1983,63:903-912.
[4] Rooke J A,Armstromg D G.The importance of the form of nitrogen on microbial protein synthesis in the rumen of cattle receiving grass silage and intrarumen infusions of sucrose[J].British Journal of Nutrition,1989,61:113-121.
[5] Givens D I,Rulquin H.Utilization by ruminants of nitrogen compounds in silage-based diets[J].Animal Feed Science and Technology,2004,114(1):1-18.
[6] 姜旭明,齐智利,齐德生,等.不同蛋白质来源的日粮对瘤胃发酵特性及蛋白质消化的影响[J].草业科学,2009,26(1):74-80.
[7] Owens V N,Albrecht K A,Muck R E.Protein degradation and fermentation characteristics of red clover and alfalfa silage harvested with varying levels of total nonstructural carbohydrates[J].Crop Science,1999,39:1873-1880.
[8] 郭旭生,周禾,刘桂霞.苜蓿青贮过程中蛋白的降解及抑制方法[J].草业科学,2005,22(11):46-50.
[9] 张鹏,王飞,张列峰,等.丝氨酸内肽酶在黄瓜叶片衰老中的作用[J].植物生理与分子生物学学报,2006,32(5):593-599.
[10] Rooke J A,Hatfield R D.Biochemistry of ensiling[A].In:Buxton D R,Muck R E,Harrison J H.Silage science and technology[M].Madison,WI,USA:ASA-CSSA-SSSA,2003:133.
[11] Slottner D,Bertilsson J.Effect of ensiling technology on protein degradation during ensilage[J].Animal Feed Science and Technology,2006,127:101-111.
[12] Gan S,Amasino R M.Making sense of senescence:molecular genetic regulation and manipulation of leaf senescence[J].Plant Physiology,1997,113:313-319.
[13] Beers E P,Woffenden B J,Zhao C S.Plant proteolytic enzymes:possible roles during programmed cell death[J].Plant Molecular Biology,2000,44:399-415.
[14] Domínguez F,Cejudo F J.Pattern of endoproteolysis following wheat grain germination[J].Physiologia Plantarum,1995,95:253-259.
[15] Wetherall J A,Armstrong D G,Finlayson H J.Reduction of proteolysis during ensilage of perennial ryegrass by protease inhibitors[J].Journal of the Science Food and Agriculture,1995,68:497-505.
[16] Nsereko V L,Rooke J A.Effects of peptidase inhibitors and other additives on fermentation and nitrogen distribution in perennial ryegrass silage[J].Science Food Agriculture,1999,79:679-686.
[17] Jiang W B,Lers A,Lomaniec E,etal.Senescence related serine protease in parley[J].Phytochemistry,1999,50:377-382.
[19] Wang B,Wu W P,Liu X Z.Purification and characterization of a neutral serine protease with nematicidal activity fromHirsutellarhossiliensis[J].Mycopathologia,2007,163:169-176.
[20] Feller U K,Soong T S,Hageman R H.Leaf proteolytic activities and senescence during grain development of field-grown corn (ZeamaysL.) [J].Plant Physiology,1977,59:290-294.
[21] 徐庆方,玉柱,李胜利,等.甲酸或绿汁发酵液对苜蓿青贮影响的研究[J].畜牧兽医学报,2008,39(12):1709-1714.
[22] 谢飞文.凯氏定氮法测定饲料粗蛋白的注意细节[J].饲料广角,2003,14:17-18.
[23] Licitra G,Mernandez T M,Van Soest P J.Standardization of procedures for nitrogen fractionation of ruminant feed[J].Animal Feed Science Technology,1996,57:347-358.
[24] Broderick G A,Kang J H.Automated simultaneous determination of ammonia and total amino acid in ruminal fluid and in vitro media[J].Journal of Dairy Science,1980,63:64-75.
[25] 李海玲,彭书明,李凛,等.4种常用蛋白浓度测定方法的比较[J].中国生化药物杂志.2008,29(4):277-282.
[26] James F,Brouquisse R,Suire C,etal.Purification and biochemical characterization of a vacuolar serine endopeptidase induced by glucose starvation in maize roots[J].Biochemical Journal,1996:320:283-292.
[27] Arulmani M,Aparanjini K,Vasanthi K,etal.Purification and partial characterization of serine protease from thermostable alkalophilic Bacillus laterosporus-AK1[J].World Journal of Microbiology and Biotechnology,2007,23:475-481.
[28] Ohshima M,McDonal P.A review of the changes in nitrogenous compounds of herbage during ensilage[J].Journal of the Science of Food and Agriculture,1978,29:497-505.
[29] Guo X S,Zhou H,Zhu Y,etal.Changes in the distribution of nitrogen and plant enzymatic activity during ensilage of Lucerne treated with different additives[J].Grass and Forage Science,2007,62:35-43.
[30] Jones B A,Hatfield R D,Muck R E.Characterization of proteolysis in alfalfa and red clover[J].Crop Science,1995,35:537-541.
