不同含水量紫花苜蓿种子卫星搭载后植株叶片保护酶活性的研究
2011-04-25马学敏张治安张蕴薇高洪文庞莹莹杨世超
马学敏,张治安,邓 波,张蕴薇,高洪文,庞莹莹,杨世超,刘 蒙
(1.吉林农业大学,吉林 长春 130118; 2.中国农业大学动物科学学院草地研究所,北京100193;3.中国农业科学院北京畜牧兽医研究所,北京 100193)
航天诱变育种又称空间诱变育种,是指利用卫星、飞船等返回式航天器或高空气球将植物种子、组织、器官或生命个体搭载到宇宙中,利用太空特殊的环境(空间宇宙射线、微重力、高真空、弱磁场等因素)使种子产生变化,引起生物体染色体畸变,进而导致生物体遗传变异,经地面种植选育新种质、新材料,培育新品种的植物育种新技术[1-2]。紫花苜蓿(Medicagosativa)是重要的豆科牧草之一,具有较高的经济价值。因其具有高蛋白、强固氮能力等优点,被冠以“牧草之王”的美誉[3]。目前关于苜蓿空间诱变方面的研究主要集中在发芽率[4]、株高[5]、过氧化物同工酶[6]、细胞学效应[7-9]等方面。但在抗氧化酶及相关物质等生理方面的研究鲜见报道。以不同种子含水量紫花苜蓿卫星搭载后与未搭载的种子生长的植株叶片为研究对象,通过对保护酶活性及丙二醛含量的测定,探讨航天诱变对其抗氧化酶系及相关物质的影响,以及种子水分含量对空间诱变结果的影响,为选育新的抗性品种提供一定的依据。
1 材料与方法
1.1材料 供试材料为紫花苜蓿“中苜一号”种子,经卫星搭载后第一代(SP1)第3年龄植株。材料由中国农业大学草地研究所提供。
1.2方法
1.2.1种子水分预处理 参考韩建国[10]的研究方法,将原始含水量为9%的供试牧草种子分为5份,每份2.5 g。将待处理的种子装入铝箔袋中,按公式计算出使含水量达到9%、11%、13%、15%和17%时分别应加的水量,含水量计算公式如下:
W2=W1×(100-A)/(100-B)
式中,A为种子初始含水量(%);B为所要达到的含水量(%);W1为称取的种子质量(g);W2为种子加水后质量(g);所需加水量(mL)为W2-W1。
用微量注射器将所需的水量分别注入铝箔袋中,封口后轻微晃动使种子与水均匀混合,水平置于25℃恒温培养箱中24 h。
1.2.2卫星搭载处理 将经过处理的种子分为两份,一份种子封入布袋进行搭载(SP),“实践八号”育种卫星于2006年9月9日在酒泉卫星发射中心升空,卫星在近地点187 km、远地点463 km的近地轨道运行,于9月24日返回地面。另一份作地面对照(CK),贮存于地面温湿度相近(20℃左右)的环境中。2008年5月将两份种子在实验室中发芽,6月移栽到中国农业大学上庄试验站。于2010年4月底,以当代(SP1)第3年龄植株为试验对象,在分枝期取植株中上部叶片作为试验材料,测定叶片超氧化物歧化酶 (SOD)、过氧化氢酶(CAT)、过氧化物酶 (POD)活性及丙二醛(MDA)含量。
1.3测定方法 SOD、CAT、POD活性的测定:称取叶片0.5 g,放入预冷的研钵中,加入1 mL预冷的酶提取液(50 mmol/L的磷酸缓冲液,pH值7.8),研磨成匀浆,加缓冲液使终体积为5 mL。在4℃条件下以12 000 r/min离心15 min。取上清液定容至5 mL,取其中1 mL稀释至10 mL后用于CAT及POD的测定,未稀释溶液用于SOD的测定。SOD活性采用NBT法[11]测定,以抑制NBT光化还原50%作为1个酶活单位(U);CAT活性采用紫外吸收法[11]测定,以每分钟内A240减少0.1的酶量为1个酶活单位(U);POD采用愈创木酚法[11]测定,以每分钟内A470变化0.01为1个酶活性单位(U)。MDA含量的测定采用硫代巴比妥酸比色法[11]测定。
1.4数据分析 试验数据使用SPSS 17.0统计软件进行显著性分析,并用Excel做图。
2 结果与分析
2.1空间诱变对植株SOD活性的影响 地面对照组(CK)之间相比,随着种子含水量的增加,植株叶片的SOD活性呈先下降后上升的变化,种子含水量为13%和15%的植株叶片SOD活性分别比9%的SOD活性降低78.33%和82.78%,差异显著(P<0.05)(图1)。卫星搭载组(SP)之间相比,随搭载种子含水量升高其植株叶片的SOD活性呈先升高后降低的变化,搭载种子含水量11%、13%和15%的植株叶片SOD活性比搭载9%的SOD活性分别提高33.16%、38.45%和36.32%,差异显著(P<0.05)。卫星搭载与地面对照组相比,种子含水量为11%、13%、15%和17%卫星搭载植株叶片的SOD活性分别比相对应种子含水量地面对照组的植株叶片的SOD活性提高61.49%、571.79%、735.48%和38.96%,差异显著(P<0.05)。种子含水量为11%、13%和15%卫星搭载植株叶片的SOD活性分别比种子含水量9%地面对照组的植株叶片SOD活性提高40.56%、45.56%和43.89%,差异显著(P<0.05)。
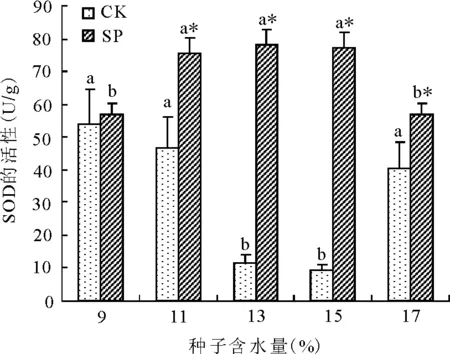
图1 不同含水量紫花苜蓿种子卫星搭载后植株叶片SOD活性的变化
2.2空间诱变对植株CAT活性的影响 地面对照组之间相比,随着种子含水量的增加,植株叶片的CAT活性呈下降变化,种子含水量为15%和17%的植株叶片的CAT活性分别比9%的CAT活性降低61.78%和59.24%,差异显著(P<0.05)(图2)。卫星搭载组之间相比,随搭载种子含水量升高,其植株叶片CAT活性呈先升高后降低的变化,搭载种子含水量13%的植株叶片的CAT活性比搭载9%的CAT活性提高44.77%,差异显著(P<0.05)。卫星搭载与地面对照组相比,种子含水量为9%、11%、13%、15%和17%卫星搭载植株叶片的CAT活性分别比相对应种子含水量地面对照组的植株叶片的CAT活性提高30.36%、30.43%、104.19%、264.44%和140.63%,差异显著(P<0.05)。种子含水量为13%和15%卫星搭载植株叶片的CAT活性分别比种子含水量9%地面对照组的植株叶片的CAT活性提高85.99%和39.28%,差异显著(P<0.05)。

图2 不同含水量紫花苜蓿种子卫星搭载后植株叶片CAT活性的变化
2.3空间诱变对植株POD活性的影响 地面对照组之间相比,随着种子含水量的增加,植株叶片的POD活性呈先下降后升高的变化,不同水分含量间虽有差异,但变化不明显,只有13%含水量显著低于15%和17%含水量的种子(P<0.05)(图3)。卫星搭载组之间相比,随搭载种子含水量升高其植株叶片的POD活性呈先升高后降低又升高的变化;搭载种子含水量13%和17%植株叶片的POD活性比搭载9%的POD活性分别提高47.99%和52.10%,差异显著(P<0.05)。卫星搭载与地面对照组相比,种子含水量为9%、13%、15%和17%卫星搭载植株叶片的POD活性分别比相对应种子含水量地面对照植株叶片的POD活性提高45.29%、252.66%、54.85%和82.65%,差异显著(P<0.05)。种子含水量为13%、15% 和17%卫星搭载植株叶片的POD活性分别比种子含水量9%地面对照的植株叶片POD活性提高115.01%、76.72%和120.99%,差异显著(P<0.05)。

图3 不同含水量紫花苜蓿种子卫星搭载后植株叶片POD活性的变化
2.4空间诱变对植株MDA含量的影响 地面对照组之间相比,随着贮藏种子含水量的增加,植株叶片MDA含量呈先上升后下降的变化,种子含水量为13%植株叶片的MDA含量比9%的MDA含量升高15.35%,差异显著(P<0.05)。卫星搭载组之间相比,随搭载种子含水量升高,其植株叶片的MDA含量呈先降低后升高的变化,搭载种子含水量13%和15%的植株叶片MDA的活性比搭载9%的MDA含量分别降低29.89%和13.45%,差异显著(P<0.05)(图4)。卫星搭载与地面对照组相比,种子含水量为13%和15%卫星搭载植株叶片的MDA活性分别比相对应种子含水量地面对照组的植株叶片MDA含量降低40.54%和25.06%,差异显著(P<0.05)。种子含水量为13%和15%卫星搭载植株叶片的MDA含量比种子含水量9%地面对照组的植株叶片MDA含量降低31.42%和15.33%,差异显著(P<0.05)。MDA的变化与保护酶的变化相一致。

图4 不同含水量紫花苜蓿种子卫星搭载后植株叶片MDA含量的变化
3 讨论与结论

本研究得出,地面对照组植株的保护酶活性及丙二醛含量在水分的影响下呈负效应,降低了植物的抗氧化能力。在空间诱变条件下,搭载种子植株的超氧化物歧化酶、过氧化氢酶和过氧化物酶的酶活性增强,丙二醛含量降低,说明卫星搭载后紫花苜蓿的抗氧化能力提高。这与Xue等[15]研究结果一致,其研究结果表明空间处理后月季(Rosachinensis)组培苗叶片中超氧化物歧化酶、过氧化氢酶和过氧化物酶的活性均有所增加,而丙二醛的含量下降。尚晨等[12]在利用高能混合粒子场的地面模拟试验中,也指出辐射增强了M2代的超氧化物歧化物酶的活性。
另外在本研究中,空间环境下不同含水量种子的植株所产生的诱变效应并不一致,这可能与空间的复杂环境(微重力、零磁空间、宇宙射线)相关。试验结果表明,超氧化物歧化酶在11%、13%和15%处理时诱变效应增强;过氧化氢酶在13%的处理效应最强;过氧化物酶则在13%和17%的处理下诱变效应最大;丙二醛的诱变效应在13%和15%下最强,且丙二醛含量的变化与保护酶活性的变化相一致。这说明植物种子较高水分含量可以促进空间诱变效应的强度,但种子水分过高时诱变效应又会减弱。任卫波等[13-14]在研究中得出空间环境处理后新麦草(Psathyrostachysjuncea)株高、生殖枝数、单株种子产量显著增加,种子千粒重降低;种子含水量对空间环境诱变效果有显著影响,当种子水分接近10%时,诱变效应减弱;当种子水分>10%时,诱变效应开始增强;空间环境对新麦草二代种子发芽能力、种苗生长、种子浸出液电导率有显著影响,具体变化因品种而异;当种子含水量为10%~12%,诱变效应减弱,当含水量偏离这一范围时,诱变效应增强。以上说明种子含水量对空间诱变效应有一定的影响,可能是因为种子含水量改变了种子的生理状态,使其处于休眠向萌动过渡时期,增加了空间诱变敏感性[13,16]。但其机理目前尚不清确,还有待进一步的研究。
综上所述,空间诱变对植株的抗逆性可产生正效应的结果,并在含水量13%、15%时达到最大的诱变效应,可作为新品种选育的研究手段,进一步进行研究。但这种变化是纯生理的还是遗传学物质的改变引起的,还需要进一步深入的研究。本研究的结果可以为进一步深入的研究奠定基础,以期为选育出新的、稳定的品种提供参考。
[1] 密士军,郝再彬.航天育种研究的新进展[J].黑龙江农业科学,2002(4):31-33.
[2] 陈积山,张月学,唐凤兰.我国草类植物空间诱变育种研究[J].草业科学,2009,26(9):173-177.
[3] Zietkiewicz E,RafalskiA,Labuda D.Genome fingerprinting by simple quence repeat (SSR)-anchored polymemse chain reaction amplification[J].Genomics,1994,20:176-183.
[4] 任卫波,王蜜,陈立波,等.卫星搭载对苜蓿种子PEG胁迫萌发及生长的影响[J].草地学报,2008,16(4):428-430.
[5] Ren W B,Zhao O L,Wang M,etal.Preliminary study on the mutagenic effects of space flight on alfalfa seeds[J].Agricultural Science & Technology,2008,9(4):51-55.
[6] 徐云远,王鸣刚,贾敬芬.卫星搭载红豆草后代中耐盐细胞系的筛选及鉴定[J].实验生物学报,2001,34(1):11-15.
[7] 任卫波,徐柱,陈立波,等.紫花苜蓿种子卫星搭载后其根尖细胞的生物学效应[J].核农学报,2008,22(5):566-568.
[8] 杜连莹,韩微波,张月学,等.“实践八号”搭载8个苜蓿品种细胞学效应研究[J].草业科学,2009,26(12):46-49.
[9] 冯鹏,李键,张蕴薇,等.不同含水量紫花苜蓿种子空载后当代叶片显微和超微结构研究[J].核农学报,2009,23(4):561-565.
[10] 韩建国.实用牧草种子学[M].北京:中国农业大学出版社,1997:153-155.
[11] 张治安,张美善.植物生理学实验指导[M].吉林大学出版社,2006.
[12] 尚晨,韩贵清,陈积山,等.高能混合粒子场处理种子对龙牧803苜蓿M2代的抗寒性影响[J].草业学报,2009,18(6):164-168.
[13] 任卫波,韩建国,张蕴薇,等.卫星搭载对新麦草种子含水量的影响(简报)[J].草地学报,2006,14(3):292-294.
[14] 任卫波,韩建国,张蕴薇,等.卫星搭载对新麦草二代种子活力的影响[J].草原与草坪,2007(1):42-45.
[15] Xue H,Liu M,Lu J Y,etal.Effects of space environment on biological characters of tissue cultured rose seedlings[J].Progress in Natural Science,2005,15(5):414-418.
[16] 任卫波,韩建国,张蕴薇.几种牧草种子空间诱变效应研究[J].草业科学,2006,23(3):72-76.
