箭筈豌豆甘油醛-3-磷酸脱氢酶基因片段的克隆及序列分析
2011-04-25刘志鹏张吉宇张妙青王彦荣
张 磊,刘志鹏,张吉宇,张妙青,王彦荣
(兰州大学草地农业科技学院,甘肃 兰州 730020)
高等植物甘油醛-3-磷酸脱氢酶(GAPDH)可以分为两个亚类,一类存在于细胞质基质,由同型的4个GapC亚基构成,以NAD(H)为辅酶,是糖酵解过程中的关键酶之一;另一类存在于成熟叶绿体中,由GapA和GapB两种亚基构成,以NADP(H)或NAD(H)为辅酶,参与光合作用Calvin循环中的能量固定过程[1-3]。甘油醛-3-磷酸脱氢酶活性与生物体能量代谢过程密切相关,它广泛参与了植物以及真菌对低温,高盐,干旱,热激以及病害等逆境胁迫的生理及病理响应过程[4-8];GAPDH基因在进化上具有保守性,因此也常被用作判定植物亲缘关系的依据[1]。
箭筈豌豆(Viciasativa)是豆科野豌豆属植物,具有较高的营养价值和较强的抗寒特性[6],是适宜在高寒高海拔地区栽培的优良牧草。先前的研究表明,箭筈豌豆品系2505,2556和2560在我国青藏高原地区经过多年驯化[7],其后代已经表现出稳定的遗传特性和良好的生产性能[8-9],具有进一步的育种潜力。引种后代与原种相比,包括抗逆特性在内的多种指标均发生了显著变化[10],同时过氧化物酶同工酶酶带暗示了短期驯化过程中分子水平上的改变[9]。然而,目前对箭筈豌豆的分子生物学研究尚不深入,关于箭筈豌豆GAPDH基因,尤其是它在作物高寒适应过程中的作用研究鲜见报道,这在很大程度上限制了基因工程在箭筈豌豆育种中的应用。有鉴于此,本研究开展有关箭筈豌豆GAPDH基因的克隆研究,为箭筈豌豆未来的育种研究提供理论基础。
1 材料与方法
1.1试验材料
1.1.1植物材料 箭筈豌豆采用引进品系2560,在兰州大学草地农业科技学院试验地盆栽,采集幼嫩荚果,液氮处理后于-80℃超低温保存。
1.1.2试剂 RNeasy Plant Mini Kit(QIAGEN), PrimeScriptTMRT-PCR Kit(TaKaRa),DNA凝胶回收试剂盒,pGM-T克隆试剂盒,DH5α感受态细胞,DNA Marker均购自天根生化科技(北京)有限公司。引物由北京赛百盛生物工程公司合成。
1.2试验方法
1.2.1引物设计 检索NCBI上已公布的植物GAPDH基因序列信息,选取与箭筈豌豆亲缘关系较近物种的GAPDH蛋白序列进行比对找出高度同源区域,用Primer Premier 5.0进行引物设计[9]。确定一对引物:P1(正向引物):5′TCTCACTCTTTCCCAACTCAAT 3′,P2(反向引物):5′TGTCATACCAAGCAACCACC 3′,预测片段长度为1 141 bp。
1.2.2RNA总量的提取 参照RNeasy Plant Mini Kit(QIAGEN)使用说明提取箭筈豌豆幼嫩荚果总RNA,产物用紫外分光光度计进行纯度测定,通过琼脂糖凝胶电泳检验RNA完整性[10]。
1.2.3RT-PCR扩增 cDNA第一链合成参照PrimeScriptTMRT-PCR Kit(TaKaRa)使用说明,PCR反应体系50 μL:10×PCR Buffer 5 μL;dNTP Mixture(10 mmol/L)2 μL;Ex Taq HS(5 U/μL)0.5 μL;引物P1和P2各1 μL。反应条件:94℃预变性1 min,然后以94℃ 30 s,58℃ 30 s ,72℃ 1 min进行30个循环,于72℃延伸10 min,取5 μL 扩增产物,用1.5%琼脂糖凝胶电泳鉴定。
1.2.4阳性克隆的筛选与鉴定 PCR产物进行琼脂糖凝胶回收后克隆在pGM-T,转化DH5α感受态细胞,经过蓝白斑筛选挑取阳性克隆,经过PCR鉴定后送上海生工进行测序。
1.2.5序列的生物信息学分析 序列翻译,比对通过DNAMAN软件进行,在NCBI(http:// blast.ncbi.nlm.nih.gov/Blast.cgi)网站上进行Blast检索[11],用MEGA 4.0构建进化树。
2 结果与分析
2.1RNA总量的提取及检测 提取幼嫩荚果总RNA后,经1%琼脂糖凝胶电泳检测,结果显示28S rRNA、18S rRNA 条带清晰,且前者亮度约为后者的2倍(图1),表明所提取RNA完整性较好;经NANODROP 1000紫外分光光度计检测,260/280、260/230分别为1.92、2.11,说明纯度较高,所提取RNA可以用于后续试验。
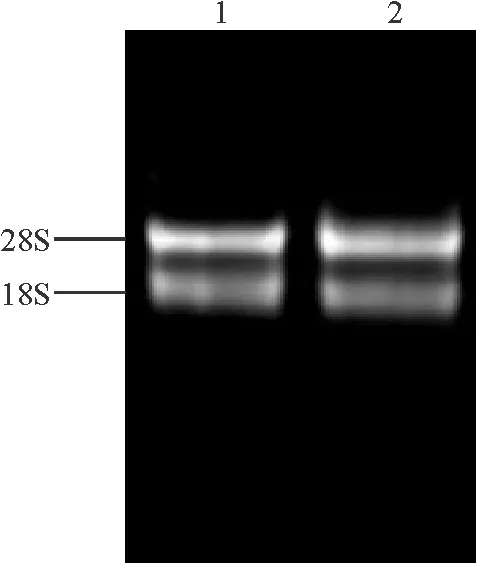
图1 箭筈豌豆荚果总RNA 1%琼脂糖凝胶电泳图
2.2RT-PCR 扩增 以总RNA反转录得到的cDNA第一链作为模板,用引物P1和P2扩增GAPDH基因片段,琼脂糖凝胶电泳分析发现约在1 141 bp附近有一亮带,且上下无杂带,与目的产物大小相近(图2)。推测此条带可能是GAPDH基因片段,结果有待进一步鉴定。

图2 RT-PCR产物凝胶电泳图
2.3阳性克隆的鉴定 将目的片段切胶回收,连接至pGM-T载体,转化DH5α感受态细胞,通过蓝白斑筛选随机挑取10个阳性克隆提取质粒,选取3个样本提取质粒进行PCR鉴定,目的产物大小约为1 141 bp,与RT-PCR结果一致(图3)。将样本送往上海生工测序。

图3 阳性克隆的PCR鉴定
2.4测序结果及序列分析 测序结果显示,插入片段长度为1 141 bp、编码381个氨基酸(图4)。Blast比较结果显示,该核酸片段与多种植物GAPDH的GapB亚基基因核酸序列相似度达83%,编码氨基酸序列的相似度在95%以上,表明克隆获得的片段为组成箭筈豌豆GAPDH的GapB亚基基因片段。

图4 箭筈豌豆GAPDH基因片段的核苷酸序列及推测的氨基酸序列
将预测的箭筈豌豆GAPDH氨基酸序列与大豆(Glycinemax,ABA86963.1),豌豆(Pisumsativum,ABA86964.1),蓖麻(Ricinuscommunis,XP_002500706.1),烟草(Nicotianatabacum,P09044),拟南芥(Arabidopsisthaliana,NP_174996.1),菠菜(Spinaciaoleracea,P12860.1),玉米(Zeamays,CAA10352.1),日本稻(Oryzasativasupsp.Japonica,ABF93788.1)和印度稻(O.sativasupsp.Indica,AAB8213301)的GAPDH氨基酸序列进行进化树分析(图5)及多重比较(图6),发现它的保守位点为353个,而非保守位点为28个,说明本研究克隆到的片段为箭筈豌豆GAPDH基因的高度保守区域。进一步的分析表明(图6),该片段与大豆GAPDH的相似度最高,达99%;与日本稻GAPDH的相似度最低,为93%;与拟南芥GAPDH相似度94%。故将克隆到的基因命名为VsGAPDH,并在GenBank注册,登录号HM117006。
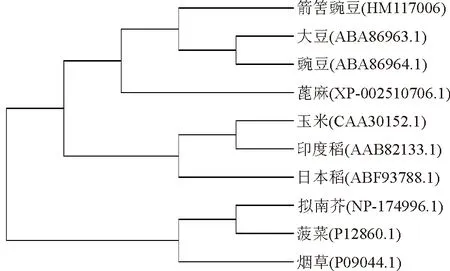
图5 VsGAPDH与其他植物GAPDH基因的氨基酸序列的进化树分析
3 讨论
构成高等植物GAPDH的三类亚基(GapA,GapB和GapC)并非起源于共同祖先,GapA与GapB具有较高的序列相似度,GapC与GapA或B的氨基酸序列相似度仅为45%,暗示GapA与GapB具有较近的亲缘关系[12]。本研究克隆获得的基因片段与多种植物GapB基因序列高度相似,其中与大豆GapB基因相似度为99%,与拟南芥GapB基因相似度94%,表明这一片段为来自箭筈豌豆的GapB基因。
高等植物GapB基因在进化上较为保守,其氨基酸序列相似度在一定程度上反映不同物种亲缘关系远近[13]。分析表明,箭筈豌豆GapB与豆科其他物种相关基因相似度较高。目前,对箭筈豌豆的遗传背景所知有限,同源克隆仍是获得功能基因的首选技术。因此,借鉴近缘物种如大豆,豌豆上的现有研究成果将极大提高箭筈豌豆的功能基因克隆及研究的效率。
在高海拔地区引种驯化的箭筈豌豆品系与原种相比表现出抗旱能力增强,生育期缩短,种子产量增加等多种可能与能量代谢相关的性状[14]。同工酶表达差异在一定程度上与这些性状在品种间的差异相一致[15]。然而,进一步的育种工作需要对这些特性产生的分子机制进行深入分析。高等植物GAPDH基因参与了高等植物的碳固定,Calvin循环等能量代谢过程[1],因而箭筈豌豆GAPDH基因的克隆将为相关工作的开展奠定基础。

图6 VsGAPDH氨基酸序列片段与其他植物GAPDH基因的氨基酸序列多重比较
[1] 王幼宁,刘孟雨,李霞.植物-3-磷酸甘油醛脱氢酶的多维本质[J].西北植物学报,2005,25(3):607-614.
[2] 王镜岩,朱圣庚,徐长法.生物化学(下册)[M].北京:高等教育出版社,2002.
[3] Russell D A,Sachsm M.Differential expression and sequence analysis of the maize glyceraldehyde-3-phosphate dehydrogenase gene family[J].Plant Cell,1989,1(8):793-803.
[4] 崔润丽,王永芳,智慧,等.谷子3-磷酸甘油醛脱氢酶基因的克隆与结构分析[J].华北农学报,2009,24(3):10-14.
[5] 李晓泽,刘关君,杨传平.西伯利亚蓼甘油醛-3-磷酸脱氢酶基因的cDNA克隆与序列分析[J].植物生理学通讯,2007,43(1):41-48.
[6] 刘志华,杨谦.球毛壳菌甘油醛-3-磷酸脱氢酶基因克隆及特性分析[J].微生物学报, 2005,45(6):885-889.
[7] 岳彩凤,康国章,刘超,等.小麦GAPDH 基因克隆及序列分析[J].农业生物技术科学, 2008,24(4):94-98.
[8] Yang Y,Kwon H B,Peng H P.Stress responses and metabolic regulation of glyceraldehyde-3-phosphate dehydrogenase genes inArabidopsis[J].Plant Physiology,1993,101(4):209-216.
[9] 杨联,张利平,王磊,等.牦牛MT-IV基因克隆与序列分析[J].草业科学, 2008,25(10):95-101.
[10] 周玲玲,缪建锟,祝建波,等.大叶补血草Na+/H+逆向转运蛋白基因的克隆及序列分析[J].草业学报,2009,18(5):176-183.
[11] 才华,朱延明,柏锡,等.野生大豆DREB基因cDNA 的克隆与分析[J].草业科学,2009,26(8):17-23.
[12] Khler U L,Mendel R R,Cerff R.A promoter for strong and ubiquitous anaerobic gene expression in tobacco[J].Plant Journal, 1996 (10):175-183.
[13] Shih M C,Heinrich P,Goodman H M.Intron existence predated the divergence of eukaryotes and prokaryotes[J].Science,1988,242:1164-1166.
[14] 王彦荣,南志标,聂斌,等.几种抗寒春箭筈豌豆新品系的形态特异性比较[J].草业学报,2005,14(2):28-32.
[15] 张建全,南志标,王彦荣.四个春箭筈豌豆品系原种及第三代过氧化物酶同工酶分析[J].草业学报,2003,12(5):94-98.
