AtPCS1基因表达载体构建与转化苜蓿的研究
2011-04-25王鸣刚骆换涛李志忠吴亦亮
王鸣刚,骆换涛,李志忠,吴亦亮
(1.兰州理工大学生命科学与工程学院,甘肃 兰州 730050; 2.厦门大学生命科学学院,福建 厦门 361005)
随着工业的迅速发展,环境中重金属的污染已成为影响环境和人类健康的一个重要问题[1]。在重金属离子的诱导下,植物细胞内的植物螯合肽合成酶(phytochelatin synthase,PCS)能够以谷氨酰半胱氨酸(glutamylcysteine,GSH)为底物迅速合成植物螯合肽(phytochelatin,PC)[2],PC可与金属离子螯合,形成复合物,通过液泡上的ABC型转运蛋白运输到液泡从而将重金属离子隔离[3]。近几年,PCS基因已分别从多种不同的植物中克隆[4],研究表明,过量表达GSH合成途径中的关键酶,可明显提高植物对重金属的耐受和积累[5-6]。含有过量表达植物螯合肽合成酶基因的转基因植株可作为理想的植物,用于对重金属污染的土壤进行生物修复。
苜蓿(Medicagosativa)适应性广、生长迅速及生物量大,是用于污染土壤生物修复的较好材料[7-8]。本研究以克隆的拟南芥(Arabidopsisthaliana)基因AtPCS1,构建植物表达载体pBⅠ121-AtPCS1,通过农杆菌EHA105介导转化苜蓿,期望获得转AtPCS1基因植株,为今后培育能够“超富集”重金属的苜蓿提供基础材料。
1 材料与方法
1.1材料 甘农一号苜蓿种子由甘肃农业大学草业学院提供。
1)菌种、表达载体:农杆菌EHA105,质粒pET28a-AtPCS1,载体pBPF及pBⅠ121均为兰州理工大学植物细胞与分子生物学实验室保存。
2)PCR扩增引物:AtPCS1、NPTⅡ引物由Invitrogen(上海)公司合成,序列如下:
AtPCS1-sense-3(正向引物):5’-AAGGATCCAATGGCTAGCGCGAGTTTAT-3’;
AtPCS1-antisense-3(反向引物): 5’-AAGAATTCACTAATAGGCAGGAGCAGCG-3’;
NPTⅡ-sencse(正向引物):5’-GGCTATGACTGGGCACAACA-3’;
NPTⅡ-antisense(反向引物):5’- GATACCGTAAAGCACGAGGA-3’。
3)培养基:B5HKT为B5H培养基+50 mg/L Kan+300 mg/L Timentin;
B5KT为B5培养基+50 mg/L Kan+300 mg/L Timentin; 1/2 MSKT为1/2 MS基础培养基(蔗糖质量浓度10 g/L)+50 mg/L Kan+100 mg/L Timentin。
1.2植物表达载体的构建 以AtPCS1-sense-3/AtPCS1-antisense-3作为引物,以质粒pET28a-AtPCS1为模板,PCR扩增拟南芥植物螯合肽合成酶基因。PCR产物浓缩后经BamHⅠ、EcoRⅠ双酶切,连入中间载体pBPF,在基因上游加入35S启动子,下游加入nos终止子,得中间质粒pBPF-AtPCS1;Hind Ⅲ单酶切质粒pBPF-AtPCS1获得含启动子、目的基因及终止子的DNA片断;将得到的目的片断连入经Hind Ⅲ单酶切的pBⅠ121,得到植物表达载体pBⅠ121-AtPCS1。
1.3苜蓿卡那霉素(Kan)抗性压的筛选 在B5H培养基中添加卡那霉素,设25、50及75 mg/L 3个质量浓度梯度。每组浓度设4个重复,每个重复放置7块叶片。20 d后统计外植体的出愈率并观察愈伤生长状况。
1.4含AtPCS1基因的农杆菌侵染苜蓿叶片 取新鲜苜蓿叶片,灭菌后切成1 cm2的小块,预培养4 d,备用;待农杆菌培养至OD600约为0.6时,取1 mL菌液加到9 mL MS液体培养基中混匀;将预培养的叶片加入到上述混合液中,与农杆菌共培养20 min。取出侵染后的叶片,置于B5H培养基中,暗培养4 d。
1.5再生植株的获得与移植 共培养4 d后的苜蓿叶片移植到B5HKT培养基中诱导愈伤,并在B5KT中诱导分化。分化出小苗后将再生苗移植到1/2MSKT中诱导生根;待苗长出2~3条粗壮的根后,温室中炼苗4~5 d移植到营养钵中培养;温室培养1个月,幼苗移植到大盆中,室外培养。
1.6转基因再生苗的PCR鉴定 以采用改进的CTAB法[9]提取转基因再生植株的基因组DNA,以其为模板,通过PCR方法鉴定再生植株。引物分别采用AtPCS1-sense-3/AtPCS1-antisense-3和NPTⅡ-sense/NPTⅡ-antisense。
2 结果与分析
2.1AtPCS1基因植物表达载体的构建和农杆菌转化子的鉴定 根据AtPCS1基因序列设计引物,在sense 引物中加入BamHⅠ酶切位点,antisense引物加入EcoRⅠ酶切位点,通过PCR得到目的片断(大小约1.4 kb)。目的片断通过BamHⅠ/EcoRⅠ双酶切后,连入中间载体pBPF,在AtPCS1基因的上下游分别加入35S启动子及nos终止子(约3.2 kb)。对中间载体pBPF-AtPCS1作HindⅢ单酶切后,回收上述表达元件,插入到pBⅠ121中得到植物表达载体pBⅠ121-AtPCS1(图1)。通过酶切鉴定,证明已获得阳性克隆(图2)。将构建好的质粒测序,结果表明所得基因序列准确无误。提取质粒pBⅠ121-AtPCS1转化农杆菌,通过菌落PCR鉴定获得阳性转化子(图3),即获得含AtPCS1基因的农杆菌。
2.2Kan选择压的确定 结果表明,经过20 d的培养,培养基含Kan质量浓度为0 mg/L试验组的外植体能长出块大、含水量高的淡黄色愈伤组织。随着培养基中Kan质量浓度的提高,外植体逐渐变黄,长出的愈伤组织明显弱小。在Kan质量浓度为50 mg/L的培养基中,外植体叶片部分褐化死亡,部分正常长出愈伤;当Kan质量浓度加到75mg/L时,叶片10 d左右基本枯黄,多数不能正常愈伤化(表1)。选择压为50 mg/L时,长出的愈伤组织在含相同浓度Kan分化培养基上能够分化出芽。因此确定以甘农一号叶片作为转化材料,其愈伤组织诱导分化Kan的选择压力为50 mg/L。
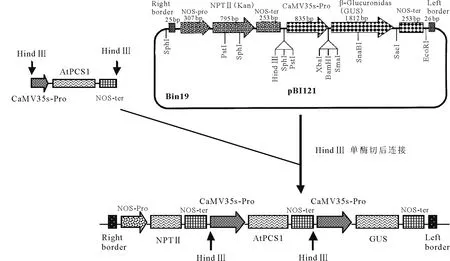
图1 植物表达载体pBⅠ121-AtPCS1的构建
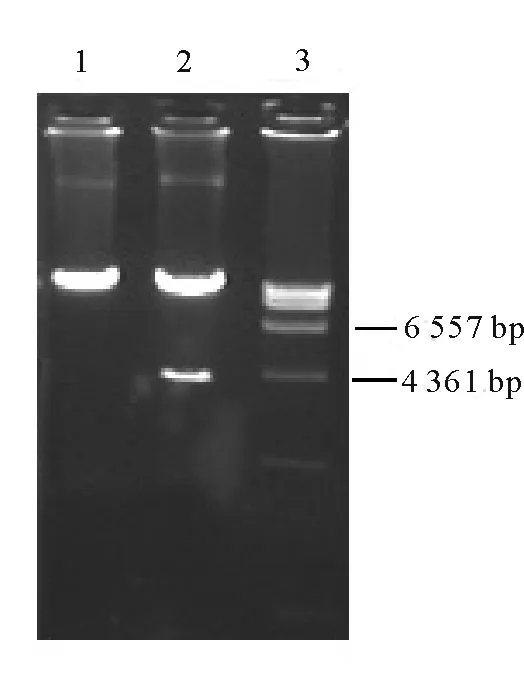
图2 重组质粒pBⅠ121-AtPCS1的酶切鉴定
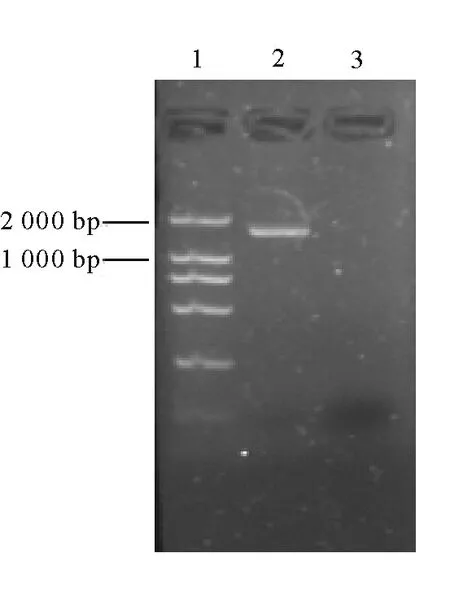
图3 含AtPCS1基因的农杆菌的PCR检测
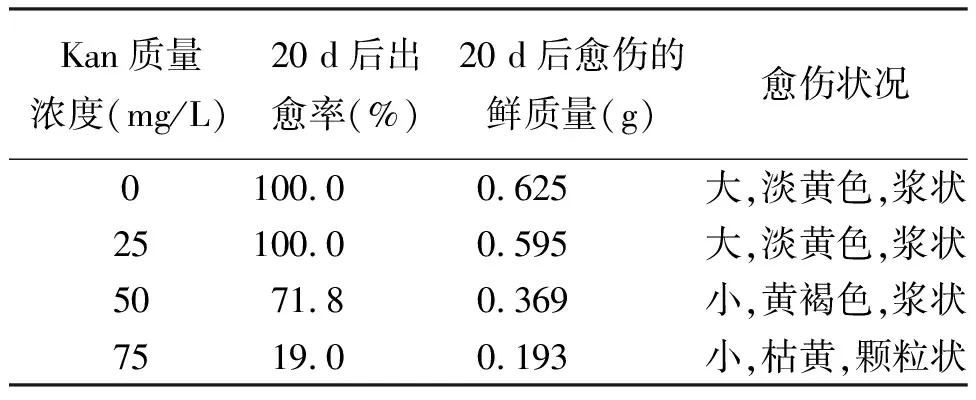
表1 不同选择压力对苜蓿叶片愈伤形成的影响
2.3AtPCS1基因导入苜蓿及植株再生 与农杆菌共培养4 d后,接种于B5HKT上筛选。10 d后叶片部分枯黄,但一些区域开始形成抗性愈伤组织,20 d后愈伤组织基本覆盖叶片,含水量增高(图4A)。在B5HKT上继代1次后转至B5KT上,约2周后抗性愈伤长出绿色的芽点,并很快的分化成芽(图4B),愈伤组织的分化率与无抗生素的条件下基本相同,且多为丛生芽,多的可达10~15个。将芽分离置于新的B5KT上培养,经过25~30 d,胚性愈伤组织逐渐长出叶片,并在基部分化出根(图4C)。
长出根后,将小苗移植到1/2MSKT上继续诱导根的生长。转基因再生苗的生根能力差别较明显,只有少数苗在20 d后可长出多且粗壮的根,多数根的发育受到一定抑制,只长1条主根,基本无侧根分化,影响再生苗移植到小盆中的成活率。后续试验放弃了在生根培养基中添加Kan作为筛选压,再生苗的生根情况明显好转。根系较为发达的再生苗,经4~5 d炼苗后移植到营养钵中(图4D),温室培养30 d后,将成活的苗移植到大盆中栽培(图4E)。本试验共获得转AtPCS1基因苜蓿再生植株57棵。
2.4转基因植株PCR鉴定 随机选取长势旺盛的9株转基因试验组和1株未转化的对照组再生苗的叶片,提取其基因组DNA,用NPTⅡ-sense/NPTⅡ-antisense及AtPCS1-sense-3/AtPCS1-antisense-3作为引物,进行PCR鉴定。以NPTⅡ特异引物对9株试验组和1株对照组植株进行检测,试验组阳性6株(图5),阳性苗比率达到66.7%。上述阳性样品进一步用AtPCS1引物鉴定,结果发现,除6号外,其余各样品均能扩增出目的基因大小一致的片断(图6),对照组没有得到相应的扩增带。初步结果表明,AtPCS1基因已转入苜蓿中。
3 讨论
3.1农杆菌菌株对转化效率的影响 在苜蓿的遗传转化技术方面,农杆菌介导法已有较多的报道[10]。韩利芳和张玉发[11]利用胭脂碱型菌株C58将烟草MnSOD基因转入保定苜蓿,阳性率达到84%,但转化效率似乎偏低;黎外奎等[12]用琥珀碱型菌株EHA105将肝片吸虫抗原基因转入紫花苜蓿,成功获得了含肝片吸虫保护性抗原基因FH3的转基因苜蓿;Mesfin等[13]则选用章鱼碱型菌株LBA4404 成功的将苹果酸脱氢酶基因转入苜蓿,获得了9棵转基因植株,转基因植株根部有机酸含量提高了4.2~7.1倍,显著提高了植株对铝的耐受能力。而Asma 等[14]在曼氏溶血杆菌A1的重要保护性抗原Lkt(leukotoxin)基因转化苜蓿的研究中比较了菌株LBA4404 及C58 的转化能力,结果表明,相对于菌株LBA4404,C58 侵染的外植体愈伤组织启动时间及形成的数量都明显减少,但是再生植株的阳性率明显提高。

图4 转AtPCS1基因的甘农一号苜蓿分化、再生情况
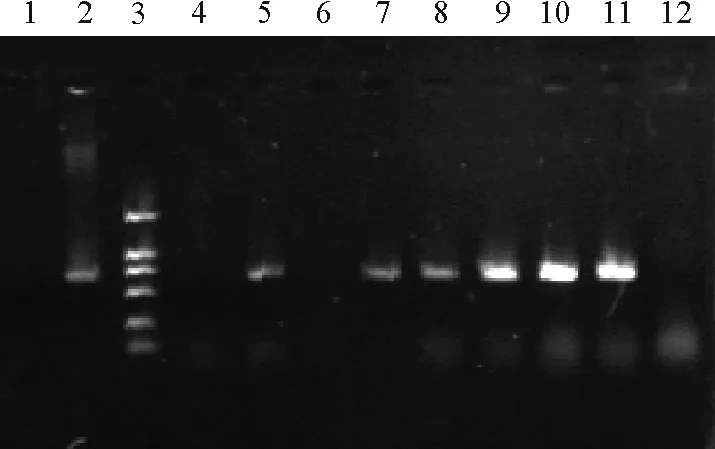
图5 NPT Ⅱ 特异引物对转基因苜蓿的PCR 检测
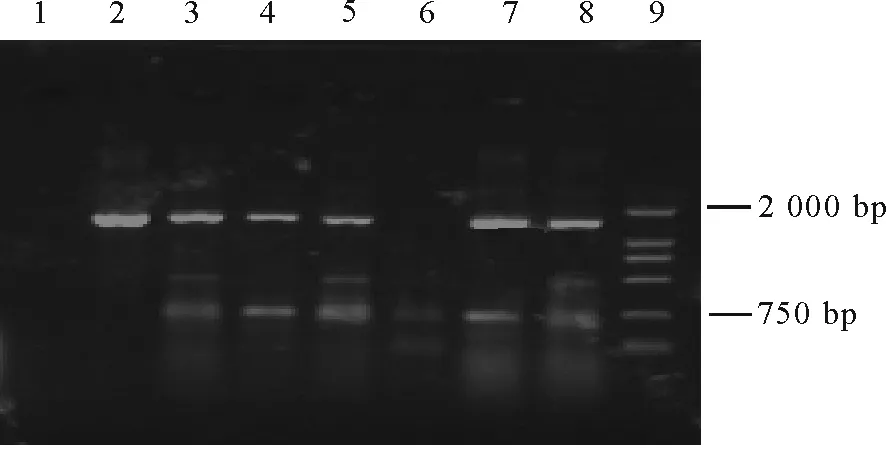
图6 AtPCS1 特异引物对转基因苜蓿的PCR 检测
本试验主要使用农杆菌EHA105 作为侵染菌株,经EHA105 菌侵染后,外植体基本上都可以正常形成愈伤组织,其后的分化率并未受到影响。由于使用的再生体系中形成的愈伤组织含水量高、浆状,GUS 染色结果较难观察,但从PCR 鉴定的结果可以看出,阳性率为66.7%。另外,也使用了LBA4404 作为侵染菌,结果表明,侵染后的外植体愈伤形成及分化率变化都不大(数据未发表),但是每块愈伤组织上分化的芽数量只有2~5个,相对EHA105 侵染后的叶片可以分化多达10个的芽明显减少,同时考虑到菌株LBA4404 培养过程容易结块,影响后续的转化。因此,在后续的试验中使用EHA105 作为主要的侵染菌株。
3.2预培养对转化效率的影响 多数研究者认为,预培养可促进细胞分裂,分裂状态的细胞更易整合外源DNA,从而提高外源基因的短暂表达和稳定整合率。陈晨等[15]对预培养影响苜蓿的转化效率做了详细的研究,认为预培养5 d抗性愈伤的形成率及稳定转化率都最高,且GUS染色后蓝色斑点布满叶片的中间,表明农杆菌侵染的比较深入。因此,在农杆菌侵染外植体之前,一般将外植体先在培养基中预培养一定的时间。本试验在农杆菌转化前对叶片进行4 d的预培养。
此外,农杆菌侵染外植体时间及共培养时间也会影响转化效率。侵染时间要适宜,一方面农杆菌需充分接触外植体,另一方面要减少细菌对植物细胞的毒害作用。陈晨等[15]研究表明苜蓿叶片侵染时间为20 min时,瞬时表达率及抗性愈伤形成率最高。参考不同研究者的方法,本试验采用20 min作为侵染时间。结果发现,一般共培养到第4天时农杆菌就大量生长,覆盖整个叶片。继续培养叶片会萎蔫,且不利于后面叶片的抑菌培养、分化。因此,采用共培养3 d后置于含Timentin 的培养基中,抑菌培养并诱导愈伤的形成。
3.3筛选压对转化效率的影响 合适的筛选压能够充分杀死非转化细胞或抑制其生长分化,提高筛选效率。多数研究者采用一步法,但为了提高筛选效率和防止筛选压力过度对所有植物细胞造成损伤,也有一些研究者采用多步筛选法。在外植体最初诱导形成愈伤组织的几周采用较低的筛选压,待愈伤组织长到一定程度后,提高抗生素的浓度[16],也有人采用筛选压浓度先高后低的方法[17]。多步法筛选得到的再生苗阳性率较高,但前者容易产生嵌合体,后者则由于开始筛选压过高导致多数细胞无法正常生长、分化而导致再生率较低。在转基因苜蓿研究中,通常采用Austin建立的一步法。本试验在甘农一号叶片愈伤形成、分化及生根过程中均使用50 mg/L的Kan作为筛选压,结果表明,阳性率达到50%,筛选效率较高。但Kan质量浓度在50 mg/L时,再生苗生根明显受到抑制,根生长缓慢且很少有根毛的分化,这可能是根组织相对于叶片对Kan更为敏感。黎外奎等[12]、黎茵等[18]在各自的研究中均使用无抗生素的培养基诱导生根,本试验后期也采用了无抗生素培养基诱导生根。但取少数根长势较好的无菌苗叶片进行PCR鉴定时,发现阳性率明显降低,只有66.7%。因此,需进一步筛选合适生根的Kan浓度,完善苜蓿遗传转化系统。
3.4植株的再生及检测 苗移植1周左右,多数植株开始萌发新叶稳定生长,叶片大、节间长。试验发现并不是所有植株都能旺盛生长,At10、At12两棵苗移植一个半月后仍无明显的壮大,叶片小且节间短。这可能由于外源片断随机插入苜蓿染色体中导致某些茎叶发育相关的基因失活或者外源基因的过量表达影响了苜蓿正常的生长,这些需要进一步分子生物学试验加以验证。9棵再生苗用NPTⅡ特异引物PCR检测获得6棵阳性植株,对此6棵阳性苗用AtPCS1 特异引物进行进一步PCR鉴定,发现样品At4为阴性,表明AtPCS1基因已丢失。这种外源片断的丢失可能发生在质粒的复制过程中,也可能是插入苜蓿染色体后由于基因的重组引起的。其他关于转基因植株转录及表达AtPCS1能力和转基因植株富集重金属能力的试验正在进行中,相关结果将陆续发表。
[1] 孙瑞莲, 周启星.高等植物重金属耐性与超积累特性及其分子机理研究[J].植物生态学报,2005,29(3):497-504.
[2] Cobbett C S.Phytochelatins and their roles in heavy metal detoxification[J].Plant Physiology,2000,123(3):825-832.
[3] Lu Y P,Li Z S,Rea P A.AtMRP1 gene ofArabidopsisencodes a glutathione S-conjugate pump:isolation and functional definition of a plant ATP binding cassette transporter gene [J].Proceedings of the National Aca-demy of Sciences,1997,949(15):8243-8248.
[4] Peterson A G,Oliver D J.Leaf-targeted phytochelatin synthase inArabidopsisthaliana[J].Plant Physiology and Biochemistry,2006,44(11-12):885-892.
[5] Hugo Virgilio,Perales-Vela.Heavy metal detoxification in eukaryotic microalgae[J].Chemosphere,2006,64:1-10.
[6] Zhu Y,Pilon-Smits E A H,Jouanin L,etal.Overexpression of glutathione synthetase inBrassicajunceaenhances cadmium tolerance and accumulation [J].Plant Physiology,1999,119(1):73-79.
[7] 曹宏,章会玲,马永祥,等.陇东地区紫花苜蓿品种区域试验研究[J].草业学报,2009,18(3):184-191.
[8] 夏素银,严学兵,王成章,等.紫花苜蓿生物活性成分在畜禽生产中的应用[J].草业科学,2010,27(7):133-140.
[9] 金东雁,黎孟枫,候云德,等译.分子克隆实验指南[M].第2版.北京:科学出版社,1992.
[10] 毛雅妮,王国良,张德罡,等.4个苜蓿品种愈伤组织诱导对光照的响应及再生体系建立[J].草业科学,2010,27(9):109-114.
[11] 韩利芳,张玉发.烟草MnSOD 基因在保定苜蓿中的转化[J].生物技术通报,2004(1):39-42,46.
[12] 黎外奎,陈幼竹,周宇,等.肝片吸虫抗原基因转基因苜蓿再生的研究[J].四川大学学报(自然科学版),2003,40(1):144-147.
[13] Mesfin T,Stephen J T,Deborah L A,etal.Overexpression of malate dehydrogenase in transgenic alfalfa enhances organic acid synthesis and confers tolerance to aluminum [J].Plant Physiology,2001,127:1836-1844.
[14] Asma Z,Raymond W H L,Reggie L,etal.Transformation of alfalfa with a bacterial fusion gene,MannheimiahaemolyticaA1 leukotoxin50-gfp:response withAgrobacteriumtumefaciensstrains LBA4404 and C58 [J].Plant Cell,Tissues and Organ Culture,2004,79:271-278.
[15] 陈晨,曹致中,贺顺姬,等.农杆菌介导的紫花苜蓿遗传转化体系的建立与优化[J].甘肃农业大学学报,2004,39(4):516-519.
[16] 郭兆奎,杨谦,姚泉洪,等.转拟南芥AtKup1基因高含钾量烟草获得[J].中国生物工程杂志,2005,25(12):24-28.
[17] Ikram U H.Agrobactrrium-mediated transformation of cotton (GossypiumhirsutumL.) via vacuum infiltration[J].Plant Molecular Biology Reporter,2004,22:279-288.
[18] 黎茵,黄霞,黄学林.根癌农杆菌介导的苜蓿体胚转化[J].植物生理与分子生物学报,2003,29(2):109-113.
