蝴蝶兰幼嫩花梗组织培养和快速繁殖
2011-04-25张彦妮边红琳陈立新
张彦妮,边红琳,陈立新
(1.东北林业大学园林学院,黑龙江 哈尔滨 150040; 2.黑龙江省农科院园艺分院,黑龙江 哈尔滨 150069)
蝴蝶兰(Phalaenopsisamabilis),又名蝶兰,为兰科蝴蝶兰属植物,其姿态优美、色泽丰富、艳丽,花期持久。在热带兰中素有“兰花皇后”之美称,是兰科植物中栽培最广泛的四大观赏热带兰之一,是室内绿化美化重要的观赏花卉,国内外市场对其需求量大。但是,由于蝴蝶兰是单茎性气生兰,很难用传统分株方式进行无性繁殖;且蝴蝶兰种子极小,没有胚乳,发育不完全,极难萌发。组织培养作为生物技术育种的基础,可以解决繁殖慢、种苗供不应求的难题[1-2]。目前,随着生物工程技术的广泛应用,组织培养也已成为兰花快速繁殖的重要手段。关于蝴蝶兰的组织培养有许多报道[3-6],这些研究多是以蝴蝶兰的叶片[7]、茎尖[7-8]、花梗腋芽[7-10]、种子[11]、根尖[7]、花梗节间[12]为外植体进行组织培养研究,对以花梗为外植体的研究,大多是以未开花或即将开花的花梗为外植体,这对母株伤害较大,影响其观赏价值和经济价值。本研究以较为幼嫩的废弃的蝴蝶兰花梗(为使花期一致,通常剪掉提前抽出的花梗)为外植体,在培养基上诱导休眠芽的萌发,通过萌发的幼苗的茎尖为材料进行类原球茎的诱导、增殖、分化、生根,初步建立组织培养再生体系,为蝴蝶兰的大量繁殖探索新的有效的材料和途径。
1 材料与方法
1.1试验材料 供试的蝴蝶兰幼嫩的花梗由黑龙江省农科院园艺分院观赏温室提供。
1.2试验方法
1.2.1花梗的消毒 取具有休眠芽的蝴蝶兰幼嫩花梗,将其横切成1.5~2.0 cm(每段带1个花芽),用75%的酒精棉球擦去表面灰尘。然后在洗衣粉中浸泡10~15 min,期间不断摇晃,再用自来水冲洗20~30 min;在超净工作台上用75%的酒精浸泡10~30 s;在0.1%升汞溶液中浸泡5~20 min;无菌水冲洗3~7次,用无菌滤纸吸干花梗表面的水分,将花梗剪成长1.0~1.5 cm的小段(每段带1个花芽),接种到不同培养基上;先暗培养14~21 d,然后再将其放入光照条件下培养。培养室温度为(25±2)℃,光/暗周期为14 h/10 h,光照强度2 500~3 500 lx。
1.2.2诱导分化及增殖培养 将消毒后的花梗或无菌苗的茎尖,在无菌条件下,将其切割成适当大小后,接种于不同的诱导分化和增殖培养基上,比较其萌发、生长、分化和增殖状况。
1.2.3组培苗的生根诱导 当获得的组培苗长到2~3 cm时,将其转入生根培养基1/2 MS+NAA 0.5 mg/L上进行生根诱导,一个月后统计生根率、根的长度以及生根状况等。
所有培养基均附加10%椰子汁、0.1%活性炭、20 g/L白砂糖和8 g/L琼脂,然后用1 mol/L NaOH调节pH值为5.4~5.6。在121℃条件下高压灭菌13 min。
1.2.4组培苗的驯化和移栽 参照张彦妮等[13]的方法进行组培苗的驯化和移栽。
1.3统计分析 为判定各种激素组合对蝴蝶兰花梗腋芽萌发率、分化率、死亡率及腋芽组培苗茎尖分化率的影响,采用前向逐步回归分析判断各激素贡献率及其显著性、显著因子,再用单因素方差分析各激素浓度对萌发率、分化率及死亡率的影响,采用单因素显著性检验方差分析的显著性。多元回归分析和方差分析用Statistica 6.0完成(StatSoft, Inc.)。
2 结果与分析
2.1蝴蝶兰花梗消毒方法和消毒时间的比较 灭菌时间对外植体的消毒效果和成活率至关重要。用0.1%升汞消毒不同时间,花梗腋芽培养2~7 d后,接种的一部分腋芽表面污染,一部分生长良好。灭菌时间短,污染率高,但长时间的消毒,对外植体的伤害较重,接种后外植体萌发时间相对较长。灭菌时间在15 min时,污染率较低,萌发时间相对较早,灭菌时间在20 min时,污染率虽然最低,但萌发时间延长(表1)。
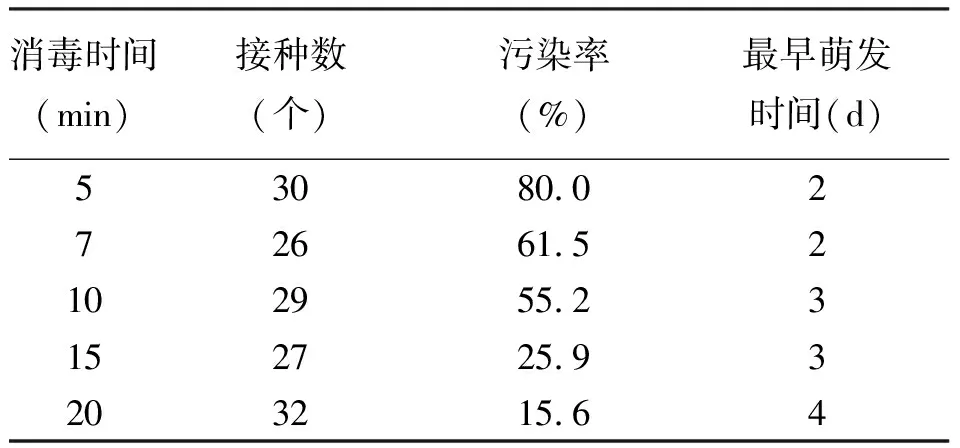
表1 0.1%升汞不同消毒时间的处理效果
2.26-BA与NAA组合对蝴蝶兰花梗腋芽萌发和分化的影响 在不同培养基上的蝴蝶兰花梗腋芽萌发及生长结果表明(表2、表3),花梗腋芽在接种3 d后,就出现萌动膨大现象(图1A和图1B),有的花梗腋芽在35 d左右就长出小叶;有的在腋芽周围突起,以后逐渐发育成几个不定芽(图1C)。这些不定芽芽大小不等,表明不定芽的分化不同步或生长发育不一致。
激素种类和浓度对于花梗腋芽启动培养有一定的影响。在培养基1/2 MS+6-BA 2 mg/L+NAA 0.2 mg/L上,蝴蝶兰花梗腋芽的萌发率最高,达40%。在培养基1/2 MS+6-BA 5 mg/L+NAA 0.5mg/L上,花梗腋芽产生的不定芽数量最多,分化率最高,但整体长势一般。可能是由于6-BA促进不定芽的形成,但影响了植株的长势。花梗腋芽接种后,在每种培养基上均有较高的死亡率,均是因为褐化造成的。这可能与蝴蝶兰中含有较多的酚类物质有关。

表2 在不同1/2 MS培养基上蝴蝶兰花梗腋芽的萌发生长状况

表3 在不同MS培养基上蝴蝶兰花梗腋芽的诱导及生长状况

图1 接种的花梗腋芽膨大萌发及产生的不定芽
多元回归分析表明,NAA、2,4-D和6-BA对蝴蝶兰花梗腋芽萌发率的影响基本相当,都没有达到95%的显著水平(结果未列出)。NAA、2,4-D和6-BA对蝴蝶兰花梗腋芽死亡率的影响中,NAA和2,4-D都显著影响死亡率,但NAA影响更强,6-BA不显著。分别对NAA和2,4-D与死亡率做单因素方差分析,结果表明(图2),NAA质量浓度为0.2 mg/L时蝴蝶兰死亡率最高,浓度为0时死亡率最低。2,4-D两个质量浓度的方差分析结果不显著。NAA、2,4-D和6-BA对蝴蝶兰花梗腋芽分化率的影响中,6-BA的影响更为主要(达到95%显著水平),单因素方差分析发现,随6-BA浓度增加(图3),蝴蝶兰花梗腋芽分化率增加。
在附加不同浓度激素的MS培养基上,花梗腋芽萌发率较高(表3)。在培养基MS+6-BA 2 mg/L+2,4-D 0.01 mg/L上,萌发率为54.5%,分化率为18.2%,产生的芽数较多(图1D)。
2.3激素组合对蝴蝶兰花梗腋芽组培苗茎尖诱导的影响 将花梗腋芽组培苗的叶子剥去,切1.5~2.5 mm茎尖,将其接种在附加不同激素种类和浓度的培养基上。结果发现,有些茎尖颜色变绿,30 d后上面出现颗粒状的亮绿色的组织,这些组织逐渐长成类原球茎(图4),2~3个月后,这些类原球茎有的长出小叶,有的继续分化类原球茎(图5)。不同的培养基对花梗腋芽组培苗茎尖的诱导效果不同(表4)。在培养基1/2 MS+6-BA 6 mg/L+NAA 0.2 mg/L和1/2 MS+6-BA 5 mg/L+2,4-D 0.01 mg/L上,茎尖的分化率最高,为50%。在前一种培养基上有16.7%诱导出类原球茎,33.3%诱导出不定芽。后一种培养基上只诱导出类原球茎。在其他培养基上诱导率相对较低,多数外植体因褐化而死亡。

图2 在1/2 MS培养基上NAA和2,4-D浓度梯度蝴蝶兰花梗腋芽死亡率方差分析结果

图3 在1/2 MS培养基上6-BA浓度梯度蝴蝶兰花梗腋芽分化率方差分析结果

图4 膨大的茎尖及茎尖产生的类原球茎
多元回归分析表明,TDZ、NAA、2,4-D和6-BA对蝴蝶兰花梗腋芽组培苗茎尖分化率的影响中,6-BA和NAA对茎尖分化率影响较大(达到95%显著水平),但6-BA影响更强,TDZ和2,4-D未达到显著程度(多元回归分析结果未列出)。分别对6-BA和NAA与茎尖分化率做单因素方差分析,结果表明,随6-BA浓度增加,蝴蝶兰茎尖分化率增加。NAA的方差分析结果并不显著(图6)。

图5 增殖的类原球茎
2.4原球茎增殖培养 将类原球茎切成0.5 cm2大小的块,接种在附加不同浓度的NAA和6-BA的MS培养基上进行增殖培养,培养一段时间后,再进行切割转移,通过这种方式使原球茎成倍增长。结果发现(表5),在培养基MS+6-BA 3 mg/L+NAA 0.2 mg/L上,类原球茎增殖倍数最高,为4.7,产生的类原球茎颜色为绿色,颗粒状,随着培养时间的延长,有的类原球茎变为乳黄色(图6)。因此,该培养基为蝴蝶兰类原球茎增殖的最佳培养基。在培养基MS+6-BA 10 mg/L+NAA 0.5 mg/L上,原球茎在增殖的同时, 有的产生大量丛生芽, 但丛生芽长得较为弱小。可能是6-BA浓度过高导致的。因为细胞分裂素是一类较活跃的植物激素,它不仅能促进植物细胞的分裂和增大,而且在芽分化的诱导、叶绿体的发育、养分的运输和分配、细胞衰老的抑制等方面都表现显著的效果。
试验发现,在增殖时一定要对类原球茎先切割后培养,这样效果比不切割的要增殖的数量多。原球茎分化比较容易,原球茎在增殖后较长时间不进行转移就能出现褐化现象。
2.5组培苗生根诱导和驯化移栽 组培苗生根的诱导也是植物组织培养能否成功的关键步骤。当再生苗长到1.2~2.0 cm时,继代到附加0.5 mg/L NAA浓度的1/2 MS培养基中中进行生根诱导,50 d后统计生根情况。结果表明(图7),98%的无菌苗均生根。并且生长良好。经过驯化的组培苗移栽后生长良好,成活率为89.3%。
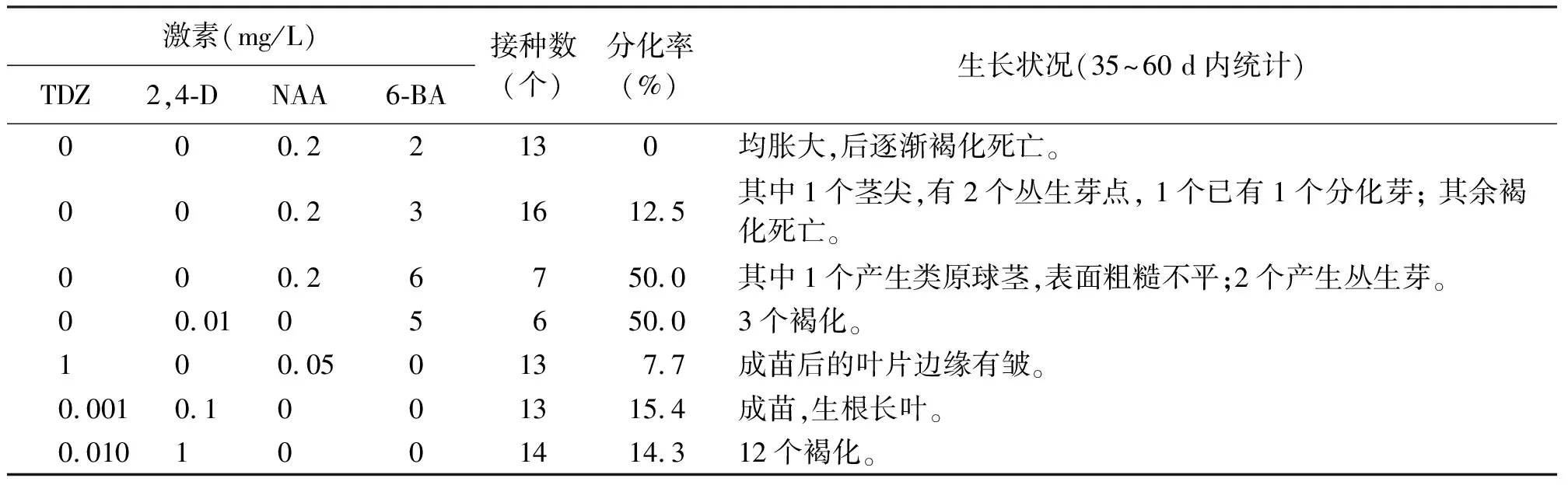
表4 在不同1/2 MS培养基上蝴蝶兰花梗腋芽组培苗茎尖的诱导及生长状况

图6 在1/2 MS培养基上不同6-BA和NAA浓度蝴蝶兰花梗腋芽组培苗茎尖分化率方差分析结果

表5 在MS培养基上的继代增殖培养

图7 生根和驯化的无菌苗
3 讨论与结论
近年来,对蝴蝶兰组织培养报道较多的是以仅开一两朵花且下面花芽饱满的花梗、幼叶、茎尖和根尖等多种器官为外植体进行组织培养研究[10],但这些方法对母株都有不同程度的损伤。本研究选用的是幼嫩的花梗(为控制花期一致剪掉的花梗)作为外植体,经过多次试验,初步建立了组织培养再生体系。虽然诱导率相对较低,但这样既不损伤母株,又可节约成本,充分利用材料,繁殖大量优良品种,比采用蝴蝶兰根尖、茎尖进行快速无性繁殖更有应用价值,特别是对一些稀有品种的保存和快繁[14]。
在植物组织培养中,外源生长素和细胞分裂素是细胞离体培养所必需的激素,合适的浓度及两者之间的适宜配比不但可以诱导细胞分裂和生长,而且能控制细胞分化和形态建成[15]。王丽艳等[16]认为,激素是诱导组培苗增殖的关键物质,对培养的成败起着决定性的作用。本研究结果证明激素种类和浓度对于花梗腋芽启动培养有一定的影响。6-BA和 NAA的共同作用可以促进蝴蝶兰花梗腋芽萌发,在培养基1/2 MS+6-BA 2 mg/L+2,4-D 0.2 mg/L上,蝴蝶兰花梗腋芽的萌发率最高。不同的培养基对蝴蝶兰茎尖的诱导效果不同,较高浓度的6-BA有助于茎尖原球茎的诱导和增殖,浓度低诱导效果相对较差[17]。在培养基1/2 MS+6-BA 6 mg/L+NAA 0.2 mg/L和1/2 MS+6-BA 5 mg/L+2,4-D 0.01 mg/L上,茎尖的分化率最高。在前一种培养基上有16.7%诱导出类原球茎,33.3%诱导出不定芽。后一种培养基上只诱导出类原球茎。在其他培养基上诱导率相对较低,多数外植体因褐化而死亡。在原球茎增殖培养过程中,在培养基MS+6-BA 3 mg/L+NAA 0.2 mg/L上,类原球茎增殖倍数最高,为4.7,产生的类原球茎颜色为绿色,颗粒状。因此该培养基为蝴蝶兰类原球茎增殖的最佳培养基。
金忠民等[18]认为提高愈伤组织诱导率是建立再生体系的第一步,没有高频的诱导率,便无法得到大量的、高品质的愈伤组织,其随后的分化及生根也难以进行。对于兰科植物来说,提高原球茎的诱导率则是建立再生体系的关键技术,本试验原球茎的诱导率相对较低,有待于进一步深入研究提高类原球茎的诱导率。此外,越来越多的研究表明,兰花类原球茎形成过程是典型的体细胞胚胎发生发育过程,且是单细胞起源的[19-20]。这为兰科植物利用组织培养育种提供了理论基础。组织培养也可以与化学诱变相结合的方法进行多倍体或抗性育种[21-23]。在兰科植物种质资源创新方面具有较大的潜在应用价值。本研究为蝴蝶兰的高频再生组织培养体系建立、基因转化、多倍体诱导或抗性育种奠定基础。
[1] 刘进平,吴发红,王丹,等.柱花草愈伤组织培养与植株再生[J].草业学报,2007,16(3):136-138.
[2] 李文送.我国香根草繁殖方法的研究进展[J].草业科学,2007,24(7):33-36.
[3] 王平,吴海红,赵兴华,等.蝴蝶兰组织培养培养基组成的初步研究[J].沈阳农业大学学报,2004,35(1):10-12.
[4] Liu T H,Lin J J,Wu R Y.The effects of using trehalose as a carbon source on the proliferation ofPhalaenopsisandDoritaenopsisprotocormrlike-bodies[J].Plant Cell,Tissue and Organ Culture,2006,86:125-129.
[5] 李军,柴向华,曾宝珰,等.蝴蝶兰组培工厂化生产技术[J].园艺学报,2004,31(3):413-414.
[6] Murdad R,Hwa K S,Seng C K,etal.High frequency multiplication ofPhalaenopsisgiganteausing trimmed bases protocorms technique[J].Scientia Horticulturae,2006,111:73-79.
[7] 李娜.蝴蝶兰的组织培养技术研究[J].江西农业学报,2008,20(9):51-53.
[8] 张伟,曾伏虎,张苏锋.蝴蝶兰的组织培养与快速繁殖[J].信阳师范学院学报,2004,17(3):335-337.
[9] 顾东亚,蒋素华,崔波,等.蝴蝶兰组培快繁技术研究[J].北方园艺,2009,10:196-198.
[10] 刘亮,易自力,蒋建雄,等.蝴蝶兰丛生芽、原球茎途径的组织培养研究[J].亚热带植物科学,2008,37(3):43-45.
[11] Chen J T,Chang W C.Induction of repetitive embryogenesis from seed-derived protocorms ofPhalaenopsisamabilisvar.formosashimadzu[J].In Vitro Cellular & Developmental Biology-Plant,2004,40(3):290-293.
[12] 鲁雪华,徐立晖,郭文杰,等.蝴蝶兰花梗节间段培养繁殖的初步研究[J].园艺学报,2002,29(5):491-492.
[13] 张彦妮,陈立新,付艳丽.夏枯草(Prunellavulgaris)组织培养和快速繁殖[J].分子植物育种,2007,5(3):383-388.
[14] 李子红,贾燕.珍品兰花快速繁殖与养护[M].上海:上海科学技术出版社,2006.
[15] 葛军,刘振虎,卢欣石.紫花苜蓿再生体系研究进展[J].中国草地,2004,26(2):63-67.
[16] 王丽艳,荆瑞勇,肖莉杰,等.扁茎黄芪离体快繁及多倍体诱导[J].草业学报,2009,18(1):94-99.
[17] 叶晓青,谢东,魏书,等.不同激素水平对蝴蝶兰原球茎体增殖的影响[J].江苏林业科技,2000,27(9):42-44.
[18] 金忠民,沙伟,张艳馥,等.羊茅种子愈伤组织诱导及再生体系的建立[J].草业科学,2010,27(10):60-63.
[19] Chen J T,Chang W C.Direct somatic embryogenesis and plant regeneration from leaf explants ofPhalaenopsisamabilis[J].Biologia Plantarum,2006,50(2):169-173.
[20] Kuo H L,Chen J T,Chang W C.Efficient plant regeneration through direct somatic embryogenesis from leaf explants ofPhalaenopsis‘little staeve’[J].In Vitro Cellular & Development Biology-Plant,2005,41(4):453-456.
[21] 崔广荣,张子学,张从宇,等.文心兰多倍体诱导及其鉴定[J].草业学报,2010,19(1):184-190.
[22] 马文芳,黄惠英,王清.外源激素对甘草愈伤组织诱导及染色体加倍的影响[J].草业学报,2008,17(3):142-145.
[23] 王小华,庄南生,王英,等.DES诱变与离体培养结合筛选柱花草抗寒突变体的研究[J].草业学报,2010,19(1):263-267.
