水杨酸浸种处理对黑麦草种子萌发及幼苗抗旱性的影响
2011-04-25杨絮茹周蕴薇
刘 杰,杨絮茹,周蕴薇
(东北林业大学园林学院,黑龙江 哈尔滨 150040)
适当的外源物质浸种处理可以杀灭种子细菌,防治苗期病虫害,增加幼苗营养,提高种子萌发和促进幼苗生长。水杨酸(SA)是生物体内普遍存在的酚类化合物之一,外施SA具有促进种子萌发、幼苗生长、诱导植物开花、控制离子吸收等多种生理作用[1-3]。王晓多等[4]报道,10~40 mg/L SA浸种后的豌豆(Pisumsativum)的幼苗根系活力得到了提高,有利于地下部根系的形成,改善幼苗的抗性。杨玲等[5]报道,SA浸种处理提高了水稻(Oryzasativa)的发芽率。但其促进效应也因其施用浓度而异,如穆瑞霞等[6]指出,当SA浓度大于5.00 mmol/L时,浸种处理可造成大葱(Alliumfistulosum)种子死亡。
水分胁迫对植物的伤害在非生物胁迫中较为常见且对植物伤害较为严重。前人的研究表明,在水分胁迫条件下,活性氧的产生和清除系统受到破坏,活性氧过度积累,引起细胞膜的过氧化,进而破坏细胞膜和细胞器[7];质膜过氧化产物——丙二醛(MDA)的积累对膜和细胞造成进一步伤害[8]。适当的外源物质浸种处理不仅可以促进种子的萌发,还可能影响植物的抗旱性。许明丽等[9]报道,在种子吸胀和萌发期间用SA处理的小麦(Triticumaestivum)幼苗,可缓解水分胁迫导致的膜损伤;也有报道[10]认为,SA浸种可提高超氧化物歧化酶(SOD)、过氧化物酶(POD)和抗坏血酸酶(AXP)活性从而减轻水分胁迫对玉米(Zeamays)幼苗的伤害。黑麦草(Loliumperenne)是重要的草坪草,在园林绿化中有广泛的应用,但关于SA浸种对黑麦草种子萌发和幼苗抗旱性的影响尚未见报道。 本试验拟通过研究不同浓度SA浸种处理对黑麦草种子萌发的影响,探讨经SA浸种处理后萌发的黑麦草幼苗对水分胁迫的生理反应,为SA在草坪草上的应用提供理论依据。
1 材料与方法
以黑麦草‘托亚’(L.perenne‘Taya’)为材料,选择大小均匀、饱满的种子分别用0.25、0.50和0.75 mmol/L 3个浓度的SA溶液浸泡24 h,用蒸馏水冲洗3次,备用。取100粒种子均匀摆放在垫有3层湿润滤纸的玻璃培养皿内,放入光照培养箱(光照3 000 lx,每天8 h,日温设定为15℃,夜温设为10℃)中,观察并统计其萌发相关指标。以清水浸种作对照,重复3次。
幼苗水分胁迫试验,用0.50 mmol/L浓度SA浸泡黑麦草草种24 h,待幼苗长至三叶一心时,用20%的PEG6000溶液进行水分胁迫处理,对照用经清水浸种后萌发的幼苗进行相同的水分胁迫处理,在胁迫的第0、1、2、3、4天取黑麦草所有叶片测定相关生理指标。试验重复3次。
发芽势以第3天发芽种子数计算,发芽率以第7天发芽种子数计算,并测幼苗的鲜质量和干质量。SOD、POD、过氧化氢酶(CAT)和MDA采用陈建勋[11]的方法测定,质膜相对透性、游离脯氨酸采用李合生[12]的方法测定。数据均采用Excel和DPS 2000统计软件分析。
2 结果与分析
2.1SA浸种对黑麦草种子萌发的影响 不同浓度SA浸种处理均可显著提高黑麦草种子的发芽率、发芽势,以及幼苗的鲜质量和干质量,其中以0.50 mmol/L处理促进效应最为显著(表1)。因此,选取0.50 mmol/L浓度SA对幼苗进行水分胁迫试验。
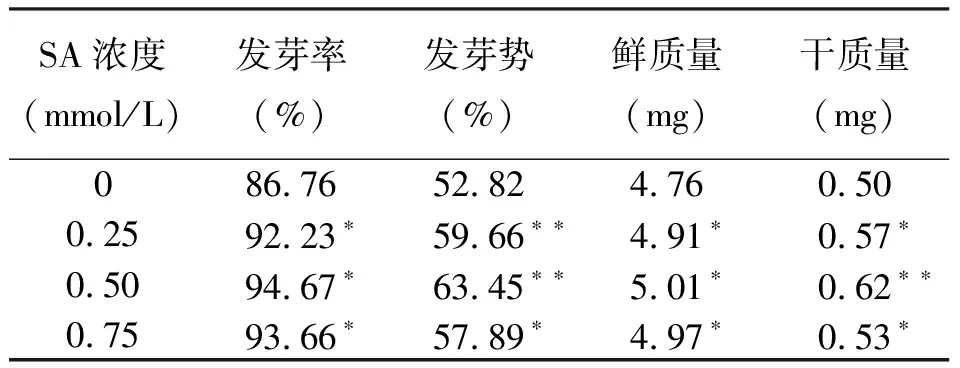
表1 SA对黑麦草种子萌发幼苗生长的影响
2.2水分胁迫下SA浸种对黑麦草幼苗叶片质膜透性和MDA含量的影响 随水分胁迫时间的增长,对照与处理植株的质膜相对透性均呈上升趋势;处理植株质膜相对透性显著低于对照植株,如胁迫第4天,处理植株质膜透性仅为对照植株的63.61%(图 1)。

图1 0.50 mmol/L SA浸种对水分胁迫下黑麦草幼苗叶片质膜透性的影响
黑麦草幼苗受水分胁迫后,叶片中MDA含量随胁迫时间的延长而增大。0.50 mmol/L SA处理的黑麦草幼苗的MDA增长幅度要明显低于对照植株,如在胁迫第4天对照植株的MDA含量是处理植株的1.48倍(图 2)。
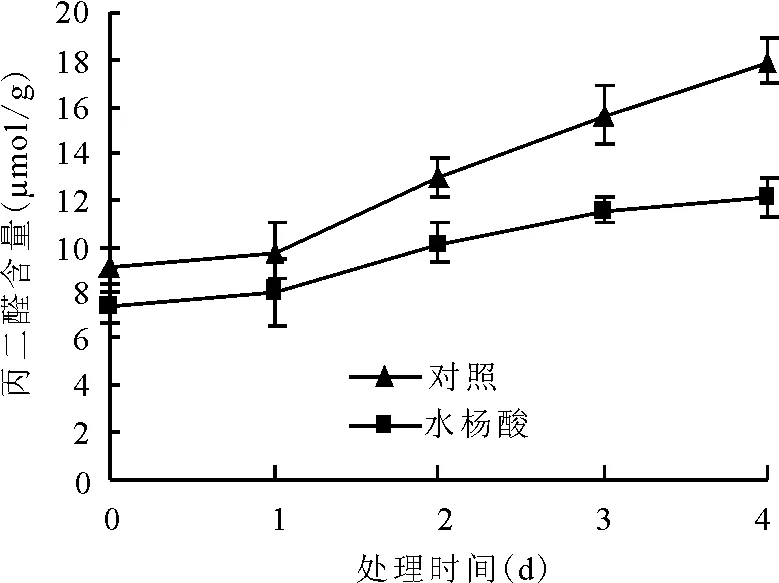
图2 0.50 mmol/L SA浸种对水分胁迫下黑麦草幼苗叶片MDA含量的影响
2.3水分胁迫下SA浸种对黑麦草幼苗叶片游离脯氨酸含量的影响 对照与SA处理植株黑麦草叶片中的脯氨酸含量均随胁迫时间的延长而升高。但经0.50 mmol/L SA处理的植株体内脯氨酸含量显著高于对照植株,在胁迫第4天差异达到最大,处理植株为对照植株的2.28倍(图 3)。

图3 0.50 mmol/L SA浸种对水分胁迫下黑麦草幼苗叶片游离脯氨酸含量的影响
2.4水分胁迫下SA浸种对黑麦草幼苗叶片POD、SOD和CAT活性的影响 水分胁迫下,对照植株与处理植株的POD和SOD活性均呈现先上升后下降的趋势,对照植株POD在第1天达到最大值,随后缓慢下降;而处理植株在第2天达到最大值之后缓慢下降,且长时间维持较高水平(图4)。对照植株与处理植株的SOD活性均在胁迫第2天时达到最大之后缓慢下降,但处理植株的SOD活性高于对照植株,表明水分胁迫下适宜浓度的SA处理,可以诱导叶片SOD活性的升高,从而增强植物的抗旱能力(图4)。水分胁迫下,对照植株的CAT活性在水分胁迫第1天急剧升高,第2、3、4天一直是下降趋势,处理植株一直处于相对稳定状态,在第1天略有降低,在第2、3、4天缓慢升高,从第2天开始处理植株的CAT活性一直高于对照植株(图4)。
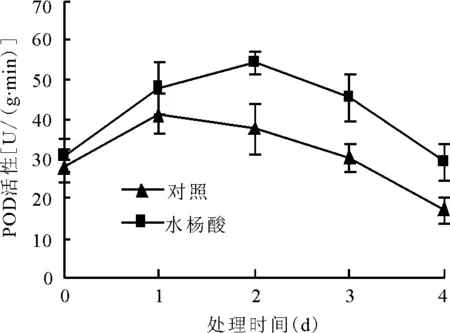


图4 0.50 mmol/L SA浸种对水分胁迫下黑麦草幼苗叶片POD、SOD和CAT活性的影响
3 讨论
水分胁迫对植物伤害的机理之一是破坏膜系统的完整性,降低对外界物质的选择透过性。植物细胞主要是由膜系统组成的多分子动体系。膜结构功能伤害的机理可能是脱水引起构型改变、活性氧伤害、膜脂过氧化作用而降解膜蛋白等[13]。黑麦草在水分胁迫下,水杨酸处理使植株质膜相对透性增长缓慢,说明水杨酸能缓解水分胁迫对黑麦草的伤害。本研究表明,水杨酸能够有效地维持水分胁迫下叶片丙二醛的低含量,这与水杨酸对棉花(Gossypiumsp.)抗旱性的研究结果一致[14]。可能是外源水杨酸抑制了水分胁迫下黑麦草活性氧的产生,激发了抗氧化酶活性,缓解了丙二醛的增长;同时还可能是水杨酸降低了因丙二醛的积累与蛋白质结合引起的蛋白质分子内和分子间的交联所导致的膜结构和功能的破坏,保护了质膜,阻止了膜透性提高,从而延缓了黑麦草的缺水反应,表现为植物受旱害程度的减轻。
脯氨酸积累可以提高细胞的渗透势,增强膜结构在缺水条件时的稳定性,减少干旱对叶片细胞的伤害作用[15]。在水分胁迫过程中,植物体内脯氨酸含量会发生适应性改变。本研究中,随着水分胁迫强度的增大,对照植株与处理植株的脯氨酸含量都呈现上升趋势,经过水杨酸处理的植株在第1天之后大量积累,可能因为水杨酸激发了脯氨酸代谢过程中的D’-吡咯啉-5-羧酸合成酶和脯氨酸脱氢酶的活性,也不能排除水杨酸可能会阻止脯氨酸降解的因素。
水杨酸可能直接或间接地参与了抗氧化保护酶系统的生理响应过程。本研究表明,水杨酸能明显影响水分胁迫下黑麦草的生理生化过程。在胁迫过程中,过氧化物酶和超氧化物歧化酶随胁迫的加强呈现先上升后下降的趋势,处理植株的过氧化物酶和超氧化物歧化酶活性始终高于对照植株,表明水杨酸浸种可提高植株水分胁迫期间过氧化物酶和超氧化物歧化酶活性,从而提高抗旱性,这与水杨酸浸种对玉米(Zeamays)幼苗抗旱性的研究结果相同[5];处理植株与对照植株的过氧化氢酶活性在胁迫期间变化趋势不同,对照植株的过氧化氢酶活性对水分胁迫反应敏感,而水杨酸处理植株的过氧化氢酶活性对水分胁迫的反应相对平稳,这可能暗示水杨酸浸种处理可提高过氧化氢酶的稳定性以抵御水分胁迫。超氧化物歧化酶、过氧化物酶、过氧化氢酶是植物体内酶促防御系统的3个重要保护酶,保护酶活性的变化与植物的抗旱能力紧密相连,水杨酸浸种后超氧化物歧化酶、过氧化物酶和过氧化氢酶对水分胁迫的两种不同反应机制及其可能的生理意义还有待进一步深入研究。
[1] 李德红,潘瑞炽.水杨酸在植物体内的作用[J].植物生理学通讯,1995,31(2):144-149.
[2] 杨江山,种培芳,费赟.水杨酸对甜瓜种子萌发及其生理特性的影响[J].甘肃农业大学学报,2005,40(1):38-41.
[3] Shakirova F M,Sakhabutdinova A R,Bezrukova M V,etal.Changes in the hormonal status of wheat seedlings induced by salicylic acid and salinity[J].Plant Science,2003,164:317-322.
[4] 王晓多,陆远柱,杨九英.水杨酸浸种对豌豆种子萌发及幼苗生长的影响[J].种子,2007,26(8):42-44.
[5] 杨玲,袁月星,谢双琴.次适温下水杨酸浸种对水稻种子萌发的效应[J].植物生理学通讯,2001,37(4):288-290.
[6] 穆瑞霞,阮云飞,王吉庆,等.不同浓度水杨酸浸种对大葱种子萌发及生理特性的影响[J].植物保护科学,2008,24(6):370-373.
[7] Mittler R.Oxidative stress,antioxidants and stress tolerance[J].Trends Plant Science,2002,7:405-410.
[8] Ji B H,Zhu S Q,Jiao D M.Photochemical efficiency of PSⅡand membrane lipid peroxidation in leaves of indica and japonica rice (Oryzasativa) under chilling temperature and strong light stress conditions[J].Acta Botanica Sinica,2002,44(2):139-146.
[9] 许明丽,孙晓艳,文江祁.水杨酸对水分胁迫下小麦幼苗叶片膜损伤的保护作用[J].植物生理学通讯,2000, 36(1):35-36.
[10] 束良佐,李爽.水杨酸浸种对水分胁迫下玉米幼苗某些生理过程的影响[J].南京农业大学学报,2002,25(3):9-11.
[11] 陈建勋.植物生理学实验指导[M].广州:华南理工大学出版社,2005.
[12] 李合生.植物生理生化试验原理和技术[M].北京:高等教育出版社,2000.
[13] 周小梅,赵运林,周朴华.2种草坪草幼苗抗渗透胁迫能力比较[J].草业科学,2008,25(2):121-123.
[14] 牟筱玲,张子学.水杨酸浸种对棉花幼苗抗旱性的影响[J].种子,2008,27(11):50-56.
[15] 赵瑞雪,朱慧森,程钰宏,等.植物脯氨酸及其合成酶系研究进展[J].草业科学,2008,25(2):90-96.
