封育和放牧对黄土高原典型草原生物量的影响
2011-04-25陈芙蓉程积民于鲁宁吴艳芹
陈芙蓉,程积民,于鲁宁,李 媛,吴艳芹
(1.中国科学院水利部水土保持研究所,陕西 杨凌 712100;2.西北农林科技大学资环学院,陕西 杨凌 712100;3.西北农林科技大学动物科技学院,陕西 杨凌 712100)
生物量指植物生长发育产生的物质总量(地上现存量和地下根系)。作为生态系统最基本的数量特征,是群落结构和功能的主要测度指标之一[1]。地上生物量是群落生产力水平的一个重要功能指标,反映群落在特定时段内积累有机物质的能力[2]。地下生物量是指存在于植被地下根系和根茎生物量的总和[3]。Scurlock和Hall[4]、Mokany等[5]认为地下生物量占草地总生物量的80%以上,是草地土壤碳库最主要的输入源,在草地碳循环中起着关键作用。植物生物量地上/地下分配方式反映植物的生长策略,并且会影响生产力和土壤碳输入,进而影响陆地生态系统碳循环[6-7]。国内对生物量的研究已经相当广泛和深入[2,8-9],但对于黄土高原典型草原生物量的研究相对较少。
黄土高原典型草原不仅是重要的生态屏障和牧民赖以生存的基本生产资料,也在维持生态平衡、调节气候、保持水土等方面占据重要地位,对维护生态安全,促进牧区经济发展十分重要[10]。然而,由于人口与家畜数量的剧增,目前典型草原面临着生产能力下降、草原大面积退化等严重问题,从而进一步影响全球碳循环和气候变化。放牧是草地常见的干扰方式,通过牲畜的采食、践踏及排泄物的输入直接或间接对草地生态系统产生影响,从而影响草地生态系统的物质生产和能量分配,间接改变草地群落结构和地下生物量等[11]。封育可以通过自然力的作用使退化草地的植被与土壤得到恢复和重建[12]。封育一方面控制牲畜对草地植被的啃食与践踏,给草地恢复提供保障,改善退化草地植物群落种类组成、盖度、高度和地上生物量,逐步恢复草地群落结构和功能[13];另一方面植被的恢复可使地表凋落物及根系周转向土壤输入更多的营养[14],增加地下生物量和草原碳蓄积量。因此,封育在国内外已经得到较为广泛的应用[15-16]。
本研究以黄土高原典型草原区(云雾山自然保护区)天然草地为对象,对放牧和封育的群落结构、地上和地下生物量进行比较分析,进一步探讨地下生物量的形成规律和生物量地上/地下的分配方式,弄清地下生物量的草地植被源汇功能,以期为草地资源的合理利用与有效管理及草地畜牧业的可持续发展提供指导,进一步为建设和保护黄土高原典型草原区生态环境提供科学参考,同时也将为云雾山自然保护区合理规划和有效管理提供基础资料。
1 材料与方法
1.1试验区自然概况 试验区位于宁夏固原云雾山草原自然保护区,地理位置106°24′~106°28′ E,36°13′~36°19′ N,面积6 700 hm2,海拔1 800~2 100 m,年均温5 ℃,最热月为7月,气温为22~25 ℃,最冷月为1月,最低气温-14 ℃,≥10 ℃年积温2 100~3 200 ℃·d。年降水量400~450 mm,降水季节分配不均,全年65%~75%的降水集中在7-9月,蒸发量1 330~1 640 mm。土壤类型为山地灰褐土和黑垆土。该区自1982年开始封育,植被主要是温带典型草原,其建群种和优势种有本氏针茅(Stipabungeana)、百里香(Thymusmongolicus)、铁杆蒿(Artemisiasacrorum)、大针茅(S.grandis)、冷蒿(A.frigida),伴生种以猪毛蒿(A.scoparis)、百里香、星毛委陵菜(Potentillaacaulis)为主,其中丛生禾本科植物本氏针茅在该区分布范围最广[17]。
1.2试验方法 封育区选择云雾山封育30年的样地,采用铁丝网围栏,完全排除家畜的踩食,放牧区为自然状态(排除人为刈割)。调查样地选择植物生长均匀、微地形差异较小、面积较大的样区,调查时间为2010年8月(地上生物量达到极大值),在封育区和放牧区选择有代表性的样地调查取样。
1.2.1植物群落结构调查 采用随机区组设计,在放牧和封育区两个样地随机取5个50 m×50 m的样区(样区间距大于500 m),在每个样区采用对角线取样法,在样区四角及中心部位各设置1个样方(50 cm×50 cm),共5个样方作为重复。调查每个样方中出现的物种及其高度、盖度,并记录优势种及样地经纬度、海拔、温度、湿度等。
1.2.2生物量的测定 包括地上和地下生物量两个部分。地上生物量用收割法测定:将5个样方中的地上现存生物量分种取样、齐地面刈割,除去黏附的土壤、砾石、杂物等,在野外称其鲜质量后全部带回实验室,在70±5 ℃条件下烘至质量不变。地下生物量用挖掘法测定:测定地上生物量的同时,在放牧和封育5个样区随机选3个样区取样,在对应收割地上生物量的位置,扫除地表杂物按25 cm×25 cm的样方面积,分5层取样,分别为0~10、10~20、20~30、30~40、40~50 cm土层,3次重复,分别装袋,由于难以区分地下死、活根系,本研究地下生物量包括死根。每层土块体积25 cm×25 cm×10 cm(高),用水洗分离法(采用土筛洗根,桶沉淀土和沙子),洗干净后,捡去石块和其他杂物,带回实验室在70±5 ℃条件下烘至质量不变。
1.3数据处理
1.3.1生物量和群落结构 把地上、地下生物量换算为单位面积的生物量(g/m2),计算群落总盖度和植物平均高度。由Shapiro-Wilk检验发现生物量(地上和地下)、高度和盖度数据符合对数正态分布,利用ANOVA随机区组设计分析放牧和封育两种方式间地上和地下生物量的差异。
1.3.2地下生物量的垂直分布 为定量表达地下生物量的垂直分布,将土壤剖面划分为5层(0~10、10~20、20~30、30~40、40~50 cm),通过处理得到各层根系质量和各层根质比例。T-test分析每一土层放牧和封育区生物量的差异,并分别计算每层地下生物量所占的百分比。采用0~10 cm地下生物量占其总量(0~50 cm地下生物量)的比例反映地下生物量分布的集中程度[18],0~10 cm占的比例越高,就表示地下生物量分布越浅,反之越深[19]。
以上数据均利用数理统计法进行处理,主要借助Excel 2003和SAS V8统计软件进行处理和分析。
2 结果
2.1群落结构和生物量的大小 在放牧和封育两个样地中,通过样方调查共收集到54种植物,放牧区43种,封育区47种,两者物种数量差异不显著(P>0.05)。在封育区,植物总盖度为71%,平均高度为25.45 cm;在放牧区,植物总盖度为63%,平均高度为9.78 cm。封育区较放牧区植被盖度增加了8.2%,高度增加了15.67 cm,说明封育措施显著增加了植物群落的盖度(P<0.05)和高度(P<0.01)(图1)。
封育对草地地上和地下生物量都有影响(表1)。与放牧区相比,封育提高了黄土高原典型草原的生物量,封育区的总生物量为3 254.91 g/m2,而放牧区的仅为2 703.16 g/m2;封育区对应的地上生物量为242.80 g/m2,放牧区的地上生物量略少于封育区,为211.49 g/m2,两者没有显著差异(P>0.05);与放牧区相比,封育后地下生物量提高了515.36 g/m2,但差异也不显著。地上生物量远小于相对应的地下生物量,不管是放牧区还是封育区,地下生物量是地上生物量的10多倍。在地下、地上总生物量中,地下部分占了91%(表1)。
2.2地下生物量的形成规律 黄土高原典型草原封育和放牧区地下生物量的垂直分布均呈典型的倒金字塔型或T字形趋势下的锯齿状分布(图2)。封育和放牧间地下生物量的垂直分布没有明显变化,但在0~50 cm各层封育区的地下生物量都高于放牧区。地下生物量主要分布在0~10 cm深的土层中,随着土层深度的增加,地下生物量快速降低,符合指数函数减小的规律(表1)。

图1 放牧和封育下植物群落平均高度和总盖度
放牧和封育区地下生物量在不同土层的分布也有一定的差异(图3)。放牧区0~10 cm的地下生物量达1 272.46 g/m2,占总地下生物量的59%,封育区0~10 cm的地下生物量达1 530.54 g/m2,占地下总生物量57%。10~20和40~50 cm土层地下生物量放牧和封育区所占比例相同,分别均为19%和4%;20~30 cm土层放牧区所占比例略高于封育区,分别为12%和11%;30~40 cm土层,封育区略高于放牧区,分别为9%和7%;可见,封育和放牧区接近80%的地下生物量主要集中在0~20 cm土层,而且各层的分配比例不尽相同。放牧区0~10 cm地下生物量所占的比例高于封育区,说明放牧区植物根的分布较浅。

表1 黄土高原典型草原放牧和封育区生物量
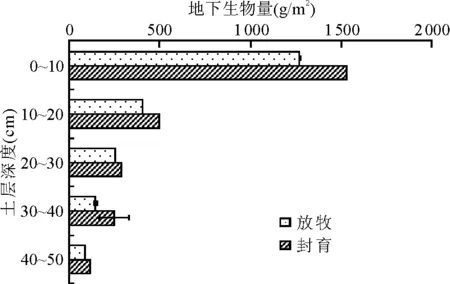
图2 黄土高原典型草原地下生物量垂直分布特征
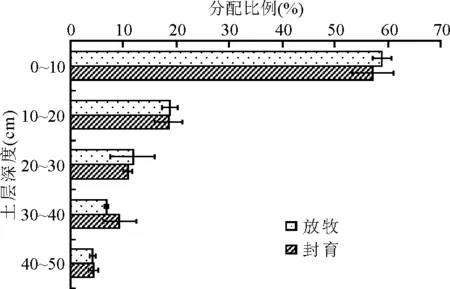
图3 封育和放牧区不同土层地下生物量的分配比例
从地下生物量的空间变异性看出,在0~50 cm土层深度,放牧和封育区的地下各层生物量变化幅度都很大(表2)。放牧区地下各层生物量在71.95~1 348.80 g/m2变动,封育区在65.87~1 738.77 g/m2变动,放牧区和封育区地下生物量各层差异相似:0~10 cm土层地下生物量与其他4层差异显著(P<0.05),10~20与30~50 cm土层差异也显著,其他3层之间差异不显著(P>0.05)。
变异系数(CV)的大小反映变量空间变异性的大小,按照变异系数的划分等级为:弱变异性,CV<10%;中等变异性:10%
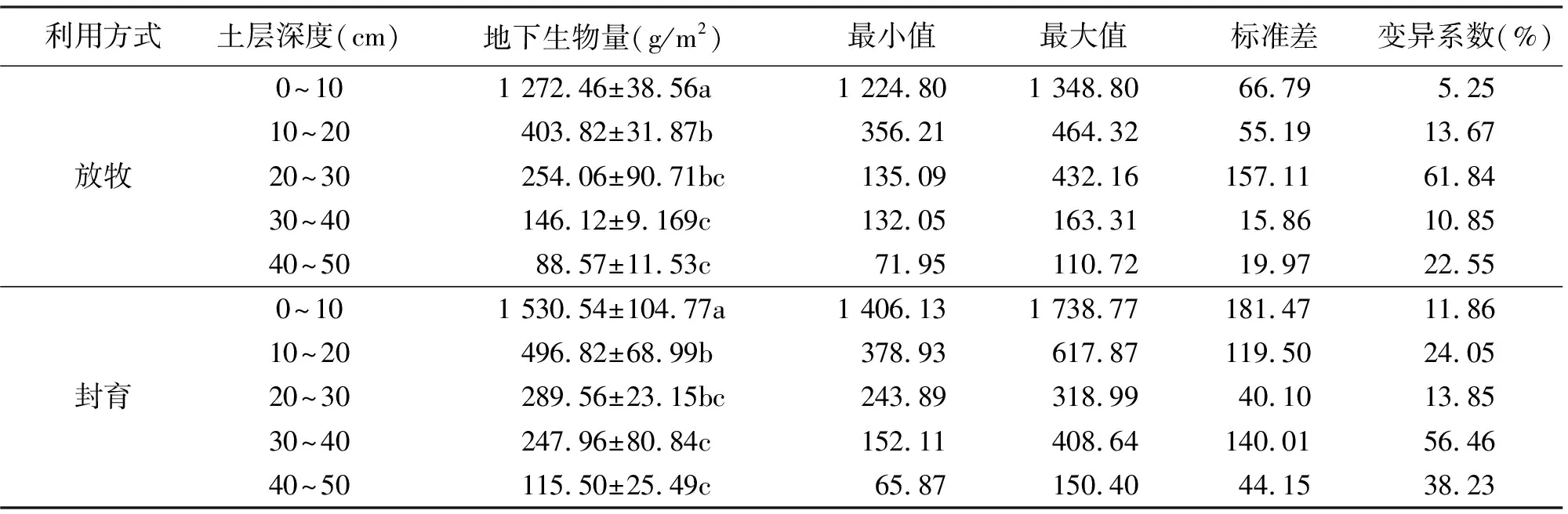
表2 两种利用方式不同土层深度地下生物量统计分析表
2.3地下生物量/地上生物量 黄土高原典型草原放牧区和封育区地下生物量/地上生物量分别为10.24和11.04(表1)。说明在黄土高原典型草原区,地下生物量占很大比例,因为在半干旱的气候条件下,植物通过其根部贮藏物质以保证其正常生长,从而促进根系发育,增大地下生物量/地上生物量,这是半干旱地区植物长期适应环境的结果,而且地下生物量/地上生物量越大,地下生物量就越高。
3 讨论与结论
3.1生物量的变化 比较封育和放牧区草地生物量的变化对研究草地生态系统的自我恢复机制具有重要意义[1]。本研究表明,与放牧相比,封育措施增加了黄土高原典型草原植被的盖度和高度。这与王英舜等[21]研究退化典型草地采取封育措施后盖度和高度都增加的结论一致;由于研究区域不同,气候不同,本研究选取的黄土高原典型草原的生物量(地上242.80 g/m2,地下2 680.39 g/m2)远高于马文红等[18]研究的内蒙古温带典型草地生物量(地上133.3 g/m2,地下688.9 g/m2),地下生物量高于Ni[22]对典型草原的估算(1 777.7 g/m2),是因为本研究没有区分活根和死根,计算结果偏大。
放牧区和封育区生物量的差异与围栏作用密切相关。封育控制了牲畜的采食与践踏,促进植物生长,增加了植物的高度和群落盖度,对群落地上植被和表层土壤形成了保护,植物进行光合作用的面积大于放牧区[23],使地上生物量积累较多,因而它向下输送的营养物质也较多,地下生物量也多。总体上说,封育区的生物量(地上、地下)大于放牧区。
3.2地下生物量的垂直分布 地下生物量是草原生态系统生产力的重要组成部分,研究群落地下生物量的分布规律对了解草原生态系统的物质循环过程有重要意义[18]。黄土高原典型草原封育和放牧群落的地下生物量均呈典型的倒金字塔型或T字形趋势下的锯齿状分布,这与前人研究[24-25]结果一致。封育和放牧区地下各层生物量变化幅度很大,其中0~10 cm土层地下生物量与其他4层差异显著;0~50 cm土层内地下生物量差异不显著,而张玉勋[26]发现不同放牧强度下围栏内外羊草(Leymuschinensis)草地0~30 cm活根量差异显著。地下生物量与土层深度呈指数函数相关关系(y=aebx),这与早期研究结果一致[27],而Bartost和Sims[28]研究得出地下生物量占总生物量的百分数与深度呈线性关系。
黄土高原典型草原地下生物量主要分布在0~10 cm土层中,有向表层土壤聚集的趋势,有利于在半干旱地区对有限降水的有效利用,这与Schenk和Jackson[29]在全球尺度上得到的Prairie草地根系垂直分布一致。地下生物量的垂直分布特征与黄土高原半干旱的气候、土壤关系密切。该地区水热同季[10],大部分有机质和养分储存于土壤表层,植物将大部分根系分布在0~10 cm的表土层中,以获取更多的热量、水分和矿质营养来满足生长需求,同时表层土壤通气条件较好,这些都为根系的生长发育创造了较有利的条件,随着土壤深度的增加,土壤温度、含水量和质地条件变差,根量也随之减少。这显示了典型草原植物对干旱生境的适应性[30]。
3.3生物量地上/地下分配方式 天然草地地下与地上生物量的比值可反映分配给地下部分的光合产物的比例,一定量的光合产物用于地下越多,分配到地上的必然会越少。地上生物量和地下生物量息息相关,既互相依存,又互相竞争,构成一个比例协调且与环境条件相适应的有机整体[31]。
Coupland[32]认为地下生物量/地上生物量一般在2~13变化。黄土高原典型草原放牧和封育区地下生物量/地上生物量分别为10.24和11.04。这一结果与黄土丘陵区白羊草(Bothriochloaischaemum)群落地下生物量/地上生物量一致[32],但比内蒙温带草地、青藏高寒草地的值高[33]。植物这种地下、地上生物量的分配,与黄土高原区干旱的限制分不开。植物面临水分胁迫时会将光合产物更多地分配到根系[34]。地上生长若不能增加光合产物,维持生长,对植物个体而言就是巨大的浪费。因此,将更多的产物转入地下储存不失为一种好的生存策略[24]。一般低温、干旱和放牧能使地下生物量/地上生物量值增大[35]。而本研究封育区的比值高于放牧区,因为放牧区植被覆盖度低,地表温度随之升高,所以土壤的蒸发强,水分减少,相对而言封育区水分多促进了根系的发育。
研究草地群落的地下、地上生物量分配方式一方面对草地生产具有十分重要的意义[36]。在黄土高原区土壤水分和养分条件都很差的情况下[37],地下生物量很大,而地上生物量却很小,所以当地下生物量/地上生物量值很大时,有利于保持水土,却不利于生产水平的提高。另一方面生物量地上、地下分配会影响陆地生态系统的碳循环,本研究表明,黄土高原典型草原地下生物量占总生物量的91%,对土壤碳库是一种巨大的来源。所以在进行天然草地的利用和管理时,应采用不同的草地利用方式,从而找到对本区最适的方式,使地下生物量/地上生物量较高(但却比前者低得多),不仅保持水土,提高产量,而且增加土壤碳储量,削弱温室效应。
[1]周国英,陈桂琛,徐文华,等.围栏封育对青海湖地区芨芨草草原生物量的影响[J].干旱区地理,2010,33(3):434-441.
[2]魏晶,吴钢,邓红兵.长白山高山冻原植被生物量的分布规律[J].应用生态学报,2004,15(11):1999-2004.
[3]黄德华,陈佐忠,张鸿芳.贝加尔针茅、克氏针茅、线叶菊草原地下生物量的比较研究[A].见:内蒙古草原生态系统定位站.草原生态系统研究(第2集)[C].北京:科学出版社,1988.
[4]Scurlock J M O,Hall D O.The global carbon sink:a grassland perspective[J].Global Change Biology,1998,4(2):229-233.
[5]Mokany K,Raison R J,Prokushkin A S.Critical analysis of root:shoot ratios in terrestrial biomass[J].Global Change Biology,2006,11(1):84-96.
[6]Kuzyakov Y,Domanski G.Carbon input by plants into the soil[J].Journal Plant Nutrition Soil Science,2000,163:421-431.
[7]Litton C M,Raich J W,Ryan M G.Carbon allocation in forest ecosystems[J].Global Change Biology,2007,13:2089-2109.
[8]韩文军,春亮,侯向阳.过度放牧对羊草杂类草群落种的构成和现存生物量的影响[J].草业科学,2009,26(9):195-199.
[9]王仁忠,李建东.放牧对松嫩平原羊草草地影响的研究[J].草业科学,1992,9(2):11-14.
[10]程积民,万惠娥.黄土高原植被建设与水土保持[M].北京:中国林业出版社,2002.
[11]仁青吉,崔现亮,赵彬彬.放牧对高寒草甸植物群落结构及生产力的影响[J].草业学报,2008,17(6):134-140.
[13]程积民,邹厚远.封育刈割放牧对草地植被的影响[J].水土保持研究,1998,5(1):36-54.
[14]闫玉春,唐海萍,辛晓平,等.围封对草地的影响研究进展[J].生态学报,2009,29(9):5039-5046.
[15]McItosh P D, Allen R B,Scott N.Effects of exclosure and management on biomass and soil nutrient pools in seasonally dry high country,New Zealand[J].Joumal of Environmental Management,1997,51:169-186.
[16]都耀庭,张东杰.禁牧封育措施改良高寒地区退化草地的效果[J].草业科学,2007,24(7):22-24.
[17]宁夏云雾山草原自然保护区管理处.宁夏云雾山自然保护区科学考察与管理文集[M].银川:宁夏人民出版社,2001.
[18]马文红,杨元合,贺金生,等.内蒙古温带草地生物量及其与环境因子的关系[J].中国科学:生命科学,2008,38(1):84-92.
[19]Jobbágy E G,Jackson R B.The vertical distribution of soil organic carbon and its relation to climate and vegetation[J].Ecological Applications,2000,10(2):423-436.
[20]王政权.地统计及在生态学中的应用[M].北京:科学出版社,1999.
[21]王英舜,师桂花,许中旗,等.锡林郭勒放牧草地封育后植被恢复过程的研究[J].草业科学,2010,27(8):10-14.
[22]Ni J.Estimating net primary productivity of grasslands from field biomass measurements in temperate northern China[J].Plant Ecology,2004,174(2):217-234.
[23]康博文,刘建军,侯琳,等.蒙古克氏针茅草原生物量围栏封育效应研究[J].西北植物学报,2006,26(12):2540-2546.
[24]鄢燕,张建国,张锦华,等.西藏那曲地区高寒草地地下生物量[J].生态学报,2005,25(11):2818-2823.
[25]姜海楼,董瑞音,贾长友.麻黄生物学特性及生物量研究[J].草业学报,1997,6(1):18-22.
[26]张玉勋.羊草草地植被对放牧和保护的反应[J].中国草地,1995(1):1-5.
[27]孙立安,梁一民,刘国彬.草地地下生物量研究综述[J].草原与草坪,1993(1):6-14.
[28]Bartos D L,Sims P L.Root dynamics of a shortgrass ecosystem[J].Journal of Range Management,1974,27:33-36.
[29]Schenk H J,Jackson R B.The biogeography of roots[J].Ecological Monographs,2002,72(3):311-328.
[30]张娜,梁一民.黄土丘陵区天然草地地下/地上生物量的研究[J].草业学报,2002,11(2):72-78.
[31]胡中民,樊江文,钟华平,等.中国草地地下生物量研究进展[J].生态学杂志,2005,24(9):1095-1101.
[32]Coupland R T.Grassland ecosystems of the world:analysis of grasslands and their uses[M].Cambridge:Cambridge Uniwersity Press,1979.
[33]王亮,牛克昌,杨元合,等.中国草地生物量地上-地下分配格局:基于个体水平的研究[J].中国科学:生命科学,2010,40(7):642-649.
[34]平晓燕,周广胜,孙敬松.植物光合产物分配及其影响因子研究进展[J].植物生态学报,2010,34(1):100-111.
[35]平晓燕,周广胜,孙敬松.植物光合产物分配及其影响因子研究进展[J].植物生态学报,2010,34(1):100-111.
[36]Eddy M,Argenta T.Aboveground and belowground biomass relations in steppes under different grazing conditions[J].Oikos,1989,56:364-370.
[37]程积民,万惠娥,王静,等.黄土丘陵区沙打旺草地土壤水分过耗与恢复[J].生态学报,2004,24(12):2979-2983.
