同时伴有t(8;21)和inv(16)/t(16;16)染色体易位的急性髓系白血病:实验室诊断
2011-04-24胡延平张旻昱张振忠崔丽芬张继红
胡延平,张旻昱,张 男,陈 芳,张振忠,崔丽芬,张继红
非随机染色体易位是人类白血病常见的染色体异常,迄今发现的染色体易位已超过300多种,其中t(8;21)和inv(16)/t(16;16)是急性髓系白血病(AML)中比较常见的两种异常核型,二者可分别产生AML1/ETO和核心结合因子-β(CBFβ)/平滑肌肌球蛋白重链基因 (MYH11)融合基因,在临床上具有较良好的预后,完全缓解率 (CR)高[1-2]。原发性的染色体异常通常比较单一,且与AML的特定亚型存在密切相关性,约55%的伴核型异常的AML病例表现为单一的染色体改变,并且单一核型较复杂核型有较好的临床预后[3]。我院收治的这例患者同时具有t(8;21)和inv(16)/t(16;16)染色体易位,该异常在AML极为少见,现对该患者的实验室诊断特点进行详细探讨,同时对核心结合因子-急性髓系白血病 (CBF-AML)进行研究。
1 病例简介
患者,女,33岁,以“乏力1个月,贫血,发现下肢出血点”为主诉于2010-11-13入院。
体格检查:贫血貌,周身皮肤和黏膜无出血点和瘀斑,浅表淋巴结未触及,睑结膜无黄染,胸骨无压痛。肝肋下未及,脾不大,无压痛。
实验室检查:(1)血常规:白细胞(WBC)3.1×109/L,红细胞 (RBC)2.0×1012/L,血红蛋白 (Hb)79 g/L,血小板 (PLT)38×109/L。(2)骨髓细胞形态学检查:骨髓增生活跃,粒∶红=1 000∶42。粒系异常增生,原始粒细胞和早幼粒细胞占33.20%,形态特点为胞体多呈类圆形或椭圆形,胞质量少,天蓝色,可见Auer小体,胞核多规则,核质呈细颗粒状,分布均匀,核仁2~5个,核仁周界明显。嗜酸粒细胞比值增高占5.60%。单核细胞系统异常增生。原有单核细胞占20.00%,特点为胞体较大,成不规则形,胞质量丰富,成不透明灰蓝色,可见细长Auer小体及细小嗜天青颗粒,胞核大,圆形,易见扭曲、折叠等现象,核质纤细,疏松成网状,核仁1~2个 (见图1)。组织化学染色:髓过氧化物酶染色 (MPO)强阳性32%,弱阳性24%;碱性磷酸酶染色 (NAP)阴性。(3)免疫分型:应用流式细胞仪 (美国BD公司FACSCalibur)间接免疫荧光法和一组单抗检测白血病细胞的表面抗原。CD452SSC设门,软件分析数据,计算白血病细胞表达抗原百分数。以自身细胞加IgG为阴性对照,超过阴性对照20%为阳性。免疫分型结果:异常髓系细胞占40.65%,表达 HLA-DR(89.22%)、CD38(99.40%)、 CD34(88.11%)、CD56(89.40%)、 CD117(84.10%)、CD15(22.86%)和CD19(42.87%);阴性:CD33、 CD2、 CD7、 CD10、 CD9、CD16、CD4、CD11b、CD14和 CD64。诊断为AML。(4)分子生物学检查:采用白血病融合基因AML1/ETO和CBFB/MYH11检测试剂盒 (核酸扩增荧光定量法,上海申有生物技术公司),提取RNA,配制反应体系,分别设置实验组,阴性对照组,阳性对照组进行AML1/ETO、CBFβ/MYH11和ABL PCR反应,以参比品ABL设置标准曲线。分子生物学检测结果:AML1/ETO阳性;CBFβ/MYH11阳性。(5)常规染色体核型分析:采用骨髓细胞直接法和24 h培养法制备染色体,应用RHG显带技术进行分析。核型异常按照《人类细胞遗传学国际命名体制(ISCN1995)》加以描述。染色体核型分析结果:对20个中期分裂象进行染色体核型分析,有11个细胞显示46,xx,t(8;21)(q22;q22)异常,9个细胞为46,xx。inv(16)是一种微小的染色体异常,常规染色体检测未发现 (见图2)。(6)FISH检测:采用 AML1/ETO和CBFβ/MYH11检测试剂盒 (荧光原位杂交法,北京金菩嘉生物技术公司),以10例正常人骨髓建立阈值,每份样本分析500个细胞,计算出显示异常信号的细胞数,异常阈值=平均值 (M)+3×标准差 (SD)。FISH检测结果:32.00%和24.00%的细胞显示异常信号,显著高于阈值,提示该患者骨髓细胞内存在AML1/ETO和 CBFβ/MYH11易位 (见图3、4)。以上实验室检查均来自中国医科大学附属盛京医院。
为求进一步诊治,后转入中国医学科学院血液病研究所,确诊为M4Eo,行标准DA方案 (柔红霉素、阿糖胞苷)诱导化疗,患者获得CR。

图1 骨髓细胞形态学Figure 1 Morphological examination

图2 常规染色体RHG显带Figure 2 Conventional chromosome RHG banding
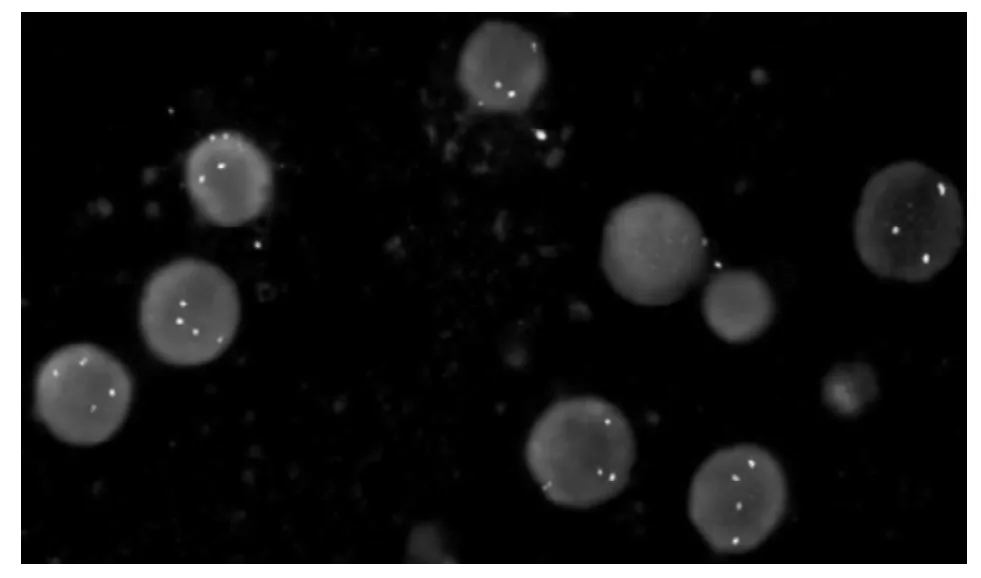
图3 FISH检测AML1/ETOFigure 3 Detection of AML1/ETO by FISH

图4 FISH检测CBFβ/MYH11Figure 4 Detection of CBFβ/MYH11 by FISH
2 讨论
t(8;21)和inv(16)/t(16;16)异常核型常见于两个不同的AML亚型,但因为扰乱CBF转录因子的功能和较好的临 床 预 后 被 称 为 CBF - AML[4-5]。WHO分型将二者列入伴重现性遗传学异常AML,命名为AML伴有t(8;21)和AML伴有inv(16)/t(16;16)。其中t(8;21)见于5% ~12%的 AML,它和M2(FAB分型)有特别的联系 (92%为M2,7%为 M4,个别为 M1),inv(16)(p13q22)见于10%~12%的AML和25%的M4(FAB分型)患者[6]。
该患者骨髓形态学诊断为M4Eo,骨髓各阶段嗜酸粒细胞增多,早、中幼嗜酸粒细胞颗粒粗大且不成熟,呈紫红色且密集。形态学上与典型的inv(16)/t(16;16) -而t(8;21)+的M2相比存在较大区别,MPO部分弱阳性,后来证明该部分细胞为幼稚单核细胞;原始细胞内Auer小体多为细长型,而M2中Auer小体多为短粗型,而且该患者并不存在M2中常见的粒系病态造血,即核幼质老现象。形态学上与典型的inv(16)/t(16;16)+而t(8;21) -的M4Eo患者并无显著差异,因此诊断为M4Eo。在免疫分型上,该患者除表达AML常见的HLADR、CD45、CD38、CD34、CD117和 CD15外,还表达 CD19、CD56,有学者研究证明、患者常伴有 t(8;21)易位[7],与该病例相符。因为RHG显带技术的局限性,且inv(16)属于肉眼较难分辨的微小异常核型,细胞遗传学检查仅检测出t(8;21)异常,但分子生物学和FISH检测结果AML1/ETO和CBFB/MYH11均为阳性。
在分子生物学上,原位于21q22上的AML1和8q22上的锌指DNA结合因子ETO易位形成AML1/ETO融合基因,原位于16p13的MYH11和位于16q22的CBFβ基因断裂后并置在一起,形成CBFβ/MYH11 融合基因[8-9],二者参与了CBF-AML的致病。在定向造血过程中,CBF发挥着关键作用,这一因子由α/β两个亚基构成,其中AML1系 CBF的α亚单位,正常情况下它和CBFβ亚单位结合形成异二聚体的转录因子,从而调节许多与髓系生长和分化有关的基因表达。AML1/ETO融合基因通过对残存的正常CBFα/β转录因子的显性负调控作用,干扰了有关基因的表达,最终导致细胞的恶 性 转 化[10]。 和 AML1/ETO 一 样,CBFβ/MYH11由于阻断了 CBFα/β 的转录激活功能而导致关键靶基因表达诱导的阻断[11]。临床上t(8;21)患者对治疗反应佳,CR率高 (90%),平均生存期(MS)52个月。M4Eo化疗效果好,CR率接近100%,MS长达5年以上。该患者给予DA(3+7)方案获得CR[12]。
在对跨系白血病的研究中,一类细胞遗传学异常的细胞中嵌合另一种异常往往提示着其白血病干细胞系的杂合性[13],如本病例t(8;21)与inv(16)/t(16;16)的同时存在提示两群不同的白血病细胞同时存在,从而出现粒系和单核系同时受累的表现,形成M2/M4Eo双表型。但对于这些“双表型”白血病的分子机制还不明确,既可能是由于白血病的疾病细胞同时来源于两种不同的细胞系,也可能是随着病程的发展,出现了在一种细胞系来源的白血病基础上,继发另一种不同细胞系来源的新的白血病,关于其分子机制尚需进一步研究。
该病例的实验室诊断结果对CBFAML致病机制的研究具有重要意义,相信随着研究的深入,具有t(8;21)与inv(16)/t(16;16)染色体易位的AML同样可取得靶向治疗的成功。
1 Hamerschlak N.Leukemia:genetics and prognostic factors [J].J Pediatr,2008,84:S52-S57.
2 Mrózek K,Bloomfield CD.Clinical significance of themostcommon chromosome translocations in adult acutemyeloid leukemia [J].JNatl Cancer Inst Monogr,2008,39:52 -57.
3 Slovak ML,Kopecky KJ,Cassileth PA,et al.Karyotypic analysis predicts outcome of preremission and postremission therapy in adult acutemyeloid leukemia:a Southwest Oncology Group/Eastern Cooperative Oncology Group Study[J]. Blood,2000,96:4075 -4083.
4 Hart SM,Foroni L.Core binding factor genes and human leukemia [J].Haematologica,2002,87:1307-1323.
5 Speck NA,Stacy T,Marín - Padilla M,et al.Core - binding factor:a central player in hematopoiesis and leukemia[J].Cancer Res,1999,59:1789s-1793s.
6 Speck NA,Gilliland DG.Core-binding factors in haematopoiesis and leukaemia [J].Nat Rev Cancer,2002,2:502 -513.
7 Fan L,Wu YJ,Li JY,etal.Immunophenotypic analysis of acutemyeloid leukemia with t(8;21).Zhongguo Shi Yan Xue Ye Xue Za Zhi,2010,18:1410 -1413.
8 Wang J,Hoshino T,Liu JM,et al.ETO,fusion partner in t(8;21)acutemyeloid leukemia,represses transcription by interaction with the human N-CoR/mSin3/HDAC1 complex[J].Proc Natl Acad Sci USA,1998,95:10860-10865.
9 Liu P,Tarle SA,Hajra A,etal.Fusion between transcription factor CBF beta/PEBP2 beta and a myosin heavy chain in acute myeloid leukemia[J].Science,1993,261:1041-1044.
10 Licht JD,Sternberg DW.Themolecular pathology of acutemyeloid leukemia[J].Hematology Am Soc Hematol Educ Program,2005,1:137-142.
11 Shigesada K,van de Sluis B,Liu PP.Mechanism of leukemogenesis by the inv(16)chimeric gene CBFB/PEBP2BMHY11 [J]. Oncogene, 2004, 23:4297-4307.
12 Byrd JC,Mrozek K,Dodge RK,et al.Pretreatment cytogenetic abnormalities are predictive of induction success,cumulative incidence of relapse,and overall survival in adult patients with de novo acute myeloid leukemia:results from Cancer and Leukemia Group B(CALGB 8461) [J].Blood,2002,100:4325-4336.
13 Weir EG,Ali Ansari- Lari,M,Batista DA,et al.Acute bilineal leukemia:a rare disease with poor outcome [J].Leukemia,2007,21:2264-2270.
