多因子诱导的杀伤细胞联合白介素-2胸腔内注射治疗癌性胸腔积液的临床疗效观察
2011-04-24陶贞霞刘荣英曹艳丽蔡秀萍许卫星王建华吴秀然李海玲
王 娟,陶贞霞,刘荣英,曹艳丽,国 虹,蔡秀萍,许卫星,王建华,吴秀然,李海玲
原发及转移的肺部、胸膜肿瘤均可引起癌性胸腔积液。目前癌性胸腔积液多采用化疗药物胸腔内注射治疗,部分应用免疫增强剂如香菇多糖、白介素-2等胸腔内注射治疗[1-2],但采用以上方法治疗多维持时间短,且对全身肿瘤无治疗作用。我科采用多因子诱导的杀伤 (CIK)细胞培养后全身应用配合CIK细胞联合白介素-2胸腔内注射治疗癌性胸腔积液,取得了良好的治疗效果,现报道如下。
1 资料与方法
1.1 一般资料 2008年6月—2010年12月我科收治的癌性胸腔积液患者15例,其中原发肺癌4例,乳腺癌肺转移3例,弥漫性大B细胞淋巴瘤 (DLBCL)肺转移3例,肾癌肺转移3例,急性白血病2例,原发病均经手术切除后病理证实(急性白血病除外)。其中急性白血病、乳腺癌肺转移、弥漫性大B细胞淋巴瘤及3例肺癌患者均应用常规化放疗全身治疗后效果不佳,1例原发肺癌患者拒绝再次应用化疗,肾癌患者为手术后1.5~2.0年,未接受其他治疗。
1.2 细胞培养过程 应用血细胞分离机(COBE,美国)分离患者外周血单个核细胞约3×109个,在百级无菌层流病房超净工作台上经去浆、Ficoll淋巴细胞分离液 (密度1.077 g/ml购于天津灏洋生物有限公司)分离单个核细胞,并应用RPMI-1640细胞培养液 (购于美国Gibco公司)洗涤2次 (1 500 r/min离心,15 min/次)后,加入细胞培养瓶中 (购于美国 Costar公司),放入37℃、5%CO2孵育箱中 (MCO-15AC日本三洋公司),2 h后将悬浮细胞移入另外培养瓶中,调整细胞浓度为2×106/ml,加入CD3单抗 (武汉生物制品研究所),γ-干扰素2 000 U/Ml(购于上海克隆生物高技术有限公司),计为D0天,D1天加入白介素-2 1 000 U/ml(购于北京双鹭药业有限公司)诱导CIK细胞,每隔2~3 d换液1次,加入同量γ-干扰素、白介素-2,同时抽取离心后的上清液行细菌、真菌培养,放至37℃、5%CO2孵育箱中继续培养。
1.3 培养产品的回输及鉴定
1.3.1 培养产品的回输 在CIK细胞培养的 D11、D13、D15天,如细菌、霉菌培养阴性,活细胞>95%,分次给患者回输。将培养瓶内的细胞悬液分装入50 ml离心管中,1 500 r/min离心15min,去上清,加入含20 g/L人血清蛋白 (上海莱氏血液制品公司)的0.9%氯化钠溶液洗涤2次,将最后得到的细胞悬液留取(0.5~1.0) ×109联合白介素-2胸腔内注射外,将剩余细胞悬浮于250 ml含20 g/L人血清蛋白及白介素-2 2×105U的0.9%氯化钠溶液中,回输细胞数为 (1~3) ×109/次,通过输血器经静脉输注,输注前予10%葡萄糖酸钙、苯海拉明防治过敏反应,记录每次输注CIK细胞后有无寒战、发热、过敏及心肺功能变化。细胞培养过程中及细胞输注后患者应用白介素-2 200万U肌注,隔日1次,α-2b干扰素300万U肌注,隔日1次,总疗程为40 d。
1.3.2 培养产品的检定 细胞培养D0、D11、D13、D15天,经流式细胞仪 (FACS C
alibur美国BD公司)进行免疫表型测定,抽取培养物1 ml加入EDTA抗凝管,充分混匀,取50μl入流式细胞仪试管1~3,分别加入20μl鼠抗 IgG1-FITC/IgG2-PE/CD45-PerCP、CD3-FITC/-PE/CD45-PerCP、CD4-FITC/CD8-PE/CD45-PerCP(试剂购自美国BD公司),涡旋器充分混匀,避光孵育20~40 min,离心,磷酸盐缓冲液 (PBS)洗涤,过滤后,加入PBS 300μl上流式细胞仪检测。所用流式细胞仪FACSCalibur,数据获取采用Cell Quest3.2,所用蒸馏水、PBS、红细胞裂解液均经过0.2μm过滤网过滤,应用鼠抗人IgG1-FITC/IgG2-PE/CD45-PerCP为对照设置样本非特异荧光,即阴性对照,应用淋巴细胞群的anti-CD4-FITC/CD8-PE/CD45-PerCP调节各荧光的补偿值,然后进行细胞的测定及分析。
1.3.3 胸腔内注射 胸腔积液经B超定位后,尽量将胸腔积液抽净后,注入CIK细胞 (0.5~1.5) ×109加入白介素 -2 100万U,隔日1次,每疗程3次。
1.3.4 T细胞亚群检测 细胞免疫治疗前后抽取患者静脉血1 ml加入EDTA抗凝管,充分混匀,取50μl入流式细胞仪试管1~5,分别加入20μl鼠抗 IgG1-FITC/IgG2a-PE、CD3-FITC/-PE、CD3-FITC/CD4-PE、CD3-FITC/CD8-PE、CD3-FITC/CD16-PE+(试剂购自美国BD公司),涡旋器充分混匀,避光孵育20~40 min,离心,PBS洗涤,过滤后,加入PBS 300μl上流式细胞仪检测。采用T细胞亚群自动分析软件。
2 结果
2.1 不良反应 除11例患者有轻微发热(体温最高37.6℃,未用特殊处理自行降至正常)外,其他4例患者静脉输注过程顺利无反应,15例患者第1次胸腔注射后均有局部疼痛、胸腔内烧灼感,第2次注射后症状减轻,所有患者均能很好地耐受该项治疗。
2.2 CIK细胞培养过程中表型的变化经流式细胞仪分析表明,CIK细胞属于异质细胞群,随着培养时间的延长,CIK细胞中、双阳性细胞的百分含量大幅度上升 (见表1)。
2.3 患者T细胞亚群的变化 治疗后患者外周血T细胞亚群显示、、、均有升高,NK细胞 (双阳性细胞)较治疗前明显上升(见表2)。
表1 CIK细胞培养过程中表型的变化(±s,% ,n=15)Table1 The alteration of immunophenotype during the cultivation of CIK cells
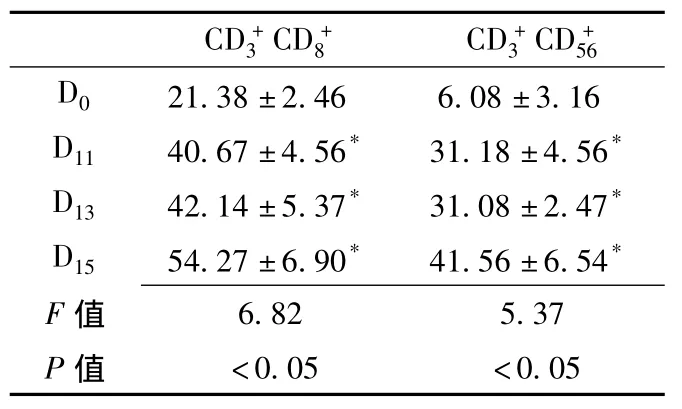
表1 CIK细胞培养过程中表型的变化(±s,% ,n=15)Table1 The alteration of immunophenotype during the cultivation of CIK cells
注:与D0比较,*P<0.01
CD+3 CD+8 CD+3 CD+56 D0 21.38±2.46 6.08±3.16 D11 40.67±4.56* 31.18±4.56*D13 42.14±5.37* 31.08±2.47*D15 54.27±6.90* 41.56±6.54*F 6.82 5.37 P值值<0.05 <0.05
2.4 疗效 15例患者共经45个疗程(每个疗程间隔2~3个月),经1个疗程治疗后憋气症状均明显减轻,疗程间隔期不需继续抽取胸腔积液,14例患者2~3个疗程后复查胸部CT,胸腔积液较前明显减少,其中1例乳腺癌肺转移患者治疗2个疗程后因加入其他药物临床协作组退出治疗,1例急性白血病患者治疗1个疗程后因原发病复发,放弃治疗自动出院,1例肺癌患者治疗2个疗程后出现肺内转移转肿瘤内科继续治疗,其余患者治疗后2个月内不再接受化疗及放疗,现已随访6~28个月,病情呈稳定状态。
3 讨论
生物治疗是目前治疗肿瘤的重要措施,其中细胞免疫治疗是研究的热点之一。细胞免疫治疗的研究始于20世纪80年代,人们陆续研究了淋巴因子激活的杀伤 (LAK)细胞、肿瘤浸润淋巴 (TIL)细胞、CD3单克隆抗体 (单抗)激活的杀伤 (CD3AK)细胞等,体外研究均具有一定的杀瘤活性,但是由于细胞的扩增倍数低,细胞毒力不强,故其临床应用受到很大的限制。1991年,Schmidt-wolf等[3]首先报道了 CIK细胞。它是将人外周血或骨髓单个核细胞在体外用多种细胞因子与CD3单抗共同培养一段时间后获得的一组异质细胞,也称自然杀伤 (NK)细胞样T淋巴细胞,CIK细胞在外周血淋巴细胞中的比例为1%~5%。其主要效应细胞表面既有T细胞表面标志 (CD3),也有NK细胞表面标志 (CD+56),因而兼有T淋巴细胞抗瘤活性和NK细胞非人类主要组织相容性复合体 (major histocompatibility complex,MHC)限制性杀瘤的特点。应用CIK细胞治疗因其可大量扩增,细胞毒活性强,可杀伤自体和异体多种肿瘤细胞,而且克服了过去过继免疫疗法的不足,如体外增殖数量少、需输注白介素-2、低效及副作用大等,现已经成为肿瘤生物治疗的一种新方法。CIK细胞具有很强的细胞毒活性,源于其较高的存活率和强大的增殖能力。CIK细胞对靶细胞的识别结合是非T细胞受体 (TCR)和非MHC限制的。目前关于CIK细胞杀伤靶细胞的原理尚未完全阐明,可能是通过黏附因子LFA/ICAM-1途径与肿瘤细胞结合后,分泌含大量BLT酯酶的颗粒,这些颗粒能穿透靶细胞膜,导致肿瘤细胞的裂解[3];而且 CIK细胞还能分泌白介素-2,白介素-6,肿瘤坏死因子-α及粒细胞-巨噬细胞集落刺激因子 (GMCSF)等一些细胞因子,增强细胞毒作用;CIK细胞同时可以上调CD2、CD18等黏附分子的表达,增加效应细胞的免疫作用。此外,CIK细胞还可通过直接靶向肿瘤细胞进行杀伤或诱导其凋亡。
表2 免疫治疗前后患者T细胞亚群的变化(±s,%,n=15)Table 2 The alteration of T cell subset in patients of pre-immunotherapy and after-immunotherapy

表2 免疫治疗前后患者T细胞亚群的变化(±s,%,n=15)Table 2 The alteration of T cell subset in patients of pre-immunotherapy and after-immunotherapy
CD+3 CD+4 CD+8 CD+19 CD+16 CD+56治疗前 55.89±6.45 21.89±2.89 30.67±4.56 8.56±2.12 16.21±4.07治疗后 73.47±2.56 39.05±6.45 33.25±6.74 45.67±3.85 39.04±7.32 t 5.65 3.98 2.79 8.96 5.47 P值值<0.05 <0.05 <0.05 <0.05 <0.05
Schmidt- Wolf[3]和黄文荣等[4]研究均发现CIK细胞不是单一种类的细胞群,而是几种细胞的混合群体。其主要细胞成分是细胞和细胞。CIK细胞来源于的T淋巴细胞在特定的细胞因子及环境下刺激形成,而不是体内原来就存在的细胞或的NK细胞。有实验进一步证明CIK细胞主要来源于T淋巴细胞。T淋巴细胞又称为细胞毒性T淋巴细胞 (CTL),主要作用是特异性直接杀伤靶细胞[5]。在本研究中,发现在细胞培养过程中,随着培养时间的延长,除双阳性细胞的百分含量大幅度上升外,双阳性细胞的百分含量亦有明显的上升。这种自身CIK细胞对自身及异基因肿瘤细胞均有杀伤作用,并且在体外大量扩增后回输体内,不需同时用白介素-2,故副作用小,因此有潜在的临床研究与应用价值[6]。在我们的前期研究中,应用血细胞分离机采集患者外周血单个核细胞,其中贴壁细胞培养树突状细胞 (DC),悬浮细胞培养CIK细胞,DC采用淋巴引流部位皮下注射,CIK细胞经静脉全身输注,该种治疗与传统的DC-CIK细胞混合培养后静脉全身应用相比,避免了不成熟DC静脉应用可能导致的免疫耐受,提高了治疗效果[7]。由于DC、CIK细胞混合应用治疗费用较高,对于经济较困难患者,我们采用单纯CIK细胞培养,并在以往恶性肿瘤类型研究的基础上,进一步扩大了恶性肿瘤的类型 (如急性白血病等)及患者的治疗例数,除将CIK细胞静脉全身应用外,我们首次采用CIK细胞联合白介素-2胸腔内注射直接到达患处杀伤肿瘤细胞,不仅患者治疗前后外周血T细胞亚群显示NK细胞双阳性细胞)较治疗前明显上升,主动抗肿瘤的免疫功能提高,患者的临床症状、影像学均提示病变较前好转,提示该种治疗方法对癌性胸腔积液是安全有效的,有良好的应用价值。
