糖尿病患者血糖波动与氧化应激状态的相关性研究
2011-04-24王艳萍孙子林
王 尧,黄 欢,王艳萍,陆 婧,孙子林
氧化应激是机体或细胞内以氧自由基为代表的氧化性物质的产生与消除平衡失调,或因外源性氧化物质的过量摄入,导致氧化性物质在细胞内蓄积而引发氧化反应的状态[1]。氧化应激可造成蛋白质损伤、脂质过氧化、DNA改变、酶的失活等,导致发生包括癌症、心血管疾病、风湿性关节炎、感染等在内的多种疾病[2]。有研究表明,氧化与抗氧化作用失衡所致氧化应激损伤是高血糖和高血脂状态下引起胰岛β细胞损伤的重要机制,糖尿病患者存在明显的氧化应激损伤[3]。另有大量研究表明,氧化应激与糖尿病肾病、糖尿病心肌纤维化、糖尿病视网膜病变的发生、发展密切相关,糖尿病慢性并发症的发生、发展不仅与整体平均高血糖水平密切相关,而且与波动性高血糖密切相关[4-5]。本研究拟通过对正常人和糖尿病患者的血糖、糖化血红蛋白 (HbA1c)及糖尿病患者血糖波动指数与氧化应激指标进行相关性分析,进一步阐明维持血糖平稳的重要意义。
1 资料与方法
1.1 一般资料 对照组:2009年6—12月在东南大学附属中大医院体检中心参加体检的人员,其中男26例,女34例,年龄33~70岁,平均 (46.2±12.7)岁,体质指数 (BMI)(24.37±4.19)kg/m2;经查空腹血糖 (FBG)正常 (按2003年WHO标准FBG<6.1 mmol/L),尿糖阴性,无糖尿病病史及家族史,肝、肾功能正常 (尿素氮、肌酐均在参考范围内)。糖尿病组:2008年7月—2010年3月在东南大学附属中大医院内分泌科住院的2型糖尿病患者92例 (诊断标准按2003年WHO制定的糖尿病诊断标准),其中男45例,女47例,年龄34~72岁,平均 (47.7±10.0)岁,BMI(25.03±5.11)kg/m2;排除肾功能不全、糖尿病肾病〔尿微量清蛋白校正值>30 mg/g和 (或)肾功能异常〕、妊娠期糖尿病、贫血、严重疾病、血肌酐>2.0 mg/dl、合并糖尿病急性并发症(如糖尿病酮症酸中毒、高渗性昏迷、低血糖昏迷)者。糖尿病组中35例患者采用动态血糖监测系统 (CGMS)监测血糖的波动指标。两组患者的年龄、性别、BMI具有均衡性。
1.2 方法
1.2.1 主要仪器 全自动生化分析仪:美国贝克曼库尔特公司LX-20全自动生化分析仪;动态血糖监测系统:美敦力(Medtronic MiniMed)公司开发、研制。
1.2.2 检测项目 静脉血糖:生化常规检测试剂盒,美国贝克曼库尔特公司,采用酶标法测定;HbA1c:采用胶乳免疫抑制凝集法;超氧化物歧化酶 (SOD)、丙二醛 (MDA):试剂盒购自南京建成生物工程研究所,采用分光光度法测定;8-异前列腺素F2α(8-iso-PGF2α):试剂盒由上海森雄科技实业有限公司提供,采用酶联免疫吸附法检测。
1.2.3 标本收集 所有研究对象禁食8 h以上,用肝素抗凝真空管从肘静脉取血2 ml,轻轻摇晃,使血液与肝素混匀以抗凝。在常温条件下以3 000 r/min离心5 min,分离血清,及时测定血糖、HbA1c,剩余血清标本保存于-80℃冰箱以测定SOD、MDA和8-iso-PGF2α。佩戴CGMS的患者进行连续7 d的动态血糖监测,并以同样的方法在第7天抽取空腹静脉血,分离血清,测定相关指标后剩余血清标本保存于-80℃冰箱以测定SOD、MDA和8-iso-PGF2α。
2 结果
2.1 两组指标检测 对照组与糖尿病组血糖、HbA1c及氧化应激指标比较,差异均有统计学意义 (P<0.05,见表1)。
2.2 血糖、HbA1c与氧化应激指标的相关性 综合对照组与糖尿病患者的血糖、HbA1c与氧化应激指标 (SOD、MDA、8-iso-PGF2α)进行Pearson相关分析,结果显示血糖、HbA1c与SOD呈负相关,与MDA和8-iso-PGF2α呈正相关 (P<0.05,见表2)。
2.3 糖尿病患者血糖波动指标与氧化应激指标的相关性 将行CGMS监测的糖尿病患者动态血糖波动的指标:平均血糖漂移幅度 (MAGE,统计CGMS受试者在7 d内漂移幅度大于1个标准差的血糖漂移,以峰值到谷值的方向计算其漂移幅度,MAGE为所有漂移幅度的平均值)、日内血糖平均绝对值(MODD,计算2个连续24 h血糖谱相匹配的血糖间的绝对差的平均值)、血糖高于180 mg/dl的曲线下面积 (AUC-180,代表患者7 d内的总体血糖波动)与氧化应激指标 (SOD、MDA和8-iso-PGF2α)进行Pearson相关分析,结果显示MAGE、MODD、AUC-180与SOD呈负相关,与 MDA、8-iso-PGF2α呈正相关 (P<0.05,见表3)。
表1 对照组与糖尿病组患者血糖、HbA1c及氧化应激指标比较(±s)Table 1 Comparison of blood glucose,HbA1c,and oxidative stress between control group and diabetic group
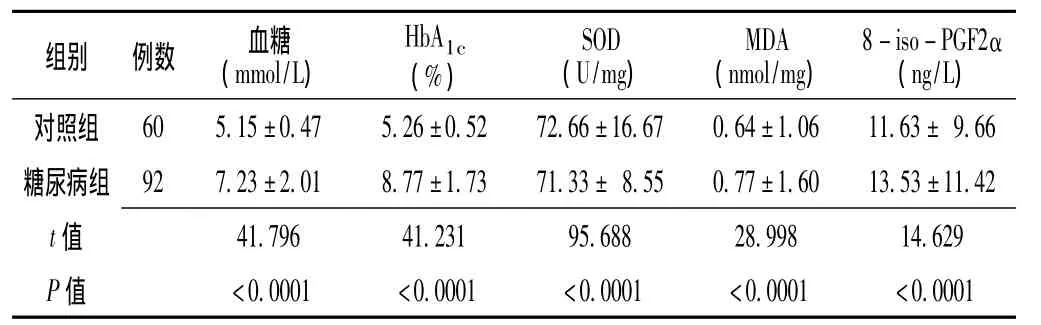
表1 对照组与糖尿病组患者血糖、HbA1c及氧化应激指标比较(±s)Table 1 Comparison of blood glucose,HbA1c,and oxidative stress between control group and diabetic group
注:HbA1c=糖化血红蛋白,SOD=超氧化物歧化酶,MDA=丙二醛,8-iso-PGF2α=8-异前列腺素F2α
组别 例数 血糖(mmol/L)HbA1c(%)SOD(U/mg)MDA(nmol/mg)8-iso-PGF2α(ng/L)6 11.63±9.66糖尿病组 92 7.23±2.01 8.77±1.73 71.33±8.55 0.77±1.60 13.53±11.42 t对照组 60 5.15±0.47 5.26±0.52 72.66±16.67 0.64±1.0值<0.0001 <0.0001 <0.0001 <0.0001 <0.0001 41.796 41.231 95.688 28.998 14.629 P值
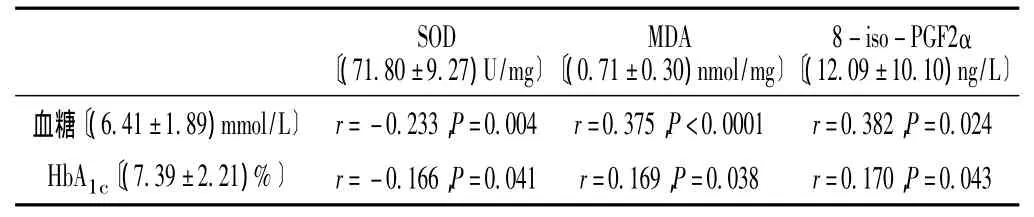
表2 血糖、HbA1c与SOD、MDA、8-iso-PGF2α的相关性Table 2 The correlation between blood glucose,HbA1c and SOD,MDA,8-iso-PGF2α
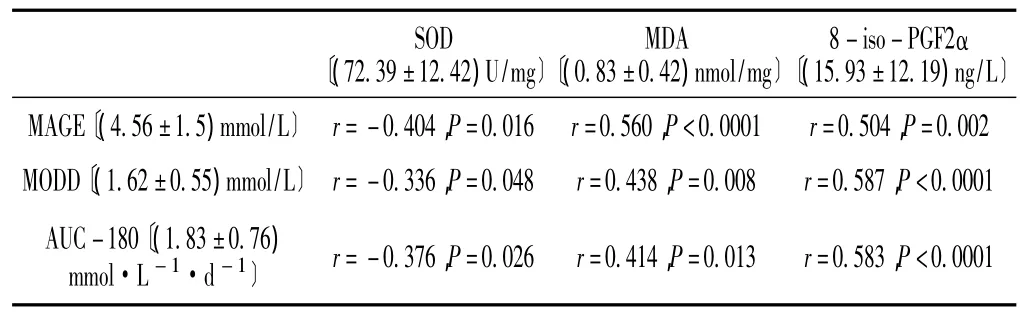
表3 糖尿病患者MAGE、MODD、AUC-180与SOD、MDA、8-iso-PGF2α的相关性Table 3 The correlation between MAGE,MODD,AUC-180 and SOD,MDA,8-iso-PGF2α about diabetic patients
3 讨论
糖尿病是因胰岛素分泌缺陷和 (或)胰岛素抵抗导致的一组以慢性高血糖为特征的代谢性疾病。高血糖和高血脂状态下诱导的氧化应激可通过损伤胰岛β细胞和降低外周组织对胰岛素的敏感性,导致糖尿病的发生及影响今后的发展。糖尿病各种慢性并发症的发病机制十分复杂,已证实氧化应激是糖尿病慢性并发症的主要发病机制之一[6-7]。
SOD能清除超氧阴离子保护细胞免受损伤,其对机体氧化与抗氧化的平衡起至关重要的作用。MDA是脂质过氧化产物,可反映体内脂质过氧化的程度。8-iso-PGF2α能增加内皮细胞通透性,使大量血浆蛋白、纤维蛋白、黏附分子漏出,漏出物刺激内皮细胞增生,同时也促进平滑肌细胞、成纤维细胞和上皮细胞增生,是糖尿病肾病早期微量蛋白尿的产生原因之一,并与其他因素一起参与肾小球硬化[8]。
有研究显示血糖水平不稳定对糖尿病慢性并发症危险性的作用可能超过血糖绝对水平的作用[9-10]。血糖波动可能通过蛋白激酶C激活、氧化应激触发、Ca2+通道激活等触发或参与内皮细胞、视网膜毛细血管周细胞、肾系膜细胞等的凋亡过程,从而导致相关糖尿病慢性并发症[11]。CGMS持续的血糖监测能够使我们获得更多的有关血糖波动的信息,有助于精确评估血糖稳定性的特征,自其问世以来已成为临床上最有效监测血糖的手段。血糖波动性常用的评估参数有平均血糖水平标准差 (SDBG)、最大血糖波动幅度 (LAGE)、MAGE、MODD、AUC-180等,它们从不同的角度反映了患者血糖的波动幅度与程度,这些参数是当前国际上普遍使用的能精确反映血糖波动的良好指标。
本研究通过正常人与糖尿病患者血糖、HbA1c、SOD、MDA、8-iso-PGF2α的对比研究,显示两组患者各指标存在明显差异,糖尿病患者较正常血糖者存在明显高血糖和高氧化应激状态;通过血糖、HbA1c分别与氧化应激指标的相关性检验,显示随着血糖、HbA1c的增高,SOD逐渐降低,MDA和8-iso-PGF2α逐渐增高;而以相关血糖波动参数与氧化应激指标的相关性分析显示血糖波动参数均与SOD呈负相关、与MDA和8-iso-PGF2α呈正相关。表明本组糖尿病人群血糖波动参与了氧化应激损伤的发生,血糖波动同样是产生氧化应激损伤的重要危险因素。
综上所述,本研究结果显示,糖尿病患者的高血糖状态与体内的氧化应激状态相关,而明显的血糖波动同样导致了氧化应激损伤的产生。因此,在对糖尿病患者的血糖管理中不仅要注重患者血糖整体水平的控制,同样要关注血糖波动对患者的影响,从而有效地减少氧化应激对患者胰岛β细胞功能的损伤,延缓糖尿病的进展,并有效防止并发症的产生和发展。
1 Papaharalambus CA,Griendling KK.Basic mechanisms of oxidative stress and reactive oxygen species in cardiovascular injury[J].Trends Cardiovasc Med,2007,17(2):48-54.
2 Wadsworth RM.Oxidative stress and the endothelium [J].Exp Physiol,2008,93(1):155 -157.
3 殷松楼,周冬梅,奚珏,等.吡格列酮对2型糖尿病患者氧化应激的影响 [J].中国全科医学,2010,13(3):888.
4 Hirsch IB.Glycemic variability:it's not just about A1canymore[J].Diabetes Technol Ther,2005,7(5):780 -783.
5 Del Prato S.Insearch of normoglycaemia in diabetes:controlling postprandial glucose [J].Int JObes RelatMetab Disord,2002,26(3):9-17.
6 Stadler K,Jenei V,Von Bolcshazy G,etal.Role of free radicals and reactive nitrogen species in the late complications of diabetesmellitus in rats[J].Orv Hetil,2004,145(21):1135 -1140.
7 林毅,罗助荣,盖晓波.普罗布考对2型糖尿病患者抗氧化和抗炎作用的初步研究 [J].中国全科医学,2008,11(9):1554.
8 Forbes M,Cooper ME,Thallas V,et al.Reduction of the accumulation of advanced glycation end products by ACE inhibition in experimental diabetic nephropathy [J].Diabetes,2002,51(11):3274.
9 Monnier L,Colette CM.Regulation of oxidative stress by glycaemic control:evidence for an independent inhibitory effect of insulin therapy[J].Diabetologia,2010,53:562 -571.
10 Fenping Zeng,Weina Lu,Chengfang Jia,et al.Relationships between glucose excursion and the activation of oxidative stress in patients with newly diagnosed type 2 diabetes or impaired glucose regulation[J].Endocrine,2010,37:201 -208.
11 Monnier L,Mas E,Ginel C,et al.Activation of oxidative stress by acute glucose fluctuations compared with sustained chronic hyperglycemia in patients with type 2 diabetes[J].JAMA,2006,295:1681-1687.
