TAC与CAF方案应用于乳腺癌新辅助化疗的疗效和安全性研究
2011-04-20赵世韬杜红阳
赵世韬,杜红阳
乳腺癌是女性常见的恶性肿瘤之一,近年来术前新辅助化疗 (neoadjuvant chemotherapy,NCT)在治疗乳腺癌中得到广泛应用,其作用也逐渐得到肯定[1],为了寻求更好的化疗方案,本研究收集2009年7月—2010年5月我院的74例乳腺癌患者,应用TAC方案和CAF方案进行NCT,探讨其临床疗效和不良反应。
1 资料与方法
1.1 一般资料 74例乳腺癌患者均为女性,年龄31~68岁,随机分为两组,每组37例。TAC组平均48.9岁,CAF组平均46.2岁。均由同一医师经粗针穿刺细胞学明确诊断,对于肿大的淋巴结通过细针穿刺活检明确是否有转移。检查血、尿常规,肝、肾功能,心电图均正常;胸片、彩超检查均未发现远处转移征象,均未进行过新辅助化疗。TAC组腋窝淋巴结阳性患者28例,肿瘤分期ⅡA期6例,ⅡB期9例,ⅢA期13例,ⅢB期9例。CAF组腋窝淋巴结阳性患者26例,肿瘤分期ⅡA期4例,ⅡB期11例,ⅢA期12例,ⅢB期10例。
1.2 治疗方法 TAC组:多西紫杉醇75 mg/m2,表柔比星70 mg/m2,环磷酰胺500 mg/m2。应用多西紫杉醇前给予口服地塞米松。CAF组:氟尿嘧啶600 mg/m2,表柔比星70 mg/m2,环磷酰胺500 mg/m2。21 d为1个周期,两组患者均化疗2个周期。两组用药前给予格雷司琼以减少胃肠道反应。每周复查血液学指标,每个化疗前复查肝肾功能和心电图。出现Ⅲ度以上白细胞减少时应用粒细胞集落刺激因子 (granulocyte colony stimulating factor,G-CSF)进行支持治疗。
1.3 疗效评价 临床疗效依据国际抗癌联合会 (International Union Against Cancer,UICC)统一标准[2],由同一医师测量原发灶最大直径,化疗前后各测一次。对临床缓解情况进行评估:完全缓解(complete remission,CR), 部 分 缓 解(partial remission,PR),病情稳定 (stable disease,SD),疾病进展 (progression of disease,PD),缓解率 (remission rate,RR)。毒副反应按照世界卫生组织(WHO)的抗癌药物毒性分度标准进行评估[3]。
1.4 统计学方法 数据分析采用SPSS 16.0统计学软件,率的比较采用χ2检验,两组疗效比较采用秩和检验,以P<0.05为差异有统计学意义。
2 结果
2.1 保乳手术率比较 NCT结束后,TAC组患者CR 4例行保乳手术,其中2例术后达到病理学完全缓解 (pathology complete remission,PCR);PR 27例中7例行保乳手术,8例因患者要求直接行改良根治术,12例因切缘阳性行改良根治术;SD 6例中3例行保乳手术,3例行改良根治术。保乳手术率达37.8%。CEF组CR 2例行保乳手术;PR 21例中4例行保乳手术,6例因患者要求直接行改良根治术,11例因切缘阳性行改良根治术;SD 14例中2例行保乳手术,12例行改良根治术。保乳手术率为21.6%。两组患者保乳手术率比较,差异无统计学意义(χ2=2.330,P >0.05)。
2.2 临床疗效比较 两组患者治疗后RR分别为83.8%和62.2%。两组患者治疗后临床疗效比较,差异有统计学意义(χ2=4.385,P <0.05,见表1)。
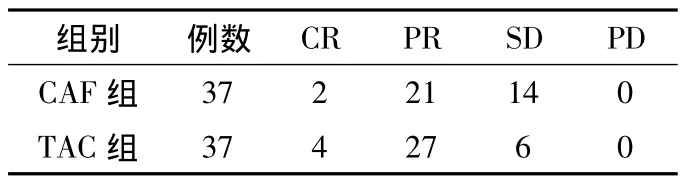
表1 两组化疗后疗效比较 (例)Table 1 The comparison of curative effect of patients in two groups after the chemotherapy
2.3 肿瘤分期的变化 根据UICC标准对NCT后的病灶进行肿瘤分期,TAC组:ⅢB期降为ⅢA期2例、降为ⅡB期2例、降为ⅡA期2例、降为0期1例,ⅢA期降为ⅡB期2例、降为ⅡA期2例、降为Ⅰ期1例、降为0期1例,ⅡB期降为ⅡA期2例、降为Ⅰ期3例、降为0期1例,ⅡA期降为Ⅰ期3例、降为0期1例。降期率为62.2%(23/37)。CAF组:ⅢB期降为ⅢA期1例、降为ⅡB期2例、降为ⅡA期1例、降为Ⅰ期1例,ⅢA期降为ⅡB期1例、降为ⅡA期1例、降为0期1例,ⅡB期降为ⅡA期1例、降为Ⅰ期1例、降为0期1例,ⅡA期降为Ⅰ期2例。降期率为35.1%(13/37)。两组患者降期率比较,差异有统计学意义(χ2=5.406,P <0.05)。
2.4 腋窝淋巴结的变化 NCT前腋窝淋巴结阳性患者TAC组28例,CAF组26例;术后病理腋窝淋巴结阳性TAC组17例,CAF组16例。转阴率分别为39.3%(11/28)和38.5%(10/26)。两组腋窝淋巴结转阴率比较,差异无统计学意义(χ2=0.004,P >0.05)。
2.5 毒副反应 白细胞减少发生率TAC组为83.8%(31/37),其中Ⅰ度8例、Ⅱ度9例、Ⅲ度8例、Ⅳ度6例,Ⅲ度以上患者应用G-CSF进行支持治疗,可继续行NCT;CAF组白细胞减少发生率为32.4%(12/37),其中Ⅰ度5例、Ⅱ度6例、Ⅲ度1例。粒细胞减少发生率分别为54.1%(20/37)和21.6%(8/37),主要是Ⅰ、Ⅱ度。血小板减少发生率分别为27.0%(10/37)和13.5%(5/37),主要是Ⅰ、Ⅱ度。恶心呕吐发生率分别为73.0%(27/37)和67.6%(25/37)。脱发发生率分别为94.6% (35/37)和54.0%(20/37)。心脏毒性发生率分别为8.1%(3/37)和10.8%(4/37),均为Ⅰ度。两组患者白细胞减少率、粒细胞减少率、脱发发生率比较,差异均有统计学意义 (χ2值分别为20.041、8.273和19.933,P<0.01)。而血小板减少率、恶心呕吐发生率、心脏毒性发生率比较,差异均无统计学意义 (χ2值分别为2.090、0.259和0.158,P>0.05)。
3 讨论
乳腺癌是一种全身疾病,常伴发临床微小转移灶,它是乳腺癌复发转移的根源[4]。NCT可观察到化疗前后肿瘤的大小、病理学及生物学指标的变化。与之相比,术后化疗因无可观察的病灶在评估疗效时多凭经验拟定化疗方案,带有一定的盲目性,难以达到理想的个体化治疗效果。综合采用多种疗法才有可能提高治愈率、减少远期转移的发生率[5]。
在乳腺癌的治疗中NCT越来越受重视,在一定程度上代表了一种趋向。研究表明,NCT不仅能很好地控制转移癌灶,并可使原发病灶明显减小,降低分期,增加保乳概率[6],但多数学者认为 NCT 4个疗程以后化疗作用减弱,术前疗程不宜太长。NCT会造成手术时机的延迟,所以应该选择适当时机实施手术,如果化疗后肿瘤逐渐缩小,则提示化疗是有效的,对化疗后肿瘤进展的患者,则应选择更有效的化疗方案或终止化疗,否则会进一步增加手术的困难。
NCT的优点之一是提供了理想的体内药敏模型,为术后化疗方案的选择提供了最为可靠的依据。如何选择合理、安全、有效的NCT方案是治疗局部晚期乳腺癌新的研究热点[7]。但目前尚无较为理想的统一方案。
紫杉类药物是目前治疗乳腺癌的重要药物,对于控制和预防肿瘤复发转移有很好的疗效[8]。部分患者对化疗敏感性高,经化疗后肿瘤完全消失,可增加手术切除的比例[9]。美国全国乳腺及肠道外科辅助治疗项目组的B-18临床试验研究的得出结论:NCT疗效PCR患者总生存率和无病生存率分别为85%和75%[10]。明显高于未达 PCR患者 (73%和58%)。故PCR是评价NCT的一个主要终点,也是预测患者预后的一项可靠指标[11]。
TAC方案被NCCN指南推荐用于乳腺癌的治疗,其疗效得到广泛的肯定[12]。鉴于晚期乳腺癌患者体质虚弱,对化疗药物的耐受性差,化疗药物选择除有效性外,毒副作用也是考虑的重要因素。本研究采用TAC和CAF方案观察其在NCT中的作用,结果显示TAC组疗效高于CAF组,骨髓抑制、恶心、呕吐可通过辅助用药缓解,但毒副作用方面如骨髓抑制率及脱发发生率CAF组则低于TAC组。对青、壮年患者及一般情况较好、病期较晚者可考虑TAC方案,而对年龄较大、一般情况较差、病期较早者可考虑采用CAF方案。
1 李洪胜,方驰华,王远东,等.CAF与CMF方案用于局部晚期乳腺癌新辅助化疗临床观察 [J].临床药物治疗杂志,2005,(2):53-55.
2 林本耀.乳腺癌[M].北京:中国医药科技出版社,2006:263-264.
3 韩少良,邵永孚.癌症化学治疗的毒副反应及处理[M].上海:复旦大学出版社,2001:116-121.
4 金永,任红军,陆佩知,等.FAC和FTC方案治疗晚期乳腺癌的临床观察[J].现代肿瘤医学,2009,17(6):1100-1101.
5 Bere sford MJ,Harris AL,Ah - See M,et al.The relationship of zhe neo - angiogenic marker,endoglin,with response to neoadjuvant chemotherapy in breast cancer[J].Br J Cancer,2006,95(12):1683 -1688.
6 Van der Hage JA,Van de Velde CJ,Julien JP,et al.Preoperative chemotherapy in primary operable breast cancer:Results from the European organization for research and treatment of cancer tris10902 [J].JClin Oncol,2001,19(22):4224-4237.
7 刘志洋,张瑾新.辅助化疗TE与CEF方案乳腺癌的临床效果比较 [J].中华乳腺病杂志,2008,2(1):18-23.
8 尹子毅,王丕琳,张铁,等.表柔比星联用紫杉醇或多西他赛在Ⅲ期乳腺癌新辅助化疗中的疗效[J].中国癌症杂志,2008,18(6):459-462.
9 罗静,李幼平,吴泰相,等.辅助化疗对可手术乳腺癌保乳手术影响的系统评价[J].中国循证医学杂志,2008,8(7):551-557.
10 Bear HD,Anderson S,Smith ER,et al.Sequenial preoperative or postoperative docetaxel added topreperative doxorubicin plus cyclophosphamide for operable breast cancer:mational surgical adjuvant breast and bowel prject protocol B - 27 [J].JClin Onocol,2006,24:2019-2027.
11 张斌.可手术乳腺癌的新辅助全身治疗[J].中华肿瘤杂志,2007,29(3):161-165.
12 朱珍,张凤春.晚期乳腺癌的化疗进展[J].现代肿瘤医学,2009,17(6):1179-1182.
