自体干细胞移植治疗糖尿病足胰岛功能变化研究
2011-04-20姚秀宇姚秀松刘艳杰
姚秀宇,姚秀松,王 巍,刘艳杰
糖尿病的发病率达10%以上,由此引发的糖尿病并发症高达30% ~40%[1],给患者及社会带来巨大的经济负担。骨髓干细胞在一定条件下可以定向分化为机体内的功能细胞,形成多种类型的组织和器官以代替损伤和坏死的组织,从而达到治疗疾病的目的[2-3]。目前骨髓间充质干细胞已在体外成功诱导分化为胰岛β细胞[4],许多学者已经找到了体内胰岛β细胞分化的相关因素[5]。本研究采用骨髓间充质干细胞治疗糖尿病足,同时发现胰岛β细胞的功能得到恢复,通过观察在不同体内环境下,骨髓间充质干细胞向胰岛β细胞转化的程度是否不同,来寻找体内促使骨髓间充质干细胞向胰岛β细胞转化的相关因素,为彻底治愈糖尿病开辟一条新的途径。
1 资料与方法
1.1 一般资料 选取2005年5月—2010年11月选择采用骨髓干细胞移植治疗的糖尿病足患者125例为研究对象,诊断均符合1999年世界卫生组织 (WHO)制定的糖尿病诊断标准。患者均有足部和 (或)下肢发凉、麻木、疼痛、间歇性跛行;Fontaine分期Ⅱ期80例、Ⅲ期32例、Ⅳ期13例。需要用止痛剂治疗13例。以神经病变为主50例,血管病变为主30例,混合型45例。心肌缺血125例均存在,血脂异常100例,脑血栓12例。彩色多普勒检查显示各段动脉不同程度的狭窄或闭塞。术前采用胰岛素控制血糖,根据血糖控制情况分为两组;1组为全天血糖完全达标 (三餐前血糖<5.6 mmol/L,餐后2 h血糖<7.8 mmol/L)63例,其中男40例,女23例;年龄50~70岁,平均年龄62岁。2组为全天血糖均高于正常(三餐前血糖<9~10 mmol/L,餐后2 h血糖<12~16 mmol/L)62例,其中男39例,女23例;年龄50~69岁,平均年龄61岁。
1.2 方法 术前3 d用重组人粒细胞集落刺激因子 (GCSF)300 U/d肌肉注射,作骨髓干细胞动员,当外周血白细胞达 (25~30) ×109/L时,采集骨髓180~200 ml。在手术室绝对无菌的条件下,采用硬膜外麻醉,麻醉生效后,取双髂后上棘后为穿刺点,常规无菌消毒,铺无菌手术孔巾,用16号骨穿针多部位抽取骨髓液200 ml。送入我科干细胞分离实验室。分离后配成一定的浓度,双下肢多点深部肌肉注射、一部分股动脉内回输。骨髓单个细胞分离方法:先将骨髓抗凝血用低温离心机,温度22℃、1 500 r/min,离心5 min,吸取少许上浮血浆,将单个核细胞层缓慢加入0.077的淋巴细胞分离液中,放入离心机中,1 200 r/min,离心20 min,取出后分为5层,吸取中间层,用0.9%氯化钠溶液洗涤2次,配成一定浓度的悬液,回输。留2 ml干细胞悬液,送学院中心实验室,用流式细胞仪检测CD34含量,以推算骨髓干细胞的数量。
1.3 评定方法 观察患肢的麻木、疼痛感、冷感、间歇性跛行是否好转,同时检测术后3 d、1周、2周、1个月、3个月的餐前及餐后2 h血糖、C-肽值,同时观察外用胰岛素用量的变化。观察有无不良反应发生。
1.4 统计学方法 采用SPSS统计软件进行数据分析,计量资料采用 (x-±s)表示,两组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 125例患者均自诉下肢麻木、疼痛感、冷感、间歇性跛行症状明显好转。
2.2 手术前后两组血糖变化比较 术前1组患者餐前和餐后2 h血糖较2组均明显降低,差异有统计学意义 (P<0.05);术后3 d、1周、2周、1个月、3个月1组与2组患者餐前及餐后2 h血糖比较,差异均无统计学意义 (P>0.05,见表1)。
2.3 手术前后两组胰岛素用量变化比较 术后3 d两组患者胰岛素用量较术前均明显降低,差异有统计学意义 (P<0.05)。术前1组患者胰岛素用量较2组无明显降低,差异无统计学意义 (P>0.05);术后3 d、1周、2周、1个月、3个月2组患者胰岛素用量较1组均明显降低,差异有统计学意义(P<0.05,见表2)。
2.4 手术前后两组血C-肽水平变化比较 两组患者术前、术后3 d、1周、2周、1个月、3个月餐前和餐后2 h血C-肽水平比较,差异均无统计学意义 (P>0.05,见表3)。2.5不良反应 两组患者均无严重不良反应发生。
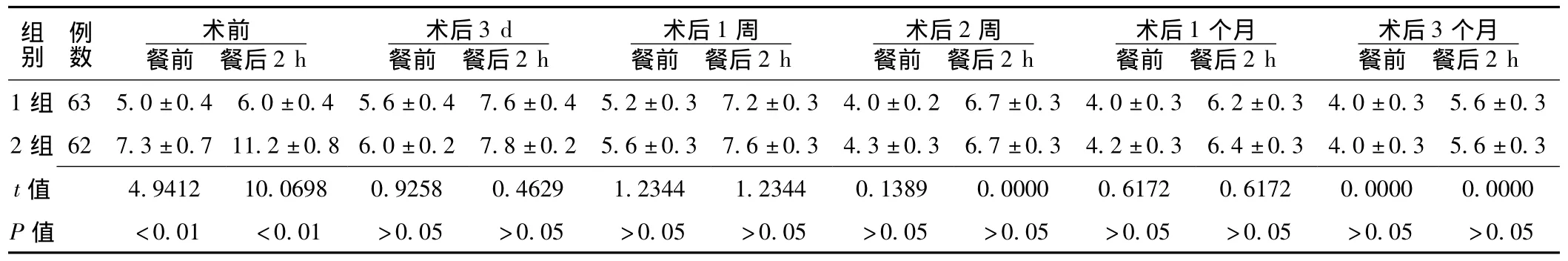
表1 手术前后两组血糖变化比较 (x-±s,mmol/L)Table1 Comparison of change contrast of blood sugar before and after operation in two groups

表3 手术前后两组血C-肽水平变化比较 (x-±s,μg/L)Table 3 Comparison of change contrast of blood C-peptide levels in two groups before and after surgery
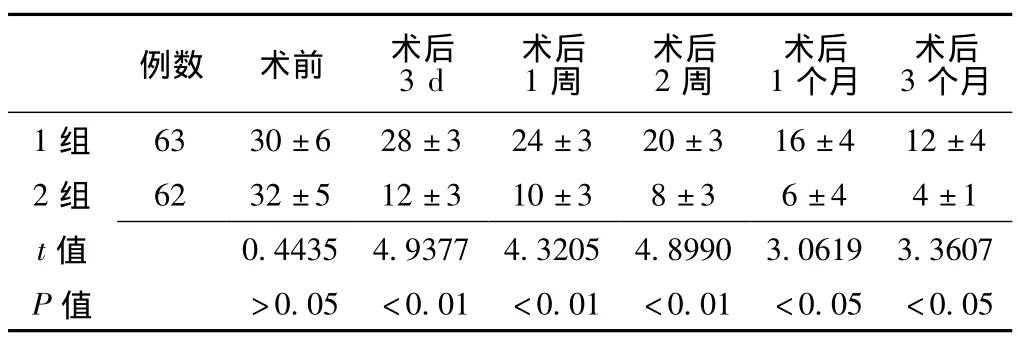
表2 手术前后两组胰岛素用量变化比较 (x-±s,U/d)Table 2 Comparison of change contrast of the insulin dose in two groups before and after surgery
3 讨论
目前在损伤的内分泌胰腺的治疗研究中,骨髓来源的干细胞、胚胎干细胞、器官来源的干细胞均有作用[6]。最重要的是如何诱导出具有完全功能的胰岛样细胞,即具有双相胰岛素释放功能,可以动态模拟生理状态下的胰岛素分泌。目前相关的研究证实,葡萄糖对胰岛β细胞的再生有双重作用[7],血糖略高于正常时可以促进干细胞分化为胰岛β细胞,血糖极高时促使胰岛本身的β细胞凋亡[8]。活化的丝-苏氨酸激酶(PBK)使葡萄糖转运子定位于β细胞表面,葡萄糖通过转运子进入细胞内,经酵解使ATP/ADP及磷酸盐浓度升高,进而ATP依赖的K通道关闭,质膜去极化,电压依赖式L型钙通道激活,胞内Ca2+浓度升高促进胰岛素分泌。但较长时间的高浓度葡萄糖,又可通过调整不同的基因程序使β细胞产生关键表型的改变而致β细胞功能缺陷、去分化及最终致β细胞死亡。对于未分化细胞,葡萄糖可充当有丝分裂剂,有实验证实,β细胞加入5%~25%葡萄糖,随浓度上升分裂增殖加快。文献分析可能由于正常的葡萄糖浓度可使葡萄糖调节基因正常化,恢复葡萄糖调节敏感性,有利于β细胞表型正常化的维持,高血糖在原始细胞阶段可诱导干细胞向胰岛β细胞分化及胰岛素分泌[9]。本研究结果显示,血糖略高于正常的患者,术后胰岛素用量明显减少,血糖完全正常组胰岛素用量减少不明显,两组有显著性差异。两组术后血糖变化不大,考虑与两组术前血糖控制差别很小有关,术后两组血糖均控制在正常范围,但胰岛素用量明显不同。高糖毒性解除后,胰岛β细胞的功能都应有所恢复,术前血糖略高组胰岛素用量明显减少,说明干细胞部分转化为胰岛β细胞。血C-肽值术后两组均有上升,但无显著性差异,可能是由于本研究选择的两组患者术前均有部份残存的胰岛β细胞。术后两组餐前、餐后血糖均在参考范围,是造成术后血C-肽没有显著性差异的主要原因。但胰岛素用量不同,说明了胰岛β细胞恢复的程度不同。高葡萄糖可以诱导干细胞定向分化为胰岛β细胞,但对自身的胰岛β细胞又有促凋亡的作用,本研究认为最好将血糖控制在略高于正常的水平,有利于干细胞的分化,同时也有利于自身胰岛β细胞的修复,对自身干细胞的作用可能是自体干细胞移植时,有部分造血干细胞及相关细胞因子对残存β细胞有修复作用。研究显示除葡萄糖外还有许多相关的因素可以促进β细胞分化,文献报道有尼可酰胺、维甲酸、丁酸盐类、shh抑制剂、活化素 (Activin)、胰高血糖素样肽 (GLP)及其类似物等,均可诱导干细胞分化为胰岛β细胞[10],这些因素是否能够成为干细胞移植后体内转化的相关因素,有待进一步研究。
综上所述,干细胞来源广泛,取材方便,在不同的理化环境下及细胞因子的诱导下具有多向分化的潜能,是组织工程、细胞移植及基因治疗领域的理想靶细胞,但体外培养再回输变数太大,如果可以找到体内诱导的方法,安全系数将明显提高。
1 Docherty K.Growth and developmentof theisletsof Langerhans:implications for the treatment of diabetesmellitus[R].Cur Opin pharmacol,2001,1(2):641-650.
2 Shapiro J,Lakey JRT,Ryan EA,et al.Islet transplantation in seven patientswith type Idiabetesmellitus using a glucocorticoid-free immunosuppressive regimen [J].N Enegl JMed,2000,343(9):230-238.
3 Soria B,Roche E,Berana G,et al.Insulin-secreting cells derived from embryonic stem cells normalize glycemia in streptozotocin-induced diabeticmice[J].Diabetes,2000,49(7):1-6.
4 Han TL,Chiou SH,Chung LK,et al.Characterization of pancreatic stem cells derived from adulthuman pancreas duts by fluore-scence activated cell sorting,world [J].J Gastroenterol,2006,28(6):4529-4535.
5 Tang DQ,Li ZC,Brant R,etal.In vivo and in vitro characterization of insulin-priducing cell obtained from murine bonemarrow [J].Diabetes,2004,53(4):1721 -1732.
6 Voltarelli JC,CouriCE,Stracieri AB,etal.Autologous nonmyeloablative hematopoietic stem cell transplantation in newly diagnosed type Idiabetesmeliitus[J].JAMA,2007,297(14):1568-1576.
7 贾延颉,钟乐,宁建辉,等.体外诱导大鼠骨髓间充质干细胞分化为胰岛素分泌细胞[J].中国当代儿科杂,2003,5(3):393-397.
8 付汉东,张爱华,鲁艳,等.自体骨髓干细胞移植治疗糖尿病足患者血管内皮生长因子的表达及意义[J].中国全科医学,2010,13(8):2554.
9 李艳华,白慈贤,谢超,等.成人骨髓间充质干细胞体外定向诱导分化为胰岛样细胞团的研究[J].自然科学进展,2003,13(6):593-597.
10 Moriscot C,Fraipont F,Richard MJ,et al.Human bonemarrow mesenchymal stem cells can express insulin and key transcription factors of the endocrine pancreas developmental pathway upon genetic and/ormicroenvironmental manipulation in vitro [J].Stem cells,2005,23(4):594-603.
