小肽转运载体2在奶牛乳腺小肽摄取中的作用研究
2011-04-17周苗苗吴跃明刘红云刘建新
周苗苗 吴跃明 刘红云 赵 珂 刘建新
(浙江大学奶业科学研究所,动物分子营养学教育部重点实验室,杭州 310029)
小肽转运载体2在奶牛乳腺小肽摄取中的作用研究
周苗苗 吴跃明*刘红云 赵 珂 刘建新*
(浙江大学奶业科学研究所,动物分子营养学教育部重点实验室,杭州 310029)
本试验旨在研究2型小肽转运载体(oligopeptide transporter 2,PepT 2)在奶牛乳腺组织吸收利用小肽合成乳蛋白过程中的作用。在体外培养的奶牛乳腺组织培养液中分别添加不同浓度的苯丙氨酸二肽(Phe-Phe)(0和11.7μg/m L)和/或焦碳酸二乙酯(DEPC)(0、0.01、0.1、0.5和1.0 mmol/L)进行培养,试验结束后收集乳腺组织和培养液分别用于基因表达和乳蛋白合成的检测。结果表明,Phe-Phe促进了PepT 2和αs1-酪蛋白基因表达及乳蛋白合成(P<0.05);随DEPC添加浓度的升高,αs1-酪蛋白基因表达(P<0.01)和乳蛋白合成(P<0.05)显著降低;0.5 mmol/L DEPC显著降低了Phe-Phe组αs1-酪蛋白的基因表达(P<0.05)和乳蛋白合成(P<0.01)以及不添加小肽组乳蛋白合成(P<0.05),但不影响不添加小肽组αs1-酪蛋白基因表达(P>0.05)。结果提示,奶牛乳腺能摄取Phe-Phe用于乳蛋白的合成,PepT 2可能在乳腺小肽摄取过程中发挥重要作用。
二肽;PepT 2;酪蛋白;DEPC;奶牛乳腺组织
随着反刍动物蛋白质和氨基酸营养研究的深入,小肽在反刍动物乳腺蛋白质合成中的作用已引起重视。有研究表明,25%以上的乳蛋白合成原料来自于过瘤胃小肽[1]。除氨基酸之外,乳腺组织很可能直接摄取和利用血液中的小肽和多肽作为合成酪蛋白等的前体物质。研究证实,给体外培养的奶牛乳腺上皮细胞培养液中添加适当浓度的蛋氨酸或赖氨酸小肽能促进酪蛋白的基因表达和乳蛋白合成[2-4]。然而,泌乳反刍动物乳腺对小肽的摄取和利用是一个较复杂的过程,其具体机制还不清楚。乳腺上皮细胞如何摄取并利用小肽方面,目前仍没有定论。有研究用反转录PCR和免疫化学的方法检测到大鼠、人和奶牛的乳腺中均有2型小肽转运载体(oligopeptide transporter 2,PepT 2)表达[5-6],这为进一步研究乳腺对小肽的摄取机制提供了基础。哺乳动物PepT 2是一种高亲和力低容量的小肽转运载体,它利用电子梯度逆浓度转运短链肽和肽结构类似物到各种细胞内,主要在肾脏上皮细胞内表达[7]。PepT 2蛋白由12个跨膜域组成,包含几个保守的组氨酸(His)残基,这些His残基与其结合转运H+/小肽相关,对维持蛋白质正常功能必不可少[8-9]。另有研究报道,His变性剂焦碳酸二乙酯(diethypyrocarbonate,DEPC)能完全阻断大鼠肾近曲小管细胞(SKPT)对二肽的吸收[10]。因此,本试验旨在通过研究小肽和DEPC对PepT 2基因表达以及乳蛋白合成的影响,试图揭示PepT 2在奶牛乳腺小肽摄取过程中的可能作用。
1 材料与方法
1.1 奶牛乳腺组织体外培养
取泌乳中期的中国荷斯坦奶牛乳腺组织,清洗并剪碎至1 mm×1 mm×1 mm大小。将组织块种植于6孔板上(Corning,USA),置于二氧化碳培养箱中(37℃,5%CO2)。待组织贴壁后每孔添加2 m L培养液。培养液成分为:基础培养液DMEM(dulbecco’s modified Eagle’s medium)-F12(Gibco,USA)添加1%谷氨酰胺、100 IU/m L青霉素、100μg/m L链霉素、5μg/m L胰岛素(Sigma,USA)、500 ng/m L 催乳素(Sigma,USA)、1μg/m L氢化可的松(Sigma,USA)以及10%的胎牛血清(FCS)(杭州四季青)。
1.2 试验设计
试验处理培养液中去除胎牛血清、补充几种必需氨基酸(表1),并按以下试验设计调整相应氨基酸和小肽的浓度。
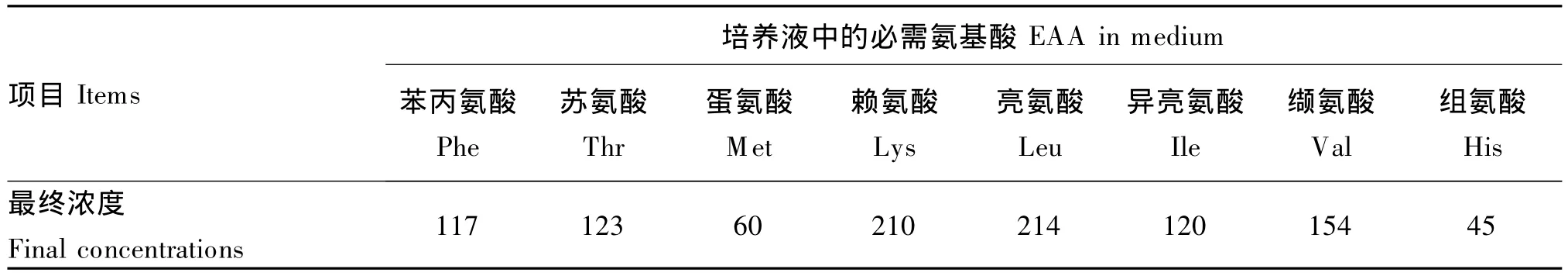
表1 培养液中几种必需氨基酸的最终浓度Table 1 Final concentrations of several essential am ino acids in medium μg/m L
1.2.1 苯丙氨酸二肽等量替代10%总游离苯丙氨酸
以培养液中Phe总量(117μg/m L)10%的二肽结合Phe(Phe-Phe,纯度>98%,杭州中肽)替代等量的Phe作为试验培养液孵育乳腺组织48 h。
1.2.2 不同浓度DEPC的添加
在含有10%Phe-Phe(11.7μg/m L)的培养液中分别添加 0、0.01、0.1、0.5 和 1.0 mmol/L 的DEPC用于奶牛乳腺组织的培养,培养时间为24 h。
在不含小肽和含10%Phe-Phe(11.7μg/m L)的培养液中分别添加0和0.5 mmol/L DEPC(由上述试验得出)用于奶牛乳腺组织的培养,培养时间为24 h。
试验结束后,收集乳腺组织和培养液分别用于总RNA的提取和总乳蛋白含量的测定。每个试验重复3次。
1.3 RNA提取和cDNA合成
用Trizol(Invitrogen,USA)提取乳腺组织中的总RNA。RNA纯度以紫外吸光法检测(OD260nm/OD280nm>1.80)。抽提的 RNA溶解后立即用于第1链cDNA的合成(PrimeScriptTM反转录试剂盒,Takara)。合成的cDNA贮存于-20℃冰箱中,备用。
1.4 实时荧光定量PCR(real-tim e PCR)
用实时荧光定量PCR的方法检测mRNA的表达。αs1-酪蛋白、PepT 2和甘油醛-3-磷酸脱氢酶(GAPDH)的实时荧光定量专用引物见表2。PCR反应在96孔板中进行,反应体系为2μL cDNA模板加18μL PCR反应液(SYBRPrem ix Ex TaqTMReal Time PCR试剂盒,Takara)。用三蒸水替代cDNA模版作为阴性对照。反应条件如下:95 ℃,10 s;95 ℃,5 s,40 个循环;60 ℃,34 s。ABI-7500实时定量序列检测软件(Applied Biosystems,USA)自动读取 CT 值。PepT 2、αs1- 酪蛋白和GAPDH的扩增效率分别为101%、100%和102%。mRNA相对变化值用公式2△△Ct进行计算。
1.5 DNA总量和培养液中总乳蛋白含量测定
用Trizol提取组织中的总DNA。紫外吸光法测定DNA的纯度(OD260nm/OD280nm>1.80)和含量。DNA量的多少作为组织/细胞数量的代表用于校正培养液中的蛋白质含量。
用冷的丙酮沉淀培养液中的蛋白质,并将蛋白质溶于含1 mmol EDTA的磷酸盐缓冲溶液(PBS)中。随后,根据 Bradford[11]的方法,用蛋白质检测试剂盒(博士德,武汉)检测培养液中总蛋白质含量,并以此代表培养液中的乳蛋白含量。
以试验组DNA校正乳蛋白含量[蛋白质含量(mg)同DNA含量(μg)的比值]同对照组 DNA校正乳蛋白含量的比值作为最终结果进行比较。
1.6 统计分析
所有数据用Excel软件进行处理,用SAS 8.0软件的 PROC-GLM 程序进行统计分析[12],P<0.05时差异显著,P<0.01时差异极显著。
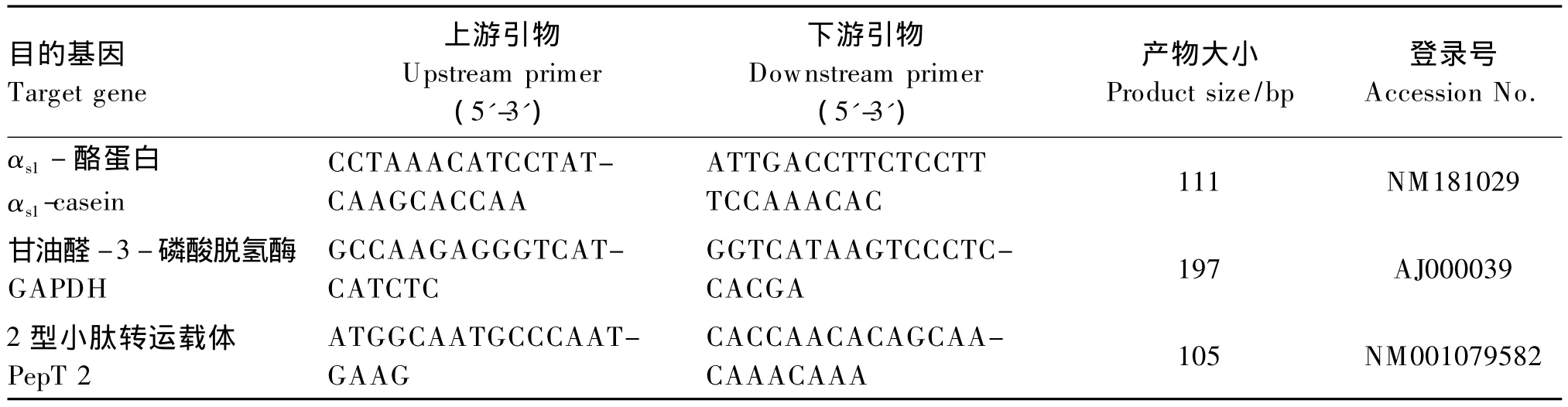
表2 实时荧光定量PCR引物Table 2 Oligonucleotide primer sets for real-time PCR
2 结果
2.1 Phe-Phe等量替代10%游离Phe对乳蛋白合成的影响
结果显示,以Phe-Phe替代培养液中10%的游离Phe(11.7μg/m L)显著提高了乳腺组织中PepT 2和αs1-酪蛋白的mRNA水平以及培养液中乳蛋白的含量(P<0.05)(图1)。
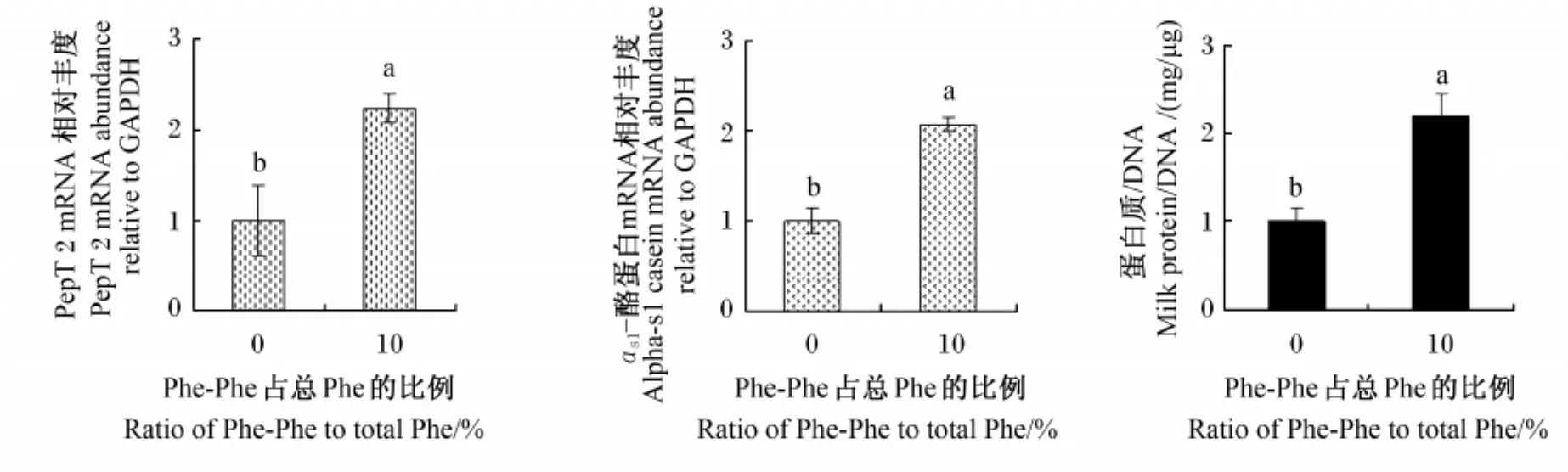
图1 Phe-Phe对PepT 2和αs1-酪蛋白基因表达及乳蛋白合成的影响Fig.1 Influence of Phe dipeptide on PepT 2 and αs1-casein gene expressions and m ilk protein synthesis
2.2 PepT 2功能抑制对乳腺小肽摄取和乳蛋白合成的影响
PepT 2功能抑制剂——DEPC的添加降低了乳腺组织中αs1-酪蛋白的mRNA丰度。其中,0.5和1.0 mmol/L DEPC 添加组 αs1- 酪蛋白的基因表达水平均显著低于对照组(P<0.05,P<0.01)(图2);随着 DEPC浓度的不断升高,乳蛋白的合成逐渐降低。同对照组相比,0.1、0.5和1.0 mmol/L DEPC添加组培养液中乳蛋白的含量均显著降低(P<0.05)(图3)。
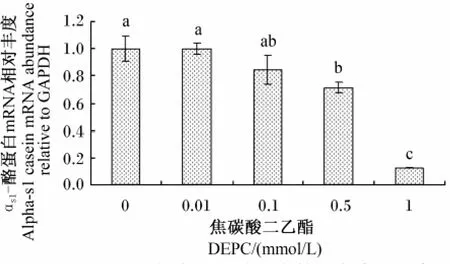
图2 DEPC浓度对αs1-酪蛋白基因表达的影响Fig.2 Influence of DEPC concentration on αs1-casein gene expression
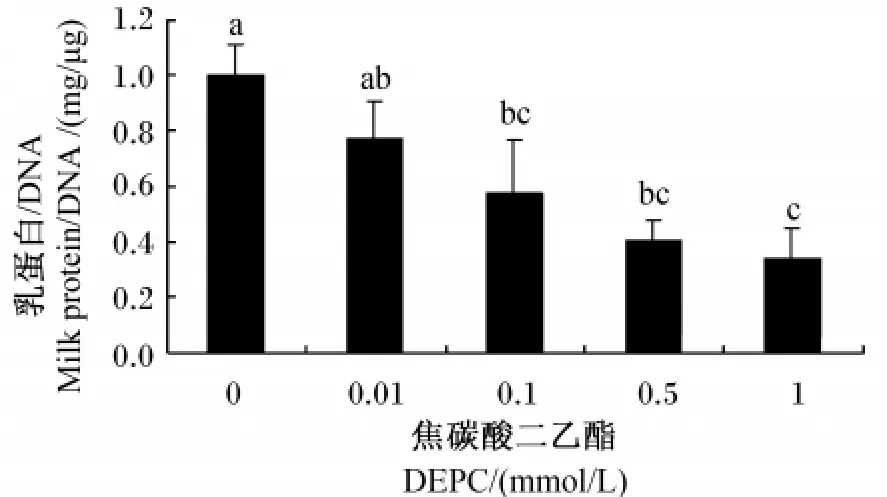
图3 DEPC浓度对乳蛋白合成的影响Fig.3 Influence of DEPC concentration on m ilk protein synthesis
不含小肽组添加0.5 mmol/L DEPC有降低乳腺组织中αs1-酪蛋白基因表达的趋势(mRNA丰度降低23%),但差异不显著(P>0.05);而10%Phe-Phe组添加0.5 mmol/L DEPC则显著降低了乳腺组织中αs1-酪蛋白的基因表达,其降低幅度为29%(P<0.05)(图4)。

图4 PepT 2功能抑制对αs1-酪蛋白基因的影响Fig.4 Influence of inhibition of PepT 2 function on αs1-casein gene expression
DEPC对乳蛋白合成的影响结果见图5。添加0.5 mmol/L DEPC显著降低了不含小肽组培养液中乳蛋白的含量(P<0.05),极显著降低了10%Phe-Phe组培养液中乳蛋白的含量(P<0.01)。其中,不含小肽组乳蛋白含量降低59%,而添加Phe-Phe组乳蛋白含量降低74%。
3 讨论
研究证实泌乳小鼠乳腺外植体可以摄取完整形式的蛋氨酸(Met)二肽用于乳蛋白的合成[13]。众多研究也表明奶牛乳腺可以摄取血液中存在的肽结合必需氨基酸作为乳蛋白合成的前体物[14-15]。Pan 等[16]比较了不同 Met二肽对奶牛乳腺上皮细胞(MAC-T)中乳蛋白合成的影响,结果发现Met-Met、Met-Val和 Leu-Met的乳蛋白合成效率高于游离的 Met。W u等[4]研究结果也表明,同游离Met和Lys相比,添加Met和 Lys二肽能促进体外培养的奶牛乳腺上皮细胞中αs1-酪蛋白的基因表达。本试验以Phe-Phe等量替代培养液中10%的游离Phe显著促进了体外培养的乳腺组织中αs1-酪蛋白基因表达和乳蛋白合成,表明乳腺组织可以利用Phe-Phe合成乳蛋白,且利用效率高于等量的游离Phe。该结果同上述用其他小肽所得结论一致。同时,Phe-Phe的添加也提高了PepT 2的mRNA表达水平,提示该小肽转运载体在乳腺小肽摄取方面可能发挥作用。
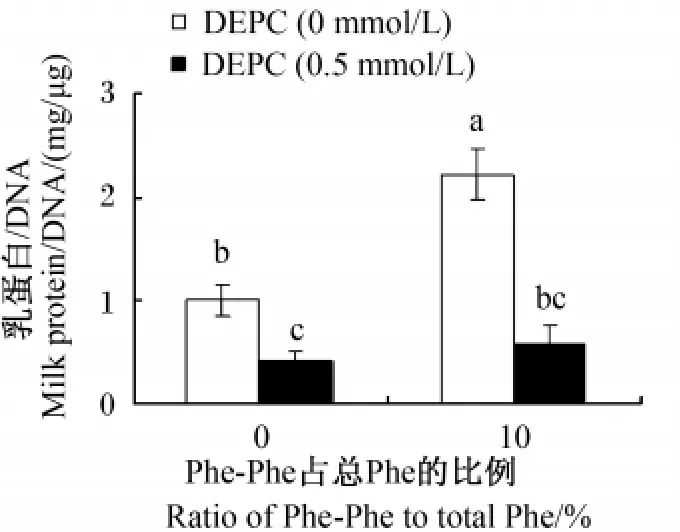
图5 PepT 2功能抑制对乳蛋白合成的影响Fig.5 Influence of inhibition of PepT 2 function on m ilk protein synthesis
Brandsch等[10]利用大鼠SKPT表达高亲和力载体PepT 2,研究了组氨酸抑制剂DEPC对PepT 2动力学参数Vmax、Km的影响。结果表明,在pH 7.5的环境下用DEPC处理后,SKPT细胞膜上的PepT 2失去结合 H+的能力,进而显著抑制了SKPT对甘氨酸 -肌氨酸(glycylsarcosine,Gly-Sar)的吸收,但并不影响PepT 2和底物结合的Km值。本试验为研究PepT 2在乳腺小肽摄取过程中的可能作用,以DEPC抑制PepT 2蛋白转运功能来检测其对αs1-酪蛋白基因表达和乳蛋白合成的影响。结果发现,0.5和1.0 mmol/L DEPC的添加显著降低了αs1-酪蛋白基因表达和乳蛋白的合成。其机制可能是:小肽转运载体蛋白的活性基团组氨酸的咪唑环结合了DEPC使其蛋白质变性,从而破坏了载体蛋白的的转运功能,最终阻断了乳腺通过小肽转运载体对小肽的摄取,抑制了小肽对乳蛋白基因转录和翻译的促进作用。另外,DEPC还可以抑制植物细胞上的非选择性阳离子通道(nonselective cation channel,NSCC),是常用的NSCC抑制剂。为避免PepT 2功能抑制剂(DEPC)通过影响乳腺组织中其他离子通道和转运载体来抑制乳蛋白合成,本试验比较了不添加和添加 Phe-Phe的情况下,以0.5 mmol/L DEPC抑制PepT 2功能对乳腺组织中乳蛋白合成的影响。结果发现,抑制PepT 2功能显著降低了添加Phe-Phe组的αs1-酪蛋白基因表达,但不影响无小肽组的αs1-酪蛋白基因表达。就乳蛋白合成而言,抑制PepT 2功能显著降低了2组的合成量。然而,添加Phe-Phe组乳蛋白合成量降低了74%,同不添加小肽组(乳蛋白降低59%)相比,添加二肽组乳蛋白合成受PepT 2功能抑制的影响更大。由此可见,无论乳腺组织中其他离子通道和转运载体是否受 DEPC的影响,DEPC都通过破坏PepT 2蛋白功能抑制了乳腺中二肽的转运,进而降低了αs1-酪蛋白基因的表达和乳蛋白的合成。因此,乳腺对小肽的摄取是通过或者至少部分通过PepT 2来实现的。
4 结论
①奶牛乳腺组织能够利用Phe-Phe合成乳蛋白,且Phe-Phe用于乳蛋白合成的效率高于等量游离Phe。
②2型小肽转运载体(PepT 2)在乳腺组织小肽摄取过程中发挥积极作用。
[1]CHEN G,SNIFFEN C J,RUSSELL JB.Concentration and estimated flow of peptides from the rumen of dairy cattle:effects of protein quantity,protein solubility,and feeding frequency[J].Journal of Dairy Science,1987,70:983.
[2]杨金勇.蛋氨酸、赖氨酸及其二肽对奶牛乳腺上皮细胞酪蛋白αs1基因表达的影响[D].硕士学位论文.杭州:浙江大学,2006.
[3]吴慧慧.必需氨基酸及蛋氨酸二肽供给模式对奶牛乳腺组织αs1酪蛋白合成的影响[D].博士学位论文.杭州:浙江大学,2007.
[4]WU H H,YANG J Y,ZHAO K,et al.Effects of methionine-containing dipeptides on caseinαs1 expression in bovinemammary epithelial cells[J].Journal of Animal Feed Science,2007,16(Suppl.2):7-12.
[5]GRONEBERG D A,DORING F,THEIS S,et al.Peptide transport in the mammary gland:expression and distribution of PEPT2 mRNA and protein[J].The American Journal of Physiology:Endocrinology and Metabolism,2002,282:E1172-E1179.
[6]ZHOU M M,WU Y M,LIU H Y,et al.Effects of tripeptides and lactogenic hormones on oligopeptide transporter 2 in bovine mammary gland[J].Journal of Animal Physiology and Animal Nutrition,doi:10.1111/j.1439 -0396.2010.01110.x
[7]周苗苗,吴跃明.小肽转运载体2及其在乳腺泌乳中的作用[J].动物营养学报,2009,21(5):603-608.
[8]KLAPPER M,DANIEL H,DORING F.Cytosolic COOH term inus of the peptide transporter PEPT2 is involved in apicalmembrane localization of the protein[J].The American Journalof Physiology:Cell Physiology,2006,290:C472-C483.
[9]FEIY J,LIUW,PRASAD PD.Identification of the histidyl residue obligatory for the catalytic activity of the human H+/peptide cotransporters PEPT1 and PEPT2[J].Biochem istry,1997,36:452 -460.
[10]BRANDSCHA M,BRANDSCHA C,GANAPATHY M E.Influence of proton and essential histidyl residues on the transport kinetics of the H+/peptide cotransport systems in intestine(PEPT1)and kidney(PEPT2)[J].Biophysica Acta,1997,1324:251 -262.
[11]BRADFORD M M.A rapid and sensitivemethod for the quantitation ofm icrogram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochem istry,1976,72:248-254.
[12]SAS Institute.SASUser’s Guide:Statistics.Version 8.01.Cary,NC.SAS Institute.Inc.,2000.
[13]WANG S,WEBB K E,AKERS M R.Peptidebound methionine can be a source of methionine for the synthesis of secreted proteins by mammary tissue explants from lactating m ice[J].Journal of Nutrition,1996,126:1662-1672.
[14]REMOND D,BERNARD L,PONCET C.Free and peptide am ino acid net flux across the rumen and the mesenteric-and portal-drained viscera of sheep[J].Journal of Animal Science,2000,78:1960-1972.
[15]TAGARI H,WEBB K,Jr,THEURER B,et al.Mammary uptake,portal-drained visceral flux,and hepatic metabolism of free and peptide-bound am ino acids in cows fed steam-flaked or dry-rolled sorghum grain diets[J].Journal of Dairy Science,2008,91:679-697.
[16]PAN Y,BENDER PK,AKERSR M,etal.Methionine-containing peptides can be used as methionine sources for protein accretion in cultured C2C12 and MAC-T cells[J].Journal of Nutrition,1996,126:232-241.
*Corresponding author,WU Yuem ing,professor,E-mail:ymwu@zju.edu.cn;LIU Jianxin,professor,E-mail:liujx@zju.edu.cn
(编辑 赵天章)
Role of O ligopeptide Transporter 2 in Bovine Mammary G land Phenylalanine Dipeptide Uptake
ZHOU Miaom iao WU Yuem ing*LIU Hongyun ZHAO Ke LIU Jianxin*
(Institute of Dairy Science,Ministry of Education Key Laboratory of Molecular Animal Nutrition,Zhejiang University,Hangzhou310029,China)
This experimentwas conducted to study the role of oligopeptide transporter 2 in small peptides uptake and m ilk protein synthesis in bovine mammary gland.Different doses of Phe dipeptide(0 and 11.7 μg/m L)and DEPC(0,0.01,0.1,0.5 and 1 mmol/L)were added to the culture medium of bovine mammary gland tissues.After incubated in the experimentalmedium,mammary tissues and medium were collected and used for gene expression and m ilk protein determ ination,respectively.The results showed that 1)Phe dipeptide increased oligopeptide transporter 2 andαs1-casein gene expression and m ilk protein quantity in themedium(P<0.05);2)with increasing of DEPC dose,αs1-casein gene mRNA level(P< 0.01)and synthesis ofmilk protein(P<0.05)were decreased;3)treatmentwith 0.5 mmol/L DEPC significantly decreased αs1-casein gene expression(P<0.05)and synthesis of m ilk protein(P<0.01)in Phe dipeptide group,and synthesis ofm ilk protein(P<0.05)in free Phe group,but had no effect on αs1-casein genemRNA level(P>0.05)in free Phe group.These results indicate that Phe dipeptide can be used for synthesis of m ilk protein by bovinemammary gland while PepT2 may play an important role in small peptides uptake by bovinemammary gland.[Chinese Journal of Animal Nutrition,2011,23(8):1303-1308]
dipeptides;PepT 2;casein;DEPC;bovinemammary gland tissues
S823
A
1006-267X(2011)08-1303-06
10.3969/j.issn.1006-267x.2011.08.008
2011-02-25
国家重点基础研究发展计划(2011CB100801);浙江省自然科学基金(Z305036)
周苗苗(1984—),女,山东聊城人,博士研究生,从事奶牛乳腺氨基酸和小肽营养研究。E-mail:zhoumm0329@163.com
*通讯作者:吴跃明,教授,博士生导师,E-mail:ymwu@zju.edu.cn;刘建新,教授,博士生导师,E-mail:liujx@zju.edu.cn
