小肾癌4D THRIVE动态增强扫描参数与肿瘤血管生成的相关性研究
2011-04-16李晓夫张铁成
李晓夫,高 颖,赵 明,张铁成,付 旷
(1.哈尔滨医科大学附属第二医院磁共振成像诊断科,黑龙江 哈尔滨 150086;2.哈尔滨工业大学放射科,黑龙江 哈尔滨 150001)
直径≤3.0cm的肾癌被定义为小肾癌(Small renal cell cacinoma,sRCC)[1],由于肿瘤较小,患者很少有明确的临床症状,了解肿瘤的生物学行为及肿瘤血管形成,对sRCC治疗方式的选择、改善预后、提高生存率均有着重要意义。非侵袭性的MRI动态增强(Dynamic contrast enhancement of MRI,DCEMRI)能反映对比剂在瘤体内的动态分布过程,提供肿瘤血管的渗透率及灌注信息[2]。本研究尝试用利用4D THRIVE动态增强序列对临床疑似sRCC患者进行检查,探讨sRCC DCE-MRI动态参数与MVD、VEGF之间的相关性,为sRCC诊断提供更加丰富的信息,并为治疗方案的合理制定提供依据。
1 资料与方法
1.1 研究对象
选取2008年5月~2010年10月在我院进行肾脏4D THRIVE DCE-MRI检查并经病理证实的小肾癌患者共30例。所有患者在检查前均被告知本项研究目的,并签署知情同意书。其中,男22例,女8例,年龄32~73岁,平均47.5岁。临床症状:血尿8例,腰痛10例,无任何症状健康体检发现者12例。手术在DCE-MRI检查后1个月内进行,病灶直径为0.8~3.0cm,平均2.4cm。
1.2 MR检查方法
使用Philips Achieva 3.0T X-series超导磁共振仪,采用6通道Sense Torso相控阵表面线圈,先行常规MRI扫描,扫描参数:T1WI-FFE,TR 250ms,TE 2.3ms,Flip 75°;T2WI-FSE,TR 1751ms,TE 80ms,FOV 24×24,NEX=2,矩阵 416×416,层厚6.5mm。平扫发现病灶后,启动4D THRIVE序列进行轴位扫描,扫描参数:FFE-T1WI,TR 4.1ms,TE 1.5ms,扫描时间20s,NEX=2,层厚1.0mm,层距0mm,一次屏气采集180层,扫描矩阵512×512,FOV 24×24,Flip 90°。经高压注射器快速团注钆喷替酸葡甲胺(Gd-DTPA),用量为0.1mmol/kg体重,流速为3.0ml/s,造影剂注射完后,以同样流速团注20ml生理盐水。
1.3 图像后处理
扫描结束后,将THRIVE增强原始数据传送至View Forum后处理工作站,使用Volume analysis高级分析软件,选取病灶实质部分、强化最明显的区域作为感兴趣区(ROI),尽量避开肉眼可辨别的血管及坏死、囊变区,ROI一般约10mm×10mm~20mm× 20mm,绘制出DCE-MRI的时间-信号强度曲线(Time signal-intensity curve,TIC),计算如下动态增强参数:①最大增强斜率 (Smax),Smax=(SIend-SIprior)/[SI0×(Tend-Tprior)]×100%,SIend代表曲线最高点的信号强度值,SIprior为曲线快速上升段起点的信号强度值,Tend、Tprior分别表示与SIend、SIprior相对应的时间点,SI0代表增强前的信号强度值。②增强峰值(PH),PH=SImax-SI0,SImax为增强后的最大信号强度值。③峰值时间(Tpeak),Tpeak为增强峰值到达的时间。
1.4 病理标本及染色
取材部位在肿瘤实质的无坏死区。尽可能与MRI强化明显处一致,选取3块,做石蜡包埋、切片、常规HE染色以及免疫组织化学染色。瘤旁正常肾组织定义为肿瘤旁1cm左右的组织[3],且在HE染色下未见癌细胞的区域。对肿瘤组织分别计算肿瘤中心及边缘区域的MVD值,MVD计数及VEGF判定均由病理科副高职称以上医师完成。
1.5 统计学分析
用Excel 2007进行数据录入和整理,统计学分析全部在统计软件包SAS 11.0系统中完成,各组间MVD、VEGF及不同组间动态增强参数两两比较采用t检验,采用Spearman等级相关分析评价sRCC动态增强参数与MVD、VEGF间的相关性,以P< 0.05为差异有统计学意义。
2 结果
2.1 4D THRIVE动态增强结果
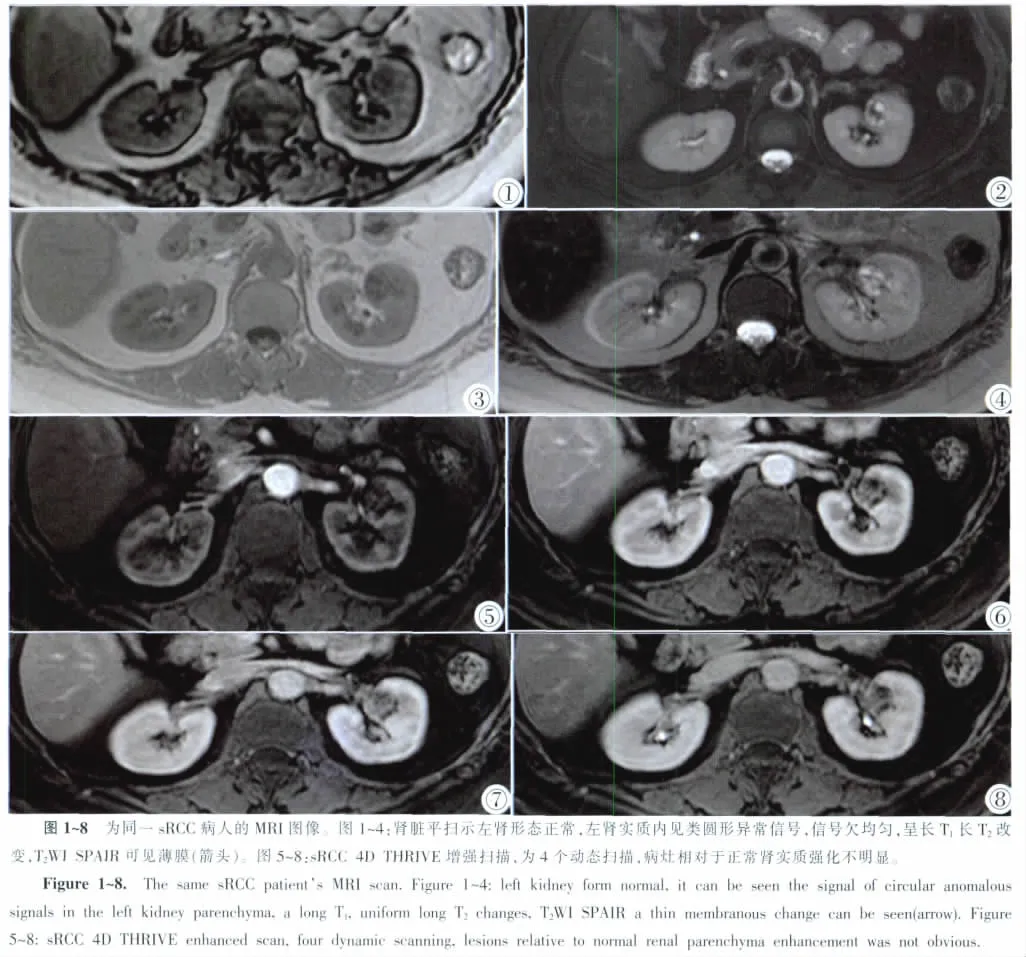
21例sRCC患者肾轮廓异常,肿块向肾外突出或推压邻近肾盂肾盏,9例肾轮廓未见明显异常(图1~4)。所有病例均有局部皮髓质界限(Cortico medullary differentiation,CMD)消失。平扫病灶信号主要表现为长T1长T2改变 (图1~4),T2WI SPAIR上常可见假包膜(图2)。所有病例均有强化,其中明显强化21例,信号高于或等于肾皮质,7例为中度强化,2例为轻度强化(图5~8)。TIC曲线表现为渐进型、平台型、廓清型。渐进型曲线(Ⅰ型):动态观察时间内,信号强度持续增加,但未出现明显峰值,中度强化组表现为此型;平台型曲线(Ⅱ型):早期时相出现信号上升,后形成中晚期平台,轻度强化组表现为此型;廓清型曲线(Ⅲ型):早期信号明显增加,达峰后信号出现明显下降,明显强化组表现为此型。本组病例TIC曲线主要表现为廓清型,即早期信号明显增加,达峰后信号出现明显下降(图9)。
2.2 sRCC MVD计数、VEGF表达情况
30例sRCC中,MVD计数范围为 32.9~119.2个,平均(65.09±15.81)个,明显高于瘤旁正常组织的(17.67±12.10)个,差异有统计学意义(t=3.790,P= 0.002)。肿瘤边缘区域的MVD值为 (60.38±24.14)个,明显高于中央区域的(37.64±16.52)个,差异有统计学意义(t=2.35,P=0.0157)。67%(20/30)的sRCC VEGF表达阳性,明显多于瘤旁正常组织(2例),差异有统计学意义(r=2.728,P=0.001)。
2.3 小肾癌4D THRIVE动态增强参数与MVD计数、VEGF表达的相关性
TIC曲线表现为廓清型曲线组MVD计数均较高,sRCC DCE-MRI各参数值与MVD行等级相关分析,结果见表1,Smax与MVD呈正相关,PH与MVD呈正相关,Tpeak与MVD呈负相关,相关性有统计学意义。
30例sRCC中,20例VEGF表达阳性,10例VEGF表达阴性,两组间MRI各动态增强参数进行比较,结果见表2,VEGF表达阳性组与阴性组的Smax差异有统计学意义(t=2.262,P=0.036),而PH(t=1.667,P=0.109)、Tpeak(t=l.894,P=0.073)两组间差异无统计学意义。
3 讨论
3.1 4D THRIVE动态增强序列的优势
对于肾脏的小病变,各种影像学检查方法都有一定的困难。静脉肾盂造影对<3cm的肾癌敏感性较低,只有67%[4],超声对<3cm肾癌的敏感性约为79%~82.5%[5]。CT检查是目前广泛使用的肾脏疾病影像学检查方法,CT平扫常容易遗漏等密度的病灶,薄层增强扫描能早期发现肾脏的较小肿块,并可以显示病灶的钙化、出血、坏死和肾门、腹腔淋巴结的增大,但是与MRI相比,CT在肿块的良恶性鉴别、显示周围组织的侵犯程度上均较MRI差[6]。MRI具有很高的软组织分辨率,在诊断sRCC方面具有不可替代的作用,是集检出病变、诊断、分期、术前评估为一体的理想的检查方法[7],此外MRI增强扫描使用钆剂(Gd-DTPA)非常安全,能够用于无法进行CT增强检查的碘过敏及肾功能障碍患者。然而,常规增强MRI存在的不足为横轴面FSPGR屏气扫描
时,常可见主动脉搏动造成的相位编码方向(前后方向)伪影;另外,有关皮质早期及皮质晚期对sRCC的价值还有待进一步的研究,少血供肾癌与肾髓质的CNR在皮质早期与皮质晚期较低,仅凭增强皮质期,肾髓质内部分少血供肾癌有漏诊可能[8]。

表2 sRCC DCE-MRI强化参数与VEGF表达的相关性

THRIVE技术是 “T1高分辨率各向同性容积激励”的简称,是一种建立在T1WI梯度回波序列上,利用Sense及Spir脂肪抑制技术、一次屏气获得多层扫描数据的一种3D扫描技术,其中4D代表第4个维(时间),标示这是一个动态扫描技术。THRIVE技术最小支持2mm3各向同性扫描,可对ROI进行无间隔轴位薄层扫描。它克服了既往2D图像采集受层数限制以及空间分辨率差的缺点,在保证高空间分辨率的同时,信噪比明显提高。连续快速容积扫描结合高压注射器的应用明显提高了病变组织的增强效果,从而清楚地显示病变的生长特征和侵犯范围。肾脏周围具有脂肪多、组织结构复杂、扫描易受呼吸运动伪影干扰的特点,通过抑脂、短时间快速无间隔扫描及动态增强,可获得高质量图像,使完成优质检查成为可能。
3.2 小肾癌的MVD、VEGF特点
肿瘤的血管生成是由多种促血管生成因子和血管生成抑制因子共同调控的结果[9],近年来的研究表明,肿瘤内MVD与其生物学行为存在着密切关系。肾癌具有大量杂乱、不均匀的新生血管,形成了不完整的、无舒缩功能的裂隙性血管网,引起微血管渗透性显著增加、组织间隙容量增加、微循环流速和流量增加等,这种肿瘤微循环在空间和时间上的不均衡性是采用动态增强影像学方法活体评价肾癌微循环的病理基础。本组研究中,30例sRCC组的MVD计数多于瘤周正常组织,肿瘤边缘区的MVD计数多于中央区,癌组织内微血管形态不规则,部分血管无明显管腔,血管的分布呈多样性,血管密集区可见于肿瘤组织的任何部位,以瘤体的周围边缘即热点区域最丰富,与Yam等[10]的研究结果一致,但不支持他们中央区坏死是肾癌环形强化病理基础的观点,因为本组30例sRCC中,病理上有3例出现中央性坏死,其中仅1例在DCE-MRI上表现为环形强化。
3.3 sRCC DCE-MRI参数与肿瘤血管生成的关系
目前,常用于评价肿瘤血管生成的DCE-MRI参数有Smax、PH、Tpeak等,它们反应的是肾脏组织注入对比剂后的强化模式,是对病灶TIC的半定量分析[11]。本研究表明,Smax、PH与sRCC组织的MVD计数呈正相关,Tpeak与MVD计数呈负相关;VEGF表达阳性组Smax高于VEGF表达阴性组,而VEGF表达阳性组PH、Tpeak与VEGF表达阴性组间差异无统计学意义。Smax代表TIC曲线上升中最为陡峭的一端增强斜率值,能反映平衡前期病灶内对比剂浓度的变化,从而反映血管的通透性及组织的血流灌注[12],TIC曲线上升越陡峭,瘤体内新生血管越丰富,并且多为不完整的裂隙性肿瘤血管。PH出现在DCE-MRI的平衡期,反映肿瘤组织内聚集对比剂的最大能力,即肿瘤中微血管内、外的组织间隙达到平衡时的共同容积总量。本研究发现,PH只能部分反映肿瘤组织的MVD计数,其相关性不如Smax,其原因主要是因为肾癌组织血管外间隙占细胞外间隙总容量的40%~70%,这与Megumi等[13]的研究一致。PH出现时间即为Tpeak,是小分子对比剂到达肿瘤微循环后,从微血管弥散至血管外间隙并达到平衡所需要的时间,PH和Tpeak除与瘤体内毛细血管、微小静脉容量有关外,还与血管外间隙容量有关。sRCC TIC曲线主要为廓清型,表明对比剂快速流入达到峰值并迅速廓清,这与肿瘤内发育不成熟、通透性高的肿瘤血管生成情况密切相关,此过程可能有VEGF参与调解。
3.4 不足之处
本研究不足之处:DCE-MRI ROI的选定与病理组织取材可能不一致,尽管对这些因素加以足够重视,但仍难免存在对应上的误差;病理免疫组化染色的质量也影响VEGF表达的测定;未按肾癌病理类型进行分组分析等。
综上所述,部分MRI动态增强参数在反映sRCC组织血液及药物动力学状态和推测微血管密度、血管通透性及对比剂渗透速度方面具有很大的潜在作用,作为一种非侵袭性检查手段,能比较客观地反映肿瘤组织血供的病理特征,从而推测血管生成状况,有助于评价sRCC的生物学行为及预后。
[1]王霄英,范诒忠,梁妍,等.小肾癌的MR表现[J].中国医学影像技术,2004,20(8):1223-1225.
[2]Yang YQ,Gu MX,Yang XQ,et al.MR imaging in the diagnosis and staging of renal cell carcinoma[J].Chin J Urol,1997,18(9): 522-523.
[3]Wei JH.Advances in the imaging of renal cell carcinoma[J].Prac J T,2000,15(1):4-6.
[4]Amendola MA,Bree RL,Pollack HM,et al.Small renal cell carcinomas:resolving a diagnostic dilemma[J].Radiology,1988,166 (3):637-641.
[5]Riccabora M,Szolar O,Preidler K,et al.Renal masses evaluation by amplitude coded colour Doppler sonography and multiphase contrast enhanced CT[J].Act a Radiol,1999,40(4):457-461.
[6]Kim JK,Kim TK,Ahn HJ,et al.Differentiation of subtypes of renal cell carcinoma on helical CT scans[J].AJR,2002,178(6): 1499-1506.
[7]Verswijvel GA,Oyen RH,Van Poppel HP,et al.Magnetic resonance imaging in the assessment of urologic disease:an all-in-one approach[J].Eur Radiol,2000,10(10):1614-1619.
[8]赵炳辉,陈祖望,周康荣,等.MRI动态增强在肾癌诊断中的价值及其检查技术探讨 [J].中国医学影像技术,2003,19(11):1544-1547.
[9]Amin MB,Amin MB,Javidan J,et al.Prognotic impact of histologic subtying of adult renal epithelial neopalsms:an experience of 405 cases[J].Am J Surg Pathol,2002,26(3):281-291.
[10]Yamashita Y,Honda S,Nishiharu T,et al.Detection of pseudocapsule of renal cell carcinoma with MR imaging and CT[J].AJR,1996,166(5):1151-1155.
[11]Li WW.Tumor angiogenesis:molecular pathology,therapeutic targeting,and imaging[J].Acad Radiol,2000,7(10):800-811.
[12]邹熠,张敏鸣,王立君,等.肺癌MRI动态增强模式与肿瘤血管生成的相关性研究[J].中华放射学杂志,2002,37(12):1150-1157.
[13]Megumi Y,Nishimura K.Chromophobe cell renal carcinoma[J]. Urol Int,1998,61(3):172-174.
