京秀葡萄四倍体诱变研究
2011-04-10张丙秀杨国慧高庆玉
张丙秀,李 璐,杨国慧,高庆玉
(东北农业大学园艺学院,哈尔滨 150030)
多倍体育种可以高效改变果树某些性状,从而达到提高产量、改良品质、增强抗逆性的目标[1-2]。自Blakeslee等用秋水仙素诱导曼陀罗四倍体成功后[3],许多科技工作者开展了果树多倍体诱导工作。早在20世纪50年代,Dermen通过诱导获得了葡萄四倍体或嵌合体[4]。日本在葡萄多倍体诱导研究方面成效最为显著[5]。四倍体葡萄因早熟、大粒、品质好等优点深受市场的欢迎,但目前我国四倍体品种数量较少,遗传背景狭窄[6],因此,葡萄四倍体诱导研究对葡萄育种和生产都具有重要意义。
过去普遍采用浸种和滴涂生长点的方法诱导果树多倍体,但这种在整体水平上诱导染色体加倍的方法受环境干扰大,嵌合体多,组培技术使诱导单个细胞内染色体加倍成为可能[7-8]。而且,秋水仙素处理组培苗可以使获得的诱变嵌合体在短时间内快速大量继代和分离[9]。因此,组培技术诱导多倍体的方法日益受到关注。在多倍体鉴定上,过去多通过形态和器官组织进行间接鉴定或体细胞染色体计数法在显微镜下观察鉴定[10],前者简便,但可靠性低[11],后者可靠性高,但操作复杂,难度较大[12]。利用流式细胞术进行多倍体检测,省时且操作简单,准确度和灵敏度极高[13-14]。京秀葡萄是加工鲜食兼用的优良品种,关于京秀多倍体组织培养诱变方法的研究,也有相关报道[6,15],但诱变率不够理想。
本试验以秋水仙素为诱变剂,对京秀葡萄进行组培诱导,探索秋水仙素不同浓度以及不同处理方法对诱变染色体变异的影响,利用流式细胞倍性分析仪对诱变多倍体整株进行分析鉴定。以期获得京秀四倍体植株,为葡萄多倍体育种提供种质资源,并为四倍体的诱变寻找简单有效的途径。
1 材料与方法
1.1 材料
1.1.1 植物材料
葡萄品种京秀,由东北农业大学果树教研室高庆玉教授提供。
1.1.2 培养基和培养条件
采用MS培养基,添加0.6%的琼脂粉、2.5%的蔗糖。pH调至5.5,121℃高压灭菌15 min。激素和秋水仙素在灭菌前加入。在温度为(25±2)℃、光照强度为2 000 lx、日照时间12 h的培养室中进行培养。
1.2 方法
1.2.1 浸泡单芽茎段法诱导四倍体
将无菌组培苗的带单芽茎段浸泡在各浓度(0.05%,0.1%,0.2%,0.3%,0.4%)的秋水仙素中,包好瓶口,避免强烈光照,分别处理6、12、24、48和72 h。处理过程中轻轻摇动以使诱导材料与药液充分接触,以无菌水为对照,处理后接种到培养基(MS+2.5 mg·L-16-BA+0.1 mg·L-1IBA)上培养。待腋芽萌发后取部分芽尖进行倍性鉴定,生根诱导(1/2MS+0.5 mg·L-1IBA)20 d 后取根尖进行倍性鉴定,研究植株倍性变化。培养30 d后对组培苗的生长量进行测定。
1.2.2 混培法诱导四倍体
将一定量秋水仙素水溶液加入MS培养基中,配成 50、100、500、1 000、2 000 mg·L-1的秋水仙素培养基,高压灭菌。选取苗龄12~15 d左右,根系长为1.5 cm的健壮组培苗,留顶端部分,带根转入尚未完全凝固的秋水仙素培养基中,每个处理10株,重复3次,分别处理15、30、40 d后,剪取芽尖进行倍性检测,并继代培养进行倍性鉴定。
1.2.3 倍性检测
使用美国BD公司生产的FACSAria型流式细胞分析系统测定单个细胞核的DNA含量,通过倍性分析仪对植株进行倍性检测。对诱导后的植株进行倍性分析,以未经处理的京秀二倍体为对照。具体方法如下:取生长良好的组培苗的根尖50 mg或茎尖30 mg,在滴有1 mL提取缓冲液(含有15 mmol·L-1Tris-HCl(pH 7.5),80 mmol·L-1KCl,20 mmol·L-1NaCl,20 mmol·L-1EDTA-Na2,15 mmol·L-1巯基乙醇,0.05%(V/V)Triton X-100)的培养皿中用锋利刀片迅速切碎,260目尼龙网包住移液枪头过滤吸取,再通过400目细胞筛过滤,滤液用标准试管收集,暗处放置3 h,加入0.5 mL Rnase A溶液(100 mg Rnase A 溶于 10 mL 的 10 mmol·L-1Tris-HCl(pH 7.5)、15 mmol·L-1NaCl中,100 ℃煮沸15 min,冰浴冷却,-20℃保存),置暗处,37℃培养30 min,冰浴冷却再加入 10 μg·mL-1碘化丙锭0.6 mL,随即上机测定。
2 结果与分析
2.1 诱导前京秀的葡萄倍性检测
取生长良好的京秀组培苗,取其根尖50 mg及茎尖30 mg,分别提取并过滤,按1.2.3的方法进行测定,测定的结果为二倍体,如图1所示。
2.2 浸泡单芽茎段法对植株生长情况及四倍体诱变效果的影响
在生长过程中,京秀组培苗茎段生长分化受到抑制,对组培苗生长30 d后的生长量进行测定,如图2所示,秋水仙素对生长的抑制作用随浓度增加和处理时间的延长而加重。秋水仙素浓度为0.05%时,不同时间处理间植株生长量差异不显著。0.2%和0.3%浓度下,浸泡12和24 h处理的试管苗株高显著低于浸泡6 h处理的株高。而在对茎段浸泡时间相同条件下,0.1%和0.2%浓度处理间的植株生长量不存在显著差异。0.4%浓度处理,在24~72 h间植株生长都受到严重的抑制,根系变短变粗,且根系的分支数量变多,几乎不生长。
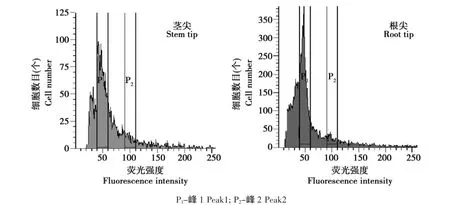
图1 京秀茎尖及根尖DNA含量分布Fig.1 Distribution of DNA content in stem tip and root tip of Jingxiu
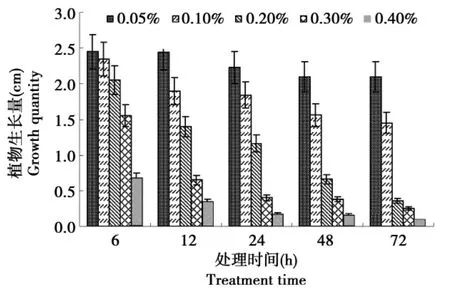
图2 秋水仙素浸泡单芽茎段法的植株生长Fig.2 Plant growth of shoot segments pretreated by colchicines soaking
从表1中可以看出,0.05%浓度下处理6 h成苗率最高,随着秋水仙素浓度及处理时间的增长,成苗率在总体上呈下降趋势。同一时间处理下,褐化率随着秋水仙素浓度的增大变化最慢的是6 h处理,最快的是72h处理,成苗率下降最慢的也是6h处理,但最快的却是48 h处理。同一浓度处理下,随着处理时间增长,低浓度处理的成苗率的下降速度及褐化率的升高速度要都低于高浓度处理。而且,0.4%浓度与其他处理浓度相比,在所有时间处理下,其成苗率始终最低,褐化率也始终最高。可见高浓度的秋水仙素毒害作用重于长时间的浸泡处理。
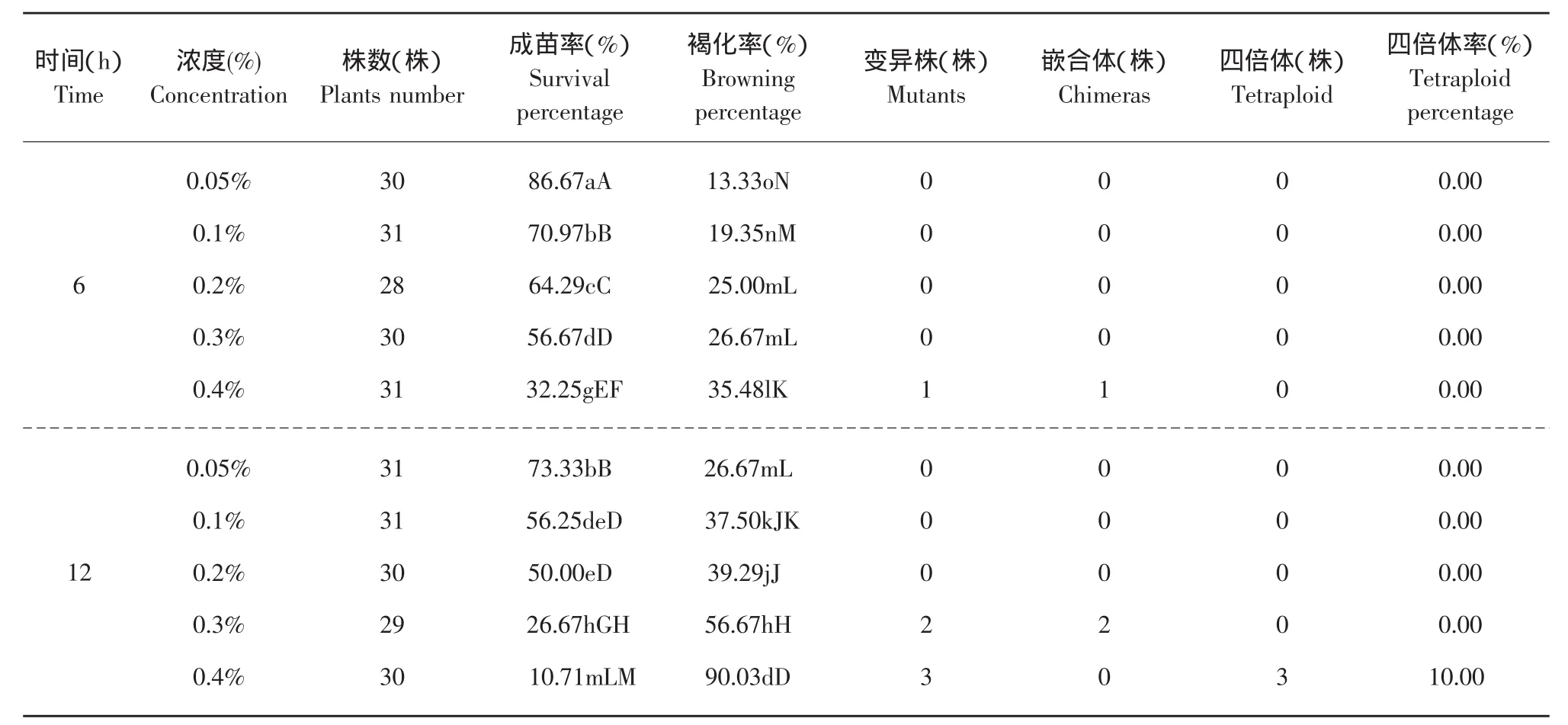
表1 秋水仙素浓度和处理时间对京秀诱变效果及生长的影响Table 1 Effect of pretreatments with colchicines on induction and growth of Jingxiu
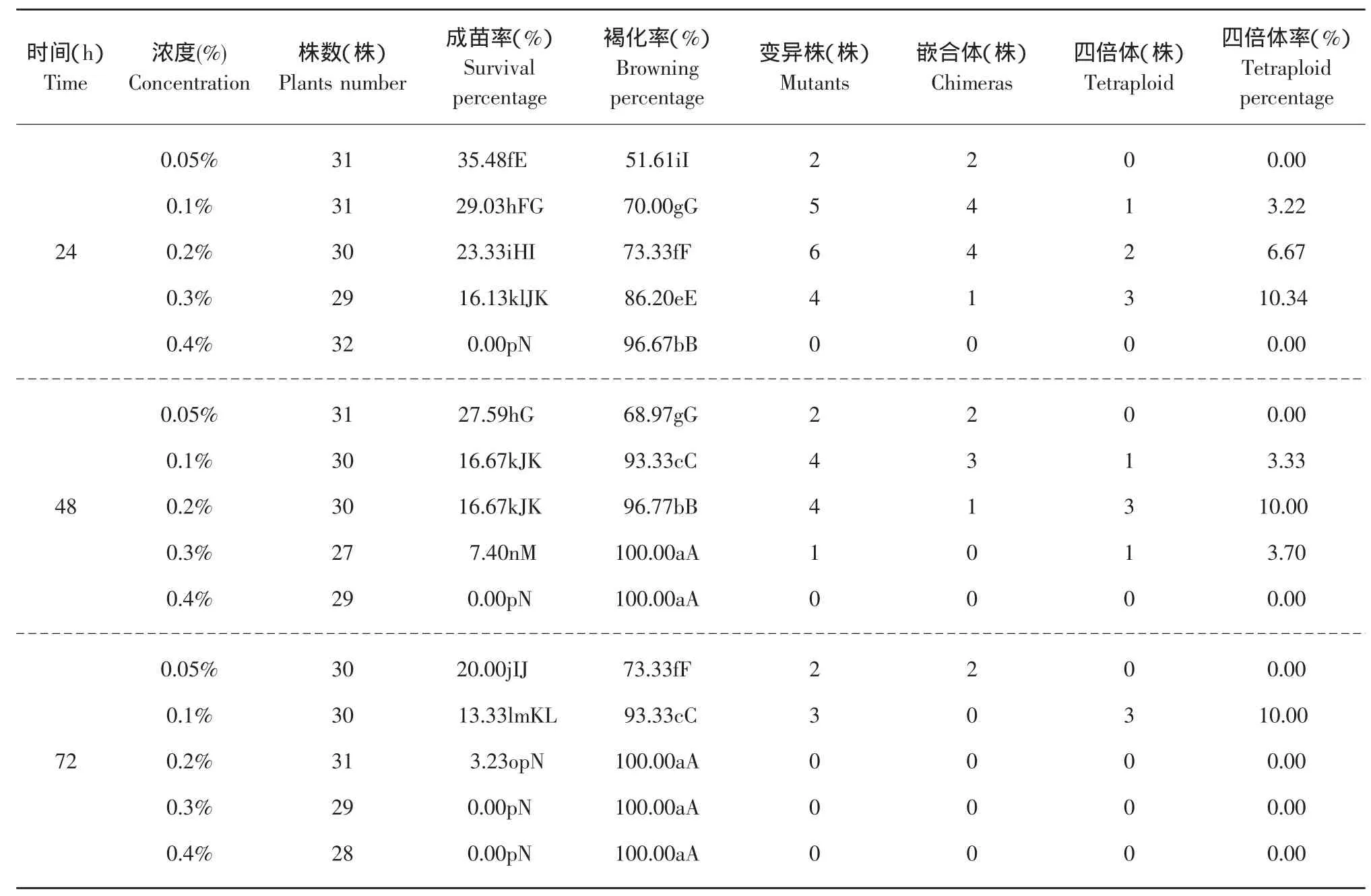
续表
浸泡茎段诱导京秀葡萄共出现39株变异植株,有17株为四倍体。由表1可知,6 h处理和0.05%的低浓度处理均没有出现变异植株。当处理时间在6 h以上时,诱变率随着浓度的增加先升高后下降,处理时间越长,最佳处理浓度越低,当高于此浓度时,诱变率开始下降;处理浓度高于0.05%时,诱变率随着处理时间的增加先升高后下降,处理浓度越高,最佳处理时间越短,当超过此时间时,诱变率开始下降。在本试验中,最佳浓度及时间组合为0.3%浓度处理24 h,四倍体的变异率为10.34%。
2.3 混培法对植株生长情况及诱导效果的影响
在含秋水仙素的培养基未完全凝固时,将根系生长良好的组培幼苗接入。
培养15、30、45 d后观察发现:组培苗根的生长普遍受到抑制,植株生长变慢,叶片变深绿,腋芽很难萌发,浓度越高,抑制作用越强;尤其是苗龄较小的植株,不仅嫩芽停止生长,而且整个植株都逐渐枯死;有些成活的植株除了生长缓慢外,新发叶片变皱,叶缘下卷,继代后变大变厚,颜色为深绿色,茎和根略粗。结果见图3。

图3 秋水仙素混培法植株生长情况Fig.3 Plant growth state of plant on mixed culture with colchicines
从表2可以看出,500 mg·L-1浓度下15 d处理的成苗率最高。本混培处理试验发现,处理时间对组培苗生长的作用强于处理浓度,这体现在以下两个方面:其一,同浓度下,随着培养时间的增加,死亡率、褐化率升高明显,萌芽率下降也显著,而同时间处理下,随着秋水仙素浓度的增加,萌芽率、褐化及死亡率的变化规律虽同前者,但变化速度缓慢,而且15 d处理萌芽率还出现了先升再降的趋势。其二,长时间(30和40 d)处理即使在低浓度(50 mg·L-1)下,其萌芽率还是显著低于短时间(15 d)中浓度(100~1 000 mg·L-1)处理的萌芽率。
混培法诱导京秀葡萄共出现9株变异植株,有5株为四倍体。从表2中可以得出,短时间处理时各浓度均不能诱导变异,而长时间高浓度处理会使苗成活率受到很大影响。组培苗在培养15 d时,各浓度均未出现变异植株;培养30 d时,除浓度50 mg·L-1外,各个浓度都测得变异植株,1 000 mg·L-1出现 1株四倍体,2 000 mg·L-1出现 2株四倍体;培养45 d时,由于长时间秋水仙素培养对植株根系抑制作用的增强,变异植株只在100mg·L-1出现1株、500 mg·L-1出现1株,但都为四倍体,且生长正常。在本试验中,30 d、2 000 mg·L-1的处理效果最好,该处理诱导出变异植株的嵌合体率为0,四倍体出现率为20.00%,占总四倍体植株数的40%。
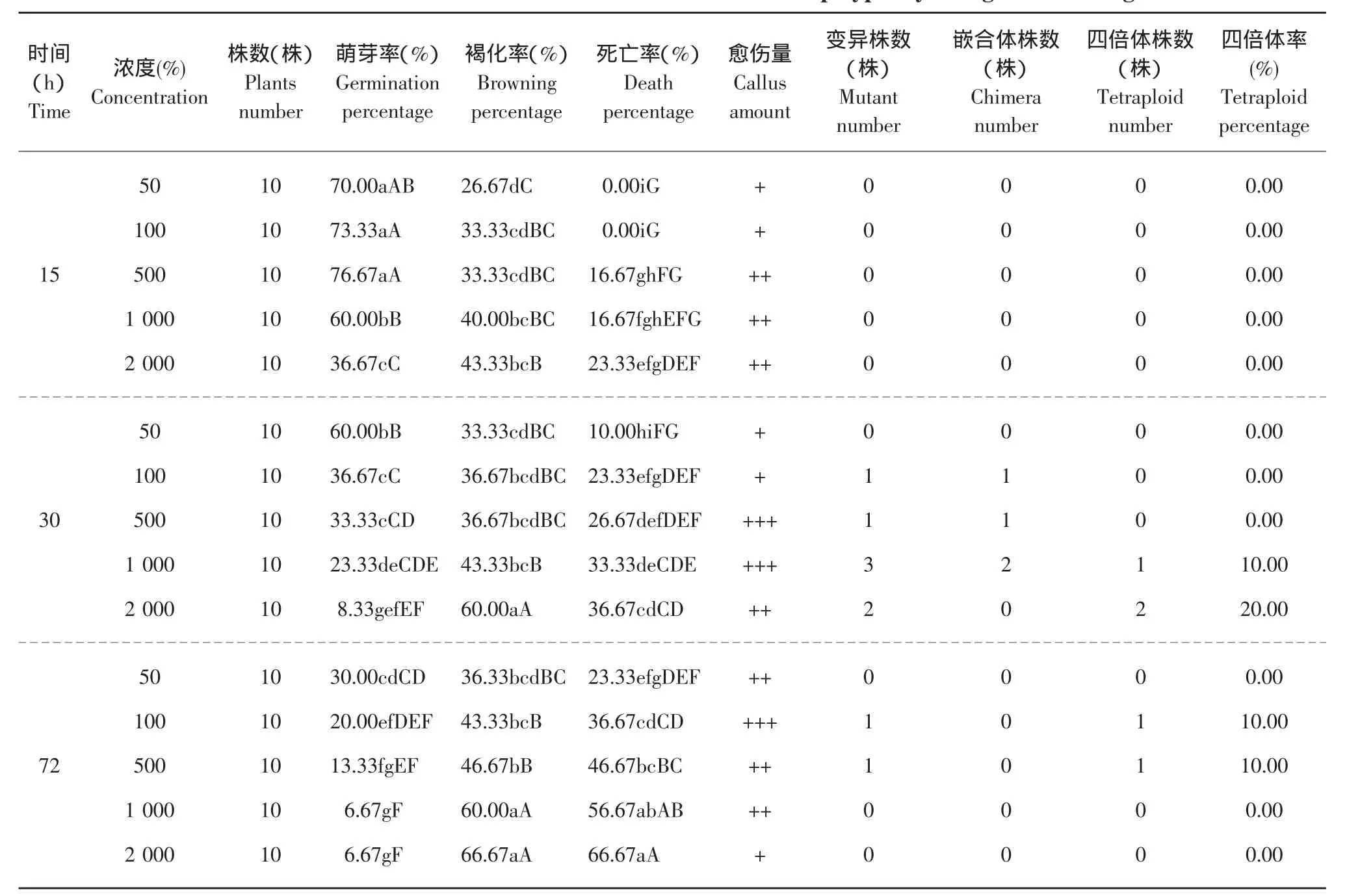
表2 秋水仙素混培法对京秀诱变效果及生长的影响Table 2 Effect of mixed culture with colchicines on induced polyploidy and growth of Jingxiu
2.4 诱变植株的倍性鉴定
图4为京秀的四倍体、二、四倍嵌合体和二倍体的DNA含量分布图。
四倍体植株在接近100的位置上出现一个单峰;二、四倍嵌合体具有2个峰:除50附近的位置有1个峰外,在位于其DNA含量一倍的地方还有一个峰;二倍体对照植株仅在荧光强度值为50的位置上出现一个单峰。经FACSAria型流式细胞仪中软件分析,得到嵌合体中不同倍性细胞的相对比例。
如图5京秀嵌合体图谱所示,二倍体细胞所占比例为47.13%,四倍体细胞所占比例为52.87%,该结果也以峰面积形式体现出来,以此结果可以了解诱变株中不同细胞的情况。
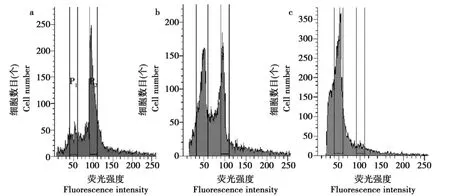
图4 京秀DNA含量分布Fig.4 Distribution of Jingxiu DNA content
3 讨论
马爱红等采用500、1 000、2 000 mg·L-1秋水仙素混合培养组培苗至30 d,未发现加倍植株,也没有测得嵌合体植株,培养40 d时,仅有4株植株的茎尖嫩叶有加倍现象[6]。但在本研究中,混培法的最佳诱导条件为2 000 mg·L-1培养30 d,四倍体诱导率为20%,与马爱红等研究的结果有差异,这可能是由于芽的状况或处理时的环境差异造成的。徐德平等研究认为,秋水仙素溶液浸泡茎段比秋水仙素混合培养基法诱导葡萄多倍体效果更好[16],本研究认为浸泡茎段法的四倍体诱导率并不明显高于混合培养基法。但从试验操作和后期生长等情况看,直接浸泡单芽茎段法简单且用药量少,药液更易渗入植物组织,倍性特征在短期内就能显现,有利于早期检测及培养四倍体植株。另外,秋水仙素混入培养基诱导四倍体时,如果选用的组培苗苗龄较大则不易诱变,而如果较小,根比较幼嫩,很容易变黑死亡,从而导致整株植株停止生长甚至死亡。
4 结论
用秋水仙素对二倍体葡萄京秀进行组培诱导多倍体,并采用流式分析仪对诱变植株的细胞DNA含量进行鉴定。结果表明,不同的诱变方法对于处理时间和处理浓度的反应不同,对于浸泡单芽茎段法,处理浓度的影响强于处理时间,而对于混培法,处理时间的影响强于处理浓度;浸泡单芽茎段法最佳诱导条件为0.3%处理24 d;混培法的最佳诱导条件为2 000 mg L-1处理30 d;在本研究中,茎段浸泡秋水仙素法诱导葡萄四倍体的效果并不明显优于混培法。
[1] 石荫坪,王强生.果树的多倍体[J].园艺,1983(2):6-12.
[2] 赵彦华,吴国良,药文生.果树多倍体育种研究进展 [J].山西果树,2004(4):35-36.
[3] Blakeslee F A,Avery A G.Methods of inducing doubling of chromosome in plants[J].J Hered,1937,25:80-108.
[4] Derman H.Colchiploidy in grapes[J].J Hered,1954,45:159-172.[5] Notsuka K,Tsuru T.Induced polyploid grapevines via in vitro chromosome doubling[J].Journal of the Japanese Society for Horticultural Science,2000,69(5):543-551.
[6] 马爱红,范培格,孙建设,等.四倍体葡萄诱导技术的研究[J].中国农业科学,2005,38(8):1645-1651.
[7] 郭启高,宋明,梁国鲁.植物多倍体诱导育种研究进展[J].生物学通报,2000,35(2):8-10.
[8] 陶颖.秋水仙素诱导葡萄多倍体的研究[D].呼和浩特:内蒙古农业大学,2007:1.
[9] 李晓艳,张志东,李亚东,等.秋水仙素诱导离体培养越橘多倍体研究[J].东北农业大学学报,2010,41(1):38-42.
[10] 赵彦华,吴国良,药文生.果树多倍体育种研究进展[J].山西果树,2004(4):35-36.
[11] 邓喜林,林跃智,李蕊,等.流式细胞术在免疫学上的应用及其发展前景[J].东北农业大学学报,2009,40(6):137-140.
[12] 李誉,石荫坪,束怀瑞,等.利用流式细胞光度术鉴定苹果倍性的研究[J].西北植物学报,1998,18(4):499-504.
[13] 刘继红,曾少华,徐春永,等.澳洲指橘与粗柠檬体细胞杂种倍性分析及其花粉活力检测[J].果树学报,2003,20(4):251-255.
[14] Arumuganathan K,Earle E D.Estimation of nuclear DNA content of plants by flowcytometry[J].Plant Mol Biol Report,1991(9):229-233.
[15] 杨晓明,王翠玲.葡萄多倍体诱导及其特征特性研究[J].甘肃农业大学学报,2005,40(6):741-744.
[16] 徐德平,徐喜楼,徐惠瑛.葡萄试管苗化学诱变的研究[J].长江果树,2003(1):9-11.
