环境因子对苋菜试管苗色素累积的影响
2011-04-10刘生财杨文文赖钟雄
刘生财,杨文文,赖钟雄
(福建农林大学园艺植物生物工程研究所,福州 350002)
苋菜是苋科苋属,一年生草本植物,在我国具有悠久的栽培历史。近年来随着天然色素研究的加深,苋菜以其较好的营养价值和药用价值已经得到广泛的开发利用,在生产上得到切实的发展[1]。早在1989年就证实天然苋菜红色素是一种符合要求的食品添加剂[2],不仅可用于给食品和饮料着色[3],而且着色效果好;同时它还是一种无毒无害的天然保健品,一种良好的自由基清除剂,对羟基自由基和超氧阴离子均有清除作用[4]。因此,天然苋菜色素拥有良好的市场开发前景。
植物体内不同色素的累积含量比例决定植物的颜色,叶片各种色素的相对含量是导致叶色不同的主要原因[5],基本上植物的叶片颜色由其基因型决定,但同时受到光照、温度等外界环境因子的调控。本试验即是研究了环境因子对苋菜试管苗色素累积的影响,又探索了苋菜色素累积的规律性,为将来更加深入地研究苋菜色素的利用价值奠定基础。
1 材料与方法
1.1 材料
本试验选用福州产特选红圆叶苋菜无菌苗为试验材料,由福建农林大学园艺植物生物工程研究所提供。
1.2 方法
从长势大小一致的实生苗中切取子叶下胚轴分为四组,接种于培养基 MS+6-BA 3.0 mg·L-1+NAA 0.2 mg·L-1中。第一组进行不同单色光处理;第二组进行不同光周期处理;第三组进行不同温度处理;第四组进行不同pH处理,每5 d观察1次,记录其生长情况。初代培养3周后,转接入增殖培养基 MS+6-BA 3.0 mg·L-1+IAA 1.0 mg·L-1中,继续放置于原单色光、原光周期、原温度和原pH条件下培养,10 d后观察记录各处理生长情况,并测定其光合色素、苋菜红色素、花色素苷的含量。
1.2.1 单色光处理
第一组分别在红光(R)、蓝光(B)、绿光(G)条件下培养试管苗,以白炽灯光照射为对照(CK)。
1.2.2 光周期处理
第二组分别控制其光照时数每天为0、6、12、18和 24 h。
1.2.3 温度处理
第三组分别于(20±1)、(24±1)、(28±1)、(32±1)℃温度条件下培养试管苗。
1.2.4 pH处理
第四组分别置于pH为5.4、5.8、6.2、6.4、6.7的培养基上培养试管苗。
1.2.5 色素含量测定
叶绿素含量的测定方法参照刘生财[6];花色素苷的测定方法参照宋长铣[7];苋菜红色素含量的测定方法参照王怀宗等[8]。
所有测定均3次重复。
1.3 培养条件
培养基中,糖含量为3%,琼脂含量为0.7%,pH除试验特别设计外均为5.8,光照强度1 500 lx,光照时间除试验特别设计外均为12 h·d-1,培养温度除试验设计要求外均为(25±1)℃。
1.4 数据处理与分析
试验数据采用Excel和DPS等软件进行处理与分析。
2 结果与分析
2.1 环境因子对苋菜试管苗光合色素含量的影响
2.1.1 不同单色光处理对苋菜光合色素含量的影响
光质是影响植物色素累积的关键因素之一,不同植物对不同颜色光谱的吸收不同。
由表1可知,白炽灯光照射时叶绿素含量较高,绿光处理叶绿素含量最低;白炽灯光与红光、蓝光处理之间差异不显著,但与绿光处理之间差异显著。Chla/Chlb在对照处理与蓝光处理之间差异不显著,而与红光、绿光处理之间差异显著;但蓝光与绿光、红光差异不显著。Car/Chl在绿光与红光处理之间差异不显著,但与对照和蓝光处理之间差异显著;但红光与蓝光和对照之间差异不显著。

表1 单色光对苋菜试管苗光合色素含量的影响Table 1 Effect of monochromatic light on photosynthetic pigments content of in vitro amaranth plantlets
2.1.2 不同光周期处理对苋菜试管苗光合色素含量的影响
苋菜试管苗培养在不同的光周期条件下,其光合色素含量变化如表2所示。
由表2可知,不同光周期处理苋菜试管苗叶绿素含量顺序为 24 h·d-1>6 h·d-1>18 h·d-1>12 h·d-1>0,光周期为24 h·d-1时类胡萝卜素含量最高,并且Chla/Chlb也与最大值之间差异不显著,而Car/Chl最小;6和18 h·d-1两个光周期处理下苋菜试管苗的光合色素含量之间差异不显著。

表2 光周期对苋菜试管苗光合色素含量的影响Table 2 Effect of photoperiod on photosynthetic pigments content of in vitro amaranth plantlets
2.1.3 不同pH处理对苋菜试管苗光合色素含量的影响
利用不同pH培养基培养苋菜试管苗,比较pH变化对苋菜试管苗光合色素含量的影响。
由表3可知,pH 5.4时叶绿素含量最高,为0.4410 mg·g-1,但是与pH 6.2、6.7差异不显著;pH 5.4时类胡萝卜素含量也达到最高水平,为0.0683 mg·g-1,与其他处理差异显著;pH 5.4、5.8、6.2时Chla/Chlb差异不显著;Car/Chl在pH 5.8时最高,为0.19。

表3 pH对苋菜试管苗光合色素含量的影响Table 3 Effect of pH on photosynthetic pigments content of in vitro amaranth plantlets
2.1.4 不同温度处理对苋菜试管苗光合色素含量的影响
温度是影响植物生长发育的重要因子之一,试验比较不同温度处理对苋菜试管苗光合色素含量变化的影响。
由表4可知,苋菜试管苗在不同温度条件下生长,叶绿素和类胡萝卜素含量存在明显差异。类胡萝卜素可以为Chla捕获光能,并且在强光下可避免叶绿素的光氧化,从表4分析亦可知,叶绿素含量在(32±1)℃条件下显著低于其他温度处理,并且类胡萝卜素含量、Chla/b比值、Car/Chl均显著小于其他温度处理;(20±1)、(24±1)、(28±1)℃处理的苋菜试管苗之间叶绿素含量、Chla/b、Car/Chl差异不显著,但均显著高于(32±1)℃处理。不同温度处理下的类胡萝卜素含量存在不同差异,(20±1)、(24±1)、(28±1)℃处理均显著高于(32±1)℃处理;但(20±1)℃处理显著高于(24±1)℃处理时类胡萝卜素含量与(28±1)℃处理差异不显著;而(28±1)℃处理又与(24±1)℃处理差异不显著。
2.2 环境因子对苋菜试管苗花色素苷含量的影响
2.2.1 不同单色光处理对苋菜试管苗花色素苷含量的影响
花色素苷是一类非光合色素类物质,试验研究不同单色光对花色素苷含量变化的影响,结果见表5。
由表5可知,不同单色光处理间苋菜试管苗花色素苷含量存在极显著差异,白光照射苋菜花色素苷含量最高,红光照射、绿光照射、蓝光照射苋菜红素含量依次递减,蓝光照射时苋菜试管苗花色素苷含量最低。苋菜试管苗花色素苷含量最高可达到0.40个色素单位,最低只有0.05个色素单位。
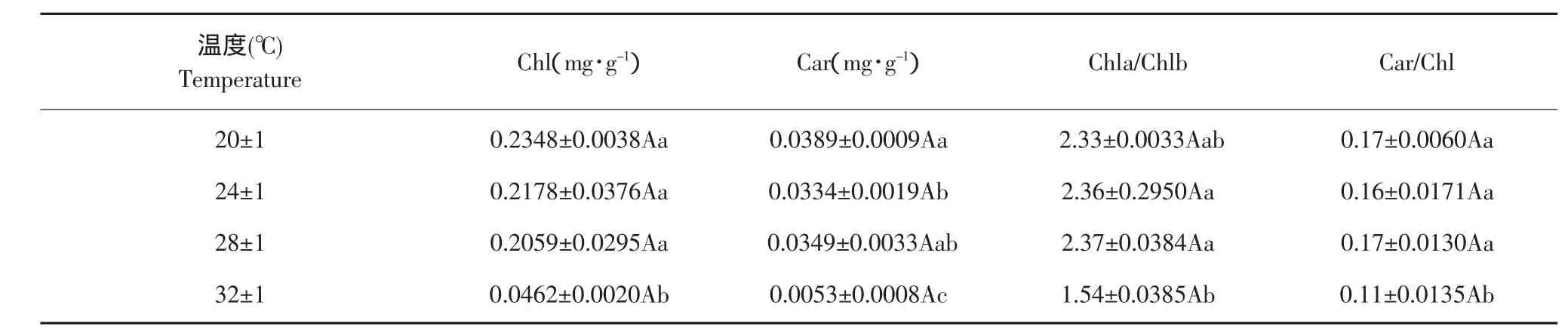
表4 温度对苋菜试管苗光合色素含量的影响Table 4 Effect of temperature on photosynthetic pigments content of in vitro amaranth plantlets
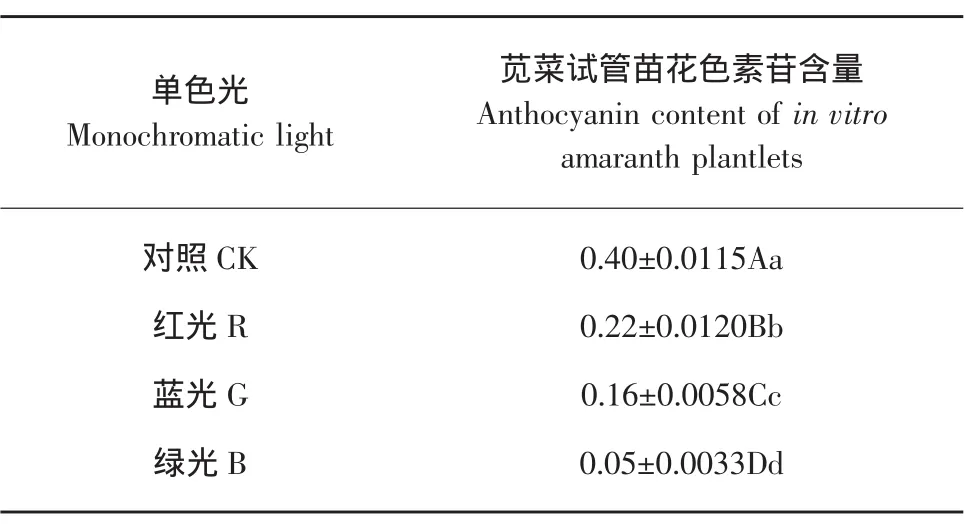
表5 单色光对苋菜试管苗花色素苷含量的影响Table 5 Effect of monochromatic light on anthocyanin content of in vitro amaranth plantlets
2.2.2 不同光周期处理对苋菜试管苗花色素苷含量的比较
不同光周期处理对苋菜试管苗花色素苷含量的影响,结果见表6。

表6 光周期对对苋菜试管苗花色素苷含量的影响Table 6 Effect of photoperiod on anthocyanin content of in vitro amaranth plantlets
由表6可知,不同光周期处理间对苋菜试管苗花色素苷含量的影响差异显著,且达到极显著水平,光周期12和18 h·d-1时苋菜试管苗花色素苷含量均最高,极显著高于其他3个光周期处理。
2.2.3 不同pH处理对苋菜试管苗花色素苷含量的影响
试验比较培养基不同pH条件对苋菜试管苗花色素苷含量的影响,结果见表7。

表7 pH处理对苋菜试管苗花色素苷含量的影响Table 7 Effect of pH on anthocyanin content of in vitro amaranth plantlets
由表7可知,不同pH处理间对苋菜试管苗花色素苷含量影响差异显著,达到1%的极显著水平,pH 5.4和pH 5.8时苋菜试管苗花色素苷含量显著高于其他pH处理,但二者之间差异不显著。随着pH升高,苋菜试管苗花色素苷含量呈显著降低趋势,说明pH较高时不利于苋菜试管苗花色素苷含量的累积。
2.2.4 不同温度处理对苋菜试管苗花色素苷含量的影响
苋菜试管苗分别培养在不同的温度条件下,比较不同温度处理对苋菜花色素苷含量的影响,结果表明在20~32℃范围内,花色素苷含量变化差异不显著(见表8)。
2.3 环境因子对苋菜试管苗红色素含量的影响
2.3.1 不同温度处理对苋菜试管苗红色素含量的影响
由表9可知,不同温度处理间对苋菜试管苗红色素含量的影响差异显著,且达到极显著水平,(20±1)℃时苋菜试管苗红色素含量最高,达到5.25个色素单位,极显著的高于其他温度处理。温度为(28±1)和(32±1)℃时,苋菜试管苗红色素含量最低,但二者之间差异不显著。
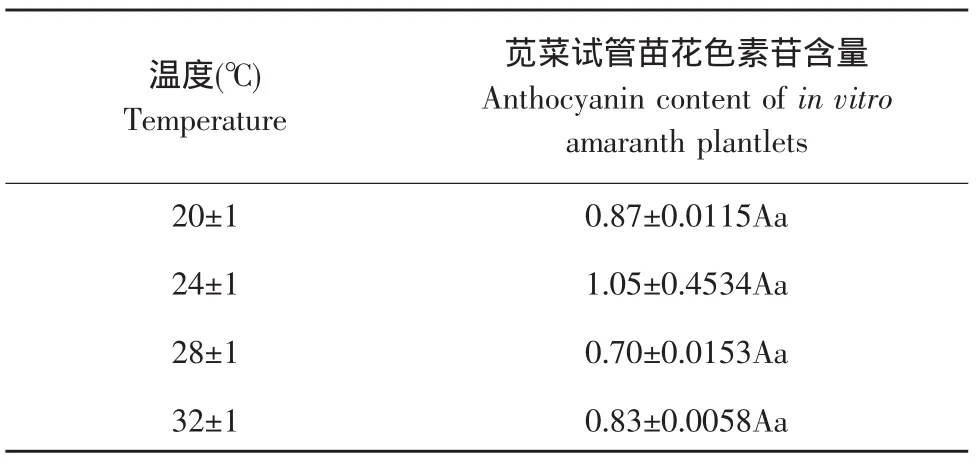
表8 温度对苋菜试管苗花色素苷含量的影响Table 8 Effect of temperature on anthocyanin content of in vitro amaranth plantlets
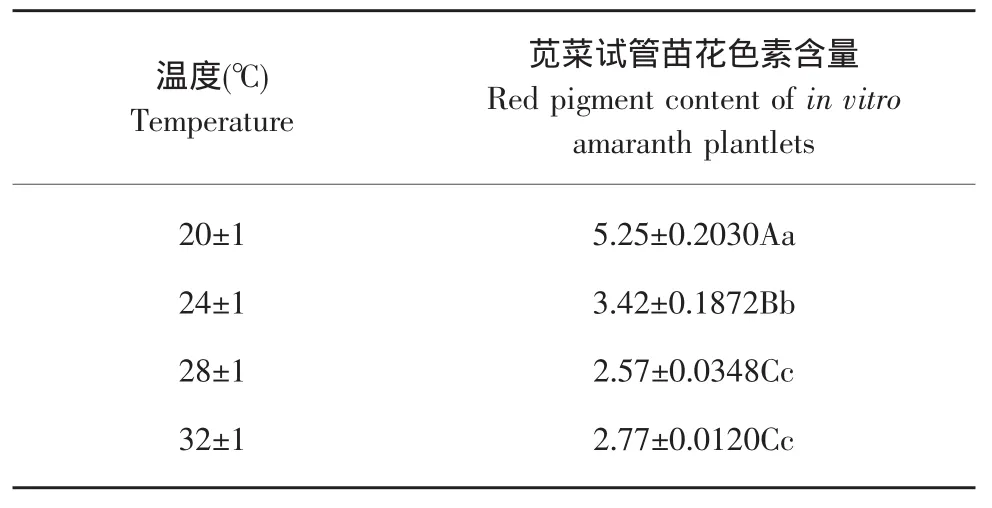
表9 温度对苋菜试管苗红色素含量的影响Table 9 Effect of temperature on red pigment content of in vitro amaranth plantlets
2.3.2 不同pH处理对苋菜试管苗红色素含量的影响
试验比较培养基不同pH条件对苋菜试管苗红色素含量的影响,结果见表10。
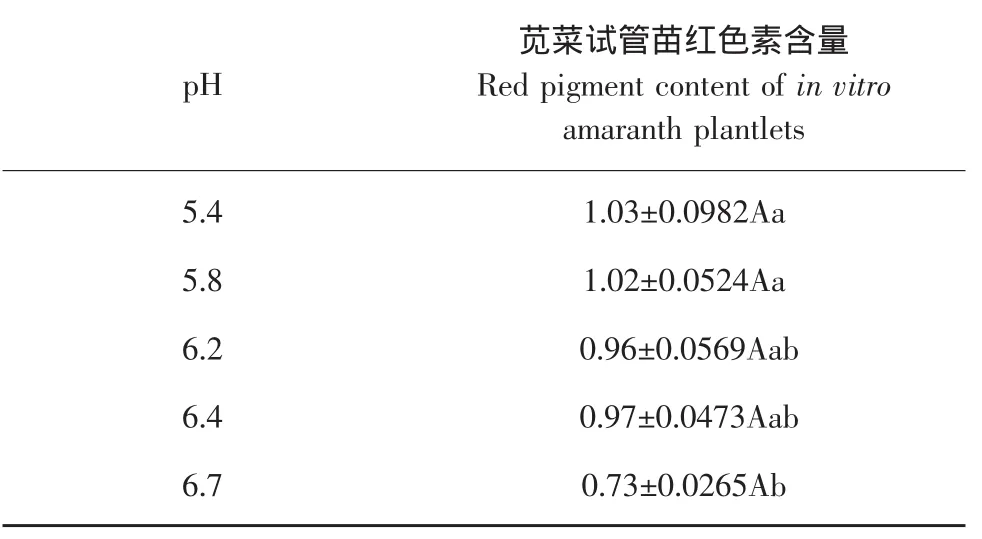
表10 pH对苋菜试管苗红色素含量的影响Table 10 Effect of pH on red pigment content of in vitro amaranth plantlets
由表10可知,不同pH处理对苋菜试管苗苋菜红色素含量的影响差异显著,pH 5.4和pH 5.8时苋菜红色素含量均较高,pH 6.2和pH 6.4时苋菜红色素含量略低于pH 5.4和pH 5.8,但是差异不显著,在5个不同pH处理中pH 6.7时苋菜红色素含量较低。
3 讨论与结论
3.1 环境因子对苋菜试管苗光合色素含量的影响
光是影响植物光合色素合成的重要条件,不同波长的光与植物体内相应的光受体作用,调控色素合成,光质对叶片叶绿素含量具有重要的影响[9],并且众多研究结果表明,植物种类、发育时期以及组织或器官对同一种光质的反应具有差异性,表现出光质生物学反应的复杂性[10]。不同植物对光质的响应不同。有研究发现,叶用莴苣在黄光下叶绿素、Chla/Chlb的含量最高[11];但红光可以提高草莓的Chla、Chlb和总叶绿素的含量[12]。但有研究发现,红光有利于一品红叶片中叶绿素b的合成,蓝光有利于叶绿素a的合成[13]。
本研究结果表明,不同单色光处理对苋菜试管苗光合色素的影响差异显著,红光、蓝光、白光照射时叶绿素含量均较高,而绿光照射叶绿素含量偏低,与刘媛等的研究结果类似[14],可能因为在一种色素蛋白复合体上进行从原叶绿素酸酯到叶绿酸酯的转变过程需要光,红光、蓝光能更好地被其利用,而白光中包含这两种光质,因此白光下的总叶绿素含量较高,但对黄瓜研究发现,生长在白光下的叶片中叶绿素含量比红光和蓝光下高,在蓝光下的含量最低[15]。
光周期条件同样影响植物的光合作用,光照时间达到一定积累量时,可促进植物的生长,严美姣等在对藻类的研究中发现[16],光周期18 h·d-1时其生长速率最快,并且叶绿素含量最高。本试验结果发现,在5个光周期处理中,全日照时苋菜试管苗叶绿素含量最高。这可能是因为试验材料基因型不同,对光照时间的需求也不一致,还需要在其他材料上进一步验证。
叶绿素的生物合成需要通过一系列的酶促反应,温度过高和过低都会抑制酶反应,甚至会破坏原有的叶绿素[17]。不同植物都有其不同的最适生长温度,本试验研究结果表明,不同温度处理对苋菜试管苗光合色素含量的影响存在显著差异,表现在较高温度(32℃)时,叶绿素含量降低,类胡萝卜素含量也达到最低水平,高温抑制苋菜试管苗的生长,抑制其叶绿素的合成。环境pH也会影响叶绿素合成过程中的酶促反应,不同植物对pH的响应不同,对条斑紫菜和孔石莼的光合作用的研究表明,pH越低其光合速率越低,原因可能是较低的pH降低了与光合作用有关的酶的活性或是叶绿素受到破坏而引起的[18]。本试验结果表明,不同pH处理对苋菜试管苗光合色素的影响差异显著,在pH 5.4时叶绿素含量最高,有利于苋菜光合作用的进行,可促进苋菜试管苗的生长。
3.2 环境因子对苋菜试管苗花色素苷含量的影响
花色素苷又称花青素、花素苷、花色苷,属黄酮类化合物,是植物组织中广泛存在的一类物质,由于其颜色鲜艳,且对人的健康有益,长期以来一直是人们研究、开发和使用的重要天然色素之一[19]。
花色素苷的形成和植物组织中糖的积累有关,一些有利于某植物组织内含糖量增加的环境因子,往往也有利于花色素苷的合成[20]。影响花色最重要的生态因子是光照[20],光照可以激活光敏色素,促进酶的合成或活化,提高碳水化合物的含量。PAL、CHS、DFR和UFGT都是光调节酶,光可以诱导这些酶的活性提高,促进花青苷积累和果实着色。光照的作用除与糖的合成有关外,还在于其直接作用于花色素的形成等。本试验研究结果发现,白炽灯光照射苋菜试管苗花色素苷含量最高。红光、绿光、蓝光照射时花色素苷含量依次递减,说明单色光处理时,短波光可抑制花色素苷的积累;当光周期为12和18 h·d-1时,花色素苷含量较高,苋菜的叶片比较深红,小于12 h·d-1和大于18 h·d-1时花色素苷含量降低。而叶绿素、类胡萝卜素等光合色素含量在光周期为12 h·d-1时较低。这种变化趋势还需要进一步去探讨和研究。
温度条件也是影响花色素苷累积的重要因子,花青苷合成是一系列酶促反应,温度过高或过低都影响酶活性可使酶钝化,从而不利于生化反应的进行[21]。基本上低温(在一定温度范围内)对花青素的累积较为有利。这是因为在冷凉的温度下PAL活跃[22],从而加速着色。同时低温下植物组织呼吸消耗少,有利于糖分的积累。适当低温不仅有利于提高花青苷合成基因的发育调节,而且是花青苷积累的一种特殊信号[23]。而本试验中,不同温度处理对花色素苷积累的影响差异不显著,这可能是因为试验设置的低温程度不够,最低温度(20±1)℃还是偏高。
pH影响试管苗的生长,酸性或碱性条件可影响花色素苷合成过程中的酶活性,从而影响花色素苷的累积。不同植物生长的适宜pH条件要求不同,一般认为酸性条件较利于花色素苷的合成,本试验研究结果符合这一规律,不同pH处理对苋菜试管苗花色素苷含量的影响差异显著,pH 5.4和5.8时花色素苷含量较高,pH 6.2、6.4和6.7时花色素苷含量较低,说明偏酸性条件可促进花色素苷的累积。
3.3 环境因子对苋菜试管苗红色素含量的影响
苋菜红色素属于花青素类[24],是一种水溶性色素,对食品和饮料的染色效果良好,对人体具有一定的保健功能。苋菜红色素的主要成分包括花色素苷类物质,故其含量变化与花色素苷类似,受到环境温度和pH的影响。本试验研究结果表明,不同温度处理对苋菜试管苗苋菜红色素含量的影响差异显著,温度较低可促进苋菜红色素的合成,但是却抑制试管苗的生长,这可能是因为低温促进了植物体内糖苷类物质的合成,但是却抑制呼吸作用的结果。
本研究结果也证实了酸性条件可促进花色素类物质的累积,不同pH处理对苋菜试管苗苋菜红色素含量的影响差异不显著,pH 6.7时苋菜红色素含量较低,其他pH条件下苋菜红色素含量差异不显著,说明偏酸性条件可促进苋菜红色素累积。
[1] 杨瑞因,李曙轩.苋菜的叶绿素和花青素含量变化 [J].植物生理学通讯,1986(4):27-29.
[2] 侯蕴华,吴紫华,张立实,等.食用天然苋菜红色素安全性毒理学研究[J].四川生理科学杂志,1989(2):55.
[3] 廖正福,黎小珂,陆向忠.天然苋菜红色素的提取与性质研究[J].广西师院学报:自然科学版,1995,13(1,2):125-128.
[4] 王宁,薛源,孙体健.苋菜红色素对羟基自由基和超氧阴离子自由基的清除作用[J].山西医科大学学报,2009,40(5):458-460.
[5] 张平.几种常见彩叶植物的色素组成与叶色关系的研究[J].山东林业科技,2008(3):14-16.
[6] 刘生财.节能日光温室地中热阻隔及对蔬菜生长的影响[D].哈尔滨:东北农业大学,2005.
[7] 宋长铣.花色素类色素的分析方法[J].科技进展,1999,13(1):20-24.
[8] 王怀宗,金玲玲,王武,等.微波萃取苋菜红色素及其稳定性的研究[J].食品研究与开发,2008(9):45-47.
[9] 张微慧,张光伦.光质对果树形态建成及果实品质的生理生态效应[J].中国农学通报,2007,23(1):78-83.
[10] 余让才,范燕萍,李明启.光呼吸与硝酸还原关系研究[J].中国农业科学,2002,35(1):49-52.
[11] 许莉,刘世琦,齐连乐,等.不同光质对叶用莴苣光合作用及叶绿素荧光的影响[J].中国农学通报,2007,23(1):96-100.
[12] 徐凯,郭彦平,张上隆.不同光质对草莓叶片光合作用和叶绿素荧光的影响[J].中国农业科学,2005,38(2):369-375.
[13]江明艳,潘远智.不同光质对盆栽一品红光合特性及生长的影响[J].园艺学报,2006,33(2):338-343.
[14] 刘媛,李胜,马绍英,等.不同光质对葡萄试管苗离体培养生长发育的影响[J].园艺学报,2009,36(8):1105-1112.
[15] 储钟稀,童哲.不同光质对黄瓜叶片光合特性的影响[J].植物学报,1999,41(8):867-870.
[16] 严美姣,王银东,胡贤江.光照对小球藻、斜生栅藻生长速率及叶绿素含量的影响[J].安徽农学通报,2007,13(23):27-29、59.
[17] 王平荣,张帆涛,高家旭,等.高等植物叶绿素生物合成的研究进展[J].西北植物学报,2009,29(3):629-636.
[18] 高尚德,赵焕登.紫菜和石莼对酸耐受力的研究Ⅱ.不同pH对条斑紫菜和孔石头莼光合作用和细胞结构的影响[J].海洋与湖沼,1988,19(1):87-92.
[19] 方忠祥,倪元颖.花青素生理功能研究进展[J].广州食品工业科技,2001,19(3):60-62.
[20] 潘耕耘,邱其伟.花瓣颜色成因分析[J].思茅师范高等专科学校学报,2006,22(3):19-22.
[21] 李兴国,于泽源.花青苷的研究进展[J].北方园艺,2003(4):6-8.
[22] 潘耕耘,邱其伟.花瓣颜色成因分析[J].思茅师范高等专科学校学报,2006(3):19-22.
[23] Hasegawa H,Fukasawa-Akada T,Okuno T,et al.Anthocyanin accumulation and related gene expression in Janpanese parsley(Oenanthestolonifera,DC.)induced by low temperature[J].Journal of Plant Physiology,2001,15H(1):71-78.
[24] 陈鼎,夏春镗.花青素类天然色素的光降解比较[J].同济大学学报:医学版,2006(5):13-16,20.
