番茄大花萼突变体MC基因的A FLP分子标记及种质资源筛选
2011-04-10李晓蕾李景富许向阳
李晓蕾,李景富,许向阳
(东北农业大学园艺学院,哈尔滨 150030)
番茄(Lycopersicon esculentum Mill.)是茄科(Solanaceae)番茄属(Lycopersicon)的一年生或多年生植物,原产于南美西部高原地带。随着市场的扩展和消费者的增多,人们对番茄品质的要求也越来越高。1994年美国Calgene公司开发了转基因番茄“Flar Savr”,这是首次商业化应用的改良转基因食品,这种番茄能够在货架上摆放2周以上不变软[1]。2002年,Vrebalov等发现番茄中的1个MADS-box基因与果实的成熟密切相关[2]。在百合中,转LfMASD1反基因植株中1朵花的雄蕊极短、花药缺失;转LfMASD1正义基因植株中发现1个花萼变瓣的突变体。在转LfMASD3反义基因植株中发现1个植株的苞叶部分瓣化,花柄变短[3]。含迟熟基因的品种外观表现为大花萼,而含大花萼突变体MC基因的品种外观表现也是大花萼。由此可见,花萼性状与MC基因存在重要的相关性。同时,随着生活水平的提高,人们对于番茄的外观品质要求日益提高,因此,通过研究MC基因培育外观美观的大花萼番茄品种也势在必行。
目前,用于标记基因的分子标记主要有RFLP、RAPD、SSR、AFLP。扩增片段长度多态性(Amplified fragments length polymorphism,AFLP),由 Zabeau和Vos于1993年发明[4],它实际上是RFLP和RAPD两项技术的结合[5]。该技术同时具备了RFLP的稳定性和PCR技术高效性的特点,多态性强,试验结果稳定,重复性好,典型的孟德尔遗传方式。然而,它所显示的只是扩增片段的有与无,是显性标记。Wang等利用AFLP技术构建了甜瓜(Cucumis melo L.)的遗传连锁图,含有197个AFLP位点、6个RAPD位点与1个微卫星位点,覆盖了1 942 cM遗传距离,并发现AFLP标记在甜瓜图谱构建中比RAPD及SSR标记更有效[6]。田雷等随机选择了30个AFLP的3+3引物组合进行选择性扩增,获得清晰可见的DNA指纹图谱[7]。张增翠等对不结球白菜优质品种矮抗6号及其父母本进行了AFLP标记分析,筛选出两对AFLP引物组合,能清楚表明杂种一代与父母本之间的遗传关系[8]。
本试验主要研究了与番茄外观品质密切相关的花萼性状,采用AFLP分子标记方法在DNA水平上研究番茄大花萼基因,建立番茄AFLP分子标记技术体系,构建与番茄MC基因紧密连锁的AFLP标记。为分子标记辅助选择育种打下基础,为培育番茄大花萼的品种提供理论和技术上的支持,并进一步解决了市场对大花萼番茄品种的需求问题。
1 材料与方法
1.1 材料
1.1.1 番茄材料
大花萼突变体亲本08085、正常亲本08086以及08085和08086有性杂交的F2代单株。
材料均由东北农业大学园艺学院番茄课题组提供。
1.1.2 试验试剂
CTAB、EDTA、RNase、TaqDNA聚合酶、MseⅠ、EcoRⅠ、T4DNA连接酶均为BMI公司产品,Repel、Binding为北京鼎国生物技术公司生产,尿素、甲酰胺、过硫酸铵、TEMED、甲叉均为Amsensco。DNA Marker、dNTP、AFLP引物由上海生工生物工程和大连生物公司合成或生产。其他试剂如氯仿、异戊醇、异丙醇、硫代硫酸钠、无水乙醇、甲醛、冰乙酸、甲苯青、溴化乙锭等化学试剂由哈尔滨市宝瑞生物试剂公司和哈尔滨市德美试剂公司提供。Tris-HCl、琼脂糖为进口分装,其他试剂为国产分析纯试剂。
1.2 方法
1.2.1 田间调查
在番茄果实花期对父母本、F1及F2代群体的花萼大小进行调查并记录。为了保证数据的稳定性,田间数据调查先后进行3次。通过观察后代的大花萼与正常花萼单株的比率,用χ2测验法计算是否符合3∶1的分离规律。
1.2.2 基因组DNA的提取及混合池的建立
番茄幼苗四叶一心时,取番茄植株幼嫩叶片,用自来水、蒸馏水冲洗两遍,用滤纸吸干后称取0.2 g于1.5 mL离心管,用液氮速冻后-20℃保存备用;采用CTAB微量法提取DNA[9]。
从F2代群体选取9株大花萼单株和9株正常花萼单株,将大花萼株系的DNA混合建立大花萼基因池,正常花萼株系DNA混合建立正常花萼基因池。1.2.3 AFLP分子标记
1.2.3.1 基因组DNA的酶切与连接
基因组DNA的Eco RⅠ、MseⅠ双酶切和接头的连接采用一步完成,其反应体系如下:DNA 100~500 ng,Eco RⅠ(10 U·μL-1)0.5 μL,MseⅠ(10 U·μL-1)0.5 μL,Eco RⅠ adapter(5 pmol·μL-1)1.0 μL,MseⅠadapter(50 pmol·μL-1)1.0 μL,ATP(10 mmol·μL-1),10×buffer 5.0 μL,T4DNA 连接酶(5 U·μL-1)0.6 μL,加 ddH2O 调至 25 μL。37 ℃酶切与连接6~8 h或过夜(时间不能太长)。
1.2.3.2 DNA片段的预扩增
预扩增的体系:DNA(酶切连接后产物)2 μL,Eco RⅠ-primer(E00 50 ng·μL-1)0.6 μL,MseⅠ-primer(M00 50 ng·μL-1)0.6 μL,10×buffer 2 μL,dNTPs(2.5 mmol·L-1)1.6 μL,MgCl21.2 μL,TaqDNA聚合酶(5 U·μL-1)0.2 μL,加 ddH2O 调至 20 μL。
预扩增的程序:94℃3 min;94℃30 s,56℃30 s,72℃ 1 min,24个循环;72℃ 10 min;4℃终止反应。
预扩增反应在PCR仪上进行,预扩增完成后,取3 μL扩增产物和1 μL Loading buffer混合后在0.8%琼脂糖凝胶中电泳,电泳后在紫外灯下检测预扩增结果。预扩增产物稀释20~40倍,用于选择性扩增,余下的预扩增产物放在-20℃保存。
1.2.3.3 DNA片段的选择性扩增
选择性扩增的体系:DNA(预扩增产物稀释30×)5 μL,Exx(50 ng·μL-1)1.0 μL,Mxx(50 ng·μL-1)1.0 μL,10×buffer 2 μL,dNTPs(2.5 mmol·L-1)1.6 μL,MgCl21.2 μL,TaqDNA 聚合酶(5 U·μL-1)0.2 μL,加ddH2O调至20 μL。
选择性扩增程序:94℃ 3 min;94℃ 30 s,65℃30 s(每个循环-0.7℃),72℃ 1 min,12个循环;94℃ 30 s,56℃ 30 s,72℃ 1 min(每个循环+1 s),25个循环;72℃10 min;4℃终止反应。
扩增在PCR仪上进行,选择性扩增完成后,在扩增产物中加入30%~40%的Loading buffer在PCR仪中95℃变性5 min后,立即置于冰水混合物中冷却,然后对扩增体系进行聚丙烯酰胺凝胶电泳,观察统计条带确定连锁距离。
2 结果与分析
2.1 田间调查结果
结果表明,父本08085全部为大花萼,母本08086为正常花萼,F1代为大花萼,F2代群体表现实际分离比为 3.175∶1,χ2检测符合 3∶1 的分离比例。分析表明,所含的MC基因所控制的性状是由单基因控制的性状,结果见表1。

表1 番茄MC基因遗传规律分析Table 1 Genetic analysis of MC gene in tomato
2.2AFLP标记
2.2.1 引物筛选
利用父母本对488对引物进行初步筛选,对筛选出的61对引物进行混合池复选,得到多态性高的28对引物,结果见表2。
2.2.2 F2单株PCR扩增
以08086×08085群体的334个F2单株DNA的预扩增产物为模板,用这28对引物进行选择性扩增。然后用聚丙烯酰胺凝胶电泳检测,并记录谱带。对每个标记的带型在F2群体中的分布进行χ2测验。
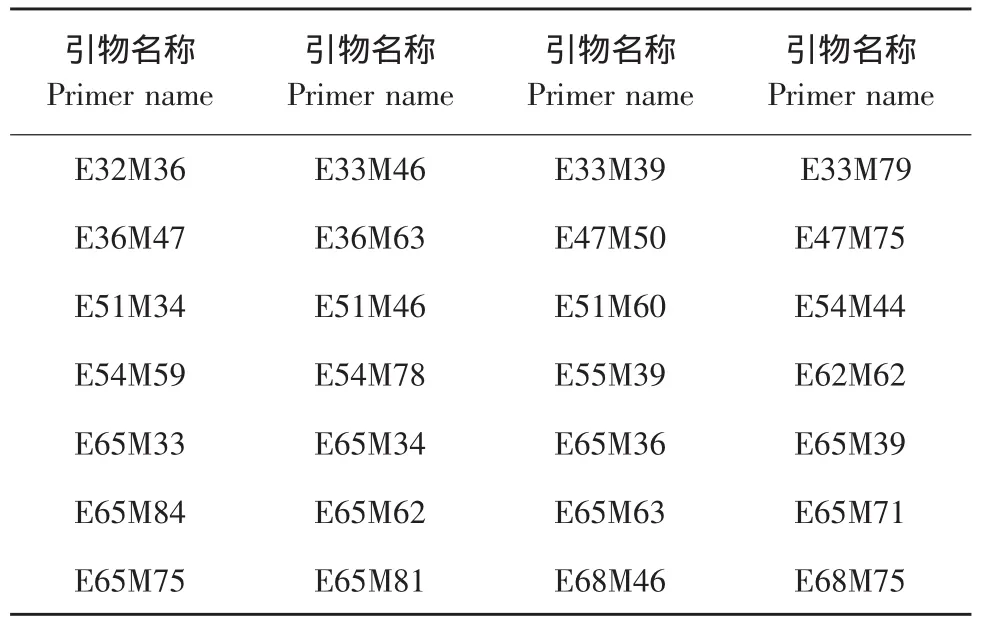
表2 用于群体F2单株选择性扩增的特异引物Table 2 Special primers used in amplication of F2individual plants of 08086×08085
利用Mapmarker 3.0软件对该结果进行连锁分析,结果表明,E65M63-D、E32M36-D和E47M75-A与MC基因的连锁距离分别为5.1、7.2、12.3 cM。其中E65M63-D是有价值的分子标记,可以作为分子辅助选择的使用,结果见图1。
2.3 种质资源筛选
用本课题组提供的48份番茄材料为试材,进行田间调查,得到番茄大花萼材料20份,同时运用AFLP标记E65M63-D检测,进行AFLP标记验证分析,结果二者吻合度达91.7%,说明本试验找到的番茄大花萼特异分子标记可以用于番茄育种材料含MC基因的追踪选择。图2为部分番茄材料的AFLP标记检测结果。

图1 引物E65M63在部分F2单株中的扩增结果Fig.1 Amplified products on AFLP primer of E65M63 on partial F2population
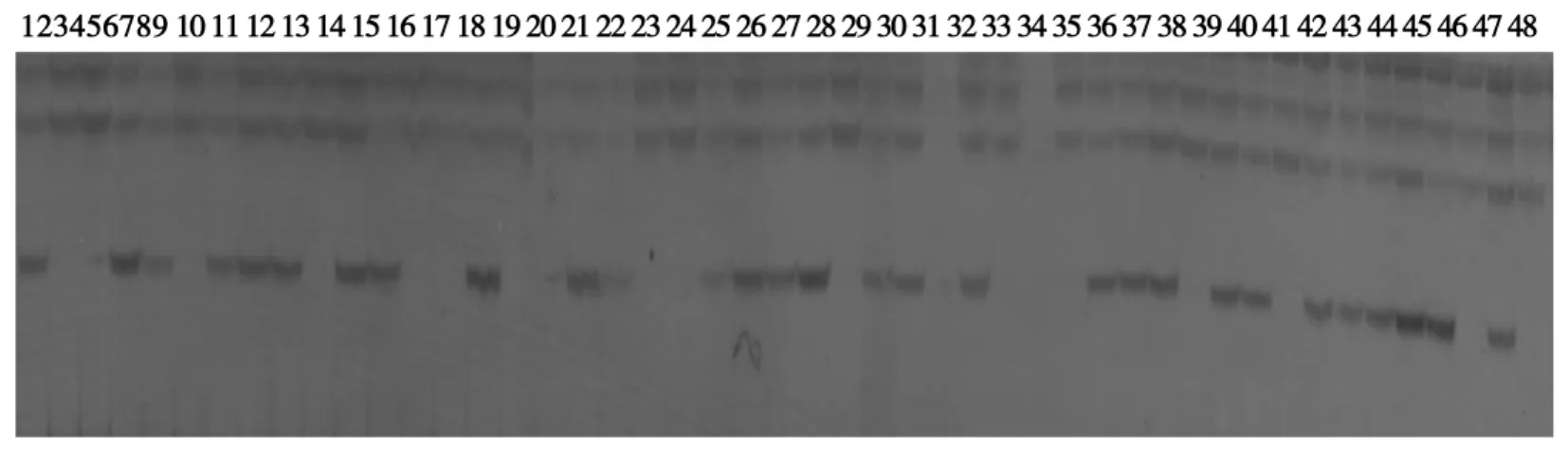
图2 E65M63-D对部分材料的检测结果Fig.2 Amplified products of AFLP primer E65M63-D on partial individual plants
3 讨论
本试验采用了稳定成熟的AFLP标记方法对番茄品质性状相关的大花萼突变体MC基因进行研究,获得了3个紧密连锁的标记,其中标记E65M63-D遗传距离为5.1 cM,是有价值的标记。通过对48份番茄材料进行标记检测,并结合田间调查,二者吻合率较高,证明了所获得的标记具有应用价值。AFLP标记的遗传距离较远的原因可能是与选择的父母亲本的亲缘关系有关,因此在选择上应选择遗传关系较远的配制杂交组合,这样可以获得更多的多态性标记,有利于获得更近的标记。
对于试验中出现的偏分离现象在几乎所有类型的遗传标记都可见到[10]。分子标记表现偏分离的原因是由于遗传搭车效应(Hitch hiking)和分子标记与影响偏分离等位基因频率的遗传因子连锁紧密。还有另外两种假说解释偏分离现象,一种假说认为由于配子体选择的缘故,F2群体出现偏分离的比例0∶2∶1(亲本1∶正常∶亲本2)。另一种假说认为是花粉选择导致了0∶1∶1的偏分离[11]。还有人认为偏分离现象是由于环境因素的影响。
本试验的研究结果表明番茄大花萼突变体MC基因为显性单基因控制的性状,因此下一步的工作可将试验获得的标记转化为快捷、稳定的SCAR标记,对番茄种质资源进行准确的含MC基因资源的筛选工作。利用含MC基因的品种配制杂交组合,通过基因工程技术把相应的MC基因转入植物的细胞中,利用细胞融合技术获得转基因植株,并将其应用于番茄的育种中,加速番茄品质育种进程。
4 结论
本试验利用含MC基因的08085为父本,正常材料08086为母本,及其有性杂交的F2分离世代的种子为试验材料。对其F2进行田间调查,调查鉴定结果表明符合3∶1的分离比率,说明MC基因是显性单基因控制的。建立了稳定的适合番茄基因组分析的AFLP反应的技术体系。通过筛选488对AFLP引物,利用Mapmaker 3.0软件处理数据,最终得到3个AFLP标记与番茄大花萼MC基因连锁,分别是E32M36-D、E65M63-D和E47M75-A,并计算得到它们与MC基因之间的遗传距离分别为7.2、5.1、12.3 cM。应用所获得的遗传距离较近的AFLP标记E65M63-D对本课题组的48份番茄材料进行分析鉴定,同时结合田间鉴定,结果AFLP分析与人工接种鉴定吻合率达91.7%,进一步证明了AFLP标记的应用价值,为分子标记辅助选择育种打下基础。
[1] 宋宁宁,侯文秀,许向阳.基因工程在番茄育种中的应用[J].2009,40(5):123-128.
[2] Vrebalov J,Ruezinsky D,Padmanabhan V,et al.AMADS-Box gene necesssary for fruit ripening at the tomato ripening inhibitor(Rin)locus[J].Science,2002,296(5566):343-346.
[3] 赵印泉,弥志伟,刘青林.百合LfMADS基因植物表达载体的构建及其功能分析[J].园艺学报,2007,342:437-442.
[4] Zabeau M,Vos P.Selective restriction fragment amplification a general method for DNA fingerprinting:European,05344858A1[P].1993.
[5] 李柱刚,崔崇士,马荣才,等.遗传标记在植物上的发展与应用[J].2001,32(4):313-319.
[6] Wang Y H,Thomas C E,Dean R A.Genetic map of melon(Cucumis melo L.)based on amplified fragment length polymorphsim(AFLP)markers[J].Theoretical and Applied Genetics,1997,95:5-6.
[7] 田雷,曹鸣,王庆辉,等.AFLP标记技术在大白菜种子真实性及品种纯度鉴定中的应用[J].中国蔬菜,2001(4):29-30.
[8] 张增翠,侯喜林.不结球白菜矮抗6号的AFLP指纹鉴定[J].江苏农业科学,2004(1):63-64.
[9] 王关林,方宏筠.植物基因工程[M].北京:科学出版社,2002:742-743.
[10] Konish T,Abe K,Mastsunra S,et al.Distorted segregation of the esterase isozyme genotypes in barely Hordeum vulgare L.[J].Jpn J Genet,1990,65:411-416.
[11] Haanstra J P W,Laugé R,Meijer-Dekens F,et al.The Cf-ECP2 gene is linked to but not part of the Cf-4/Cf-9 cluster on the short arm of chromosome I in tomato[J].Molecular and Genetics,1999,262(4-5):839-845.
