乳源降血压七肽基因在毕赤酵母中的表达研究
2011-04-10韩建春李名远
韩建春,李名远,李 杰
(1.东北农业大学食品学院,哈尔滨 150030;2.东北农业大学生命科学学院,哈尔滨 150030)
抗高血压肽(Antihypertensive peptide,AHP)是血管紧张素转化酶(Angiotensin converting enzyme,ACE)的抑制剂,可通过抑制人体血管紧张素Ⅱ的生成达到降低血压的目的[1]。它源于食品,能够降低人体血压,且毒副作用小[2-4]。近年来很多研究采用酶解法已从牛奶、乳酪、大豆等不同的天然蛋白质中获取得到了具有较好ACE抑制活性的酶解抗高血压肽,但其提取步骤繁琐、产率低,限制了抗高血压肽的研究和开发[5-6]。基因工程技术的发展为降血压肽的开发利用带来了契机。利用基因工程技术来生产食品原料、药物已越来越多,为利用基因工程技术制备抗高血压肽提供了很好的借鉴[7-9]。目前,国内这方面的研究还正处于起步阶段,研究报道不多。基因工程制备抗高血压肽克服了直接从动、植物、微生物原料中分离提取抗高血压肽筛选水解酶类的盲目性(特异性蛋白水解酶事先选定),以及纯化工艺的复杂繁琐性,而且不受原料来源的限制,生产周期短,下游分离纯化工艺简单,便于进行大规模生产等优势,因此,具有广阔的应用前景。
本研究根据Maruyama等[10]于1982年报道,在牛乳酪蛋白的胰蛋白水解物中分离到了一种在体外具有ACE抑制活性的抗高血压生物活性七肽,经动物体内实验已经证明具有降低血压作用[11-12]。利用基因工程技术,根据毕赤酵母密码子偏爱性,人工合成了具有较高活性的抗高血压七肽串联基因序列,并构建酵母表达载体,转化毕赤酵母GS115。进一步对表达的蛋白进行分析,为抗高血压七肽的工业化生产和应用奠定基础。
1 材料与方法
1.1 材料与仪器
1.1.1 菌种及载体
大肠杆菌DH5α、毕赤酵母GS115由本实验室保存;pPIC9载体由本实验室保存。
1.1.2 试剂及酶类
DNA片段回收试剂盒(鼎国生物工程公司);ACE和底物马尿酸酰组氨酸酰亮氨酸(Sigma公司);限制性内切酶、T4DNA连接酶、rTaq酶、dNTPs(大连宝生物工程公司TaKaRa);T载体(Promega公司);其他化学试剂皆为分析纯。
1.1.3 主要仪器设备
BIO-RAD Mini-PROTEIN3 蛋白质电泳系统;Amersham Biosciences Ultrospec 1100pro紫外分光光度计;BIO-RAD PTC-200 PCR仪;OMEGA 10TM凝胶成像系统。
1.2 试验方法
1.2.1 抗高血压七肽串联基因的合成
合成抗高血压七肽串联基因的引物序列由上海生工生物工程技术服务有限公司合成:
AHSP-1:5′CTCGAGAAAAGAGAGGCTG3′XhoⅠAHSP-2:5′CTGGAGAAAAGAGAGGCTGAAGCT GCTGTTCCATACCCACAAAG 3′
AHSP-3:5′TTTGTGGGTATGGAACAGCTCTTT GTGGGTATGGGACAGCTCTTTGTGGGTATGGAAC3′
AHSP-4:5′GCGGCCGCTTATCTTTGTGGGTATG GAACAG3′NotⅠ
合成分两轮PCR进行,第一轮是引物AHSP-1、AHSP-2进行PCR反应,第二轮是以第一轮PCR产物为模板,引物AHSP-1、AHSP-3进行PCR反应。回收250~500 bp的PCR产物加A后连接T载体,转化DH5α中。挑取单菌落,在Amp+的LB培养基中培养,取过夜培养物,提取质粒,并酶切电泳初步鉴定,选出阳性菌株,送上海生工生物工程技术有限公司测序。目的基因片段的回收、酶切、连接、转化均按基因工程常规方法操作。
1.2.2 毕赤酵母重组质粒表达载体的构建
利用XhoⅠ和NotⅠ酶切阳性克隆得到的串联基因片段,经0.8%(W/V)琼脂糖凝胶电泳后回收。将其与同样经XhoⅠ和NotⅠ酶切的表达载体pPIC9按照一定比例混合,加入T4DNA连接酶,16℃连接过夜。然后转化DH5α,挑取转化子于LB液体培养基37℃,200 r·min-1振荡培养过夜,提取质粒,并用适当的限制性内切酶酶切鉴定。
1.2.3 目的蛋白的表达
①挑选鉴定正确的单菌落,置于装有25 mL BMG培养基的250 mL摇瓶中,于28~30℃,250~300 r·min-1培养至 OD600=2.000~6.000(约 16~18 h)。
② 室温下 1 500~3 000 r·min-1离心 5 min,收集菌体,用BMM重悬菌体,使OD600=1.000左右(约 100~200 mL);
③将步骤2所得的菌液置于1 L的摇瓶中,用双层纱布封口,30 ℃、250~300 r·min-1继续生长;
④每24 h向培养基中添加100%甲醇至终浓度为0.5%~1.0%;
⑤按时间点分别取菌液样品,取样量为1 mL,置于1.5 mL离心管中,最大转速离心2~3 min,分别收集上清和菌体,分析目的蛋白的表达量和菌液最佳收获时间[13]。
1.2.4 表达产物浓缩
用TCA沉淀法浓缩毕赤酵母表达上清中的蛋白:
① 取诱导表达的菌液 1.5 mL,13 000 r·min-1,离心2 min,收集上清;
②取l mL上清置于1.5 mL离心管中,加入100 μL 100%TCA(预先放于4℃),颠倒混匀数次;
③样品置于冰浴中大约30 min(或在冰箱内放置 15 min);
④ 13 000 r·min-1,离心 10 min,可见有棕褐色沉淀,倒掉上清;
⑤将离心管倒扣在吸水纸上,于37℃烘箱烘干10~20 min,待管底无明显液体残留时,加入200 μL冰冷的丙酮(预先放于-20℃),轻弹离心管的管壁,洗去管底和管壁残留的TCA;
⑥ 13 000 r·min-1,离心 10 min,用 20 μL 枪头吸净管底残留的液体(操作尽量要快,不然沉淀容易散开,影响蛋白回收率),将离心管倒置于吸水纸上,37℃烘箱烘干5 min,确认管壁和管底没有液体残留;
⑦加入20~50 μL凝胶加样缓冲液,95℃加热10min使沉淀溶解,也可用手指轻弹管壁或用20μL枪头吹打,以促进蛋白溶解。
1.2.5 半抑制浓度的测定
将表达蛋白水解物冷冻干燥,用BBS溶液将其溶解配成试验需要浓度的溶液,按照水解物ACE抑制率的检测方法测定其抑制活性,以浓度为横坐标,ACE抑制率为纵坐标绘制曲线,使用Origin 7.5软件中的多项式拟合程序对曲线进行拟合,从得到的拟合方程中计算出当ACE抑制率为50%时,水解物的浓度即为半抑制浓度值(IC50)。
1.2.6 表达产物ACE抑制活性的检测
在Nakamura等方法上进行改进[14-15]。具体见表1。

表1 表达产物ACE抑制活性的检测Table 1 Assay of ACE inhibitory activities (μL)
将 ACE 酶底物 Hip-His-Leu(HHL)溶于 0.1 mol·L-1的含 0.3 mol·L-1NaCl的硼酸缓冲液中(pH 8.3),配制成5mmol·L-1的浓度。取100μL5mmol·L-1Hip-His-Leu 溶液,与 40 μL ACE 抑制肽(胰蛋白酶水解产物)混合(预先将水解产物pH调至8.3),在37℃条件下温育3 min。加入10 μL的0.1 U·mL-1的ACE酶(用去离子水配制),37℃条件下反应30 min,加 250 μL,1 mol·L-1的 HCl终止反应。然后在反应体系中加入1.0 mL乙酸乙酯萃取马尿酸,旋涡混合 15 s,在 10 000 r·min-1下离心 10 min,将上层的乙酸乙酯0.7 mL转移到一个干净的5 mL青霉素小瓶中,于120℃的干燥箱中干燥15 min,加热除去乙酸乙酯。然后再用5 mL的去离子水溶解马尿酸,在228 nm处测量其OD值。ACE酶的抑制程度用百分比来表示,计算方法为:

式中,A表示ACE及ACE抑制物都存在的条件下的OD值(实测值);B表示ACE抑制物不参与反应的条件下测得的OD值(对照值);C表示ACE不参与反应的条件下的OD值(空白值)。
2 结果与分析
2.1 抗高血压七肽串联基因的合成
抗高血压七肽串联基因AHP7P的合成如图1和 2所示。图1是引物 AHSP-2、AHSP-3进行PCR结果,图2是利用引物AHSP-1与AHSP-4及前步PCR产物的连续重叠延伸获得不同长度的含抗高血压七肽串联序列。从图1可以看出,第一轮PCR获得100~1 000 bp的弥散扩增片段,符合预期结果。图2是以第一轮PCR产物为模板,引物AHSP-1、AHSP-4进行PCR扩增的结果,获得了100~1 000 bp的弥散扩增产物。回收250~500 bp的片段进行加A反应,产物回收后连接pMD18-T载体,转化大肠杆菌DH5α中。提取质粒进行Eco RⅠ和HindⅢ双酶切初步鉴定(见图3)。经琼脂糖凝胶电泳分析出现约2 700、250 bp的2条谱带,表明目的片段成功与T载体连接。将重组质粒命名为pMD-AHP7P,送上海生工生物工程技术服务有限公司测序。
重组质粒测序结果为:CTCGAGAAAAGAGAG GCTGAAGCTGCTGTTCCATACCCACAAAGGCTGTT CCATACCCACAAAGAGCTTTCCATACCCACAAAGA GCTGTTCCATACCCACAAAGAGCTGTCCCATACCC ACAAAGAGCTGTTCCATACCCACAAAGAGCTGTTC CATACCCACAAAGAGCTGTTCCATACCCACAAAG AGCTGTTCCATACCCACAAAGAGCTGTTCCATACC CACAAAGAGCTGTTCCATACCCACAAAGAGCTGTC CCATACCCACAAAGAGCTGTTCCATACCCACAAAG ATAAGCGGCCGC
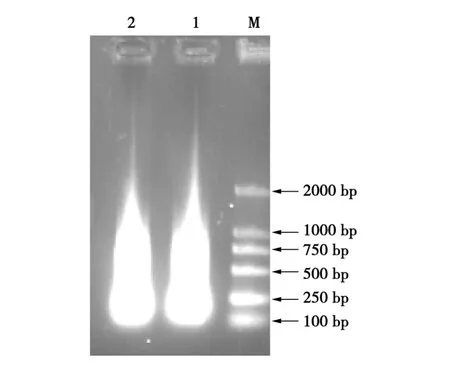
图1 第一轮PCR产物Fig.1 PCR product of the first cycle

图2 第二轮PCR产物Fig.2 PCR product of the secend cycle
预测由该基因编码的多肽链氨基酸序列为:Leu-Glu-Lys-Arg-Glu-Ala-Glu-Ala-Ala-Val-Pro-Tyr-Pro-Gln-Arg-Ala-Val-Pro-Tyr-Pro-Gln-Arg-Ala-Val-Pro-Tyr-Pro-Gln-Arg-Ala-Val-Pro-Tyr-Pro-Gln-Arg-Ala-Val-Pro-Tyr-Pro-Gln-Arg-Ala-Val-Pro-Tyr-Pro-Gln-Arg-Ala-Val-Pro-Tyr-Pro-Gln-Arg-Ala-Val-Pro-Tyr-Pro-Gln-Arg-Ala-Val-Pro-Tyr-Pro-Gln-Arg-Ala-Val-Pro-Tyr-Pro-Gln-Arg-Ala-Val-Pro-Tyr-Pro-Gln-Arg-Ala-Val-Pro-Tyr-Pro-Gln-Arg-Ala-Val-Pro-Tyr-Pro-Gln-Arg-***-Ala-Ala,即 Leu-Glu-Lys-Arg-Glu-Ala-Glu-Ala-(Ala-Val-Pro-Tyr-Pro-Gln-Arg)13。其中 Leu-Glu-Lys-Arg-Glu-Ala-Glu-Ala 为信号肽切割位点,经毕赤酵母自身信号肽酶切割后分泌蛋白序列为(Ala-Val-Pro-Tyr-Pro-Gln-Arg)13。该序列经胰蛋白酶酶解将获得抗高血压七肽 Ala-Val-Pro-Tyr-Pro-Gln-Arg。表明已成功获得抗高血压七肽串联基因序列。
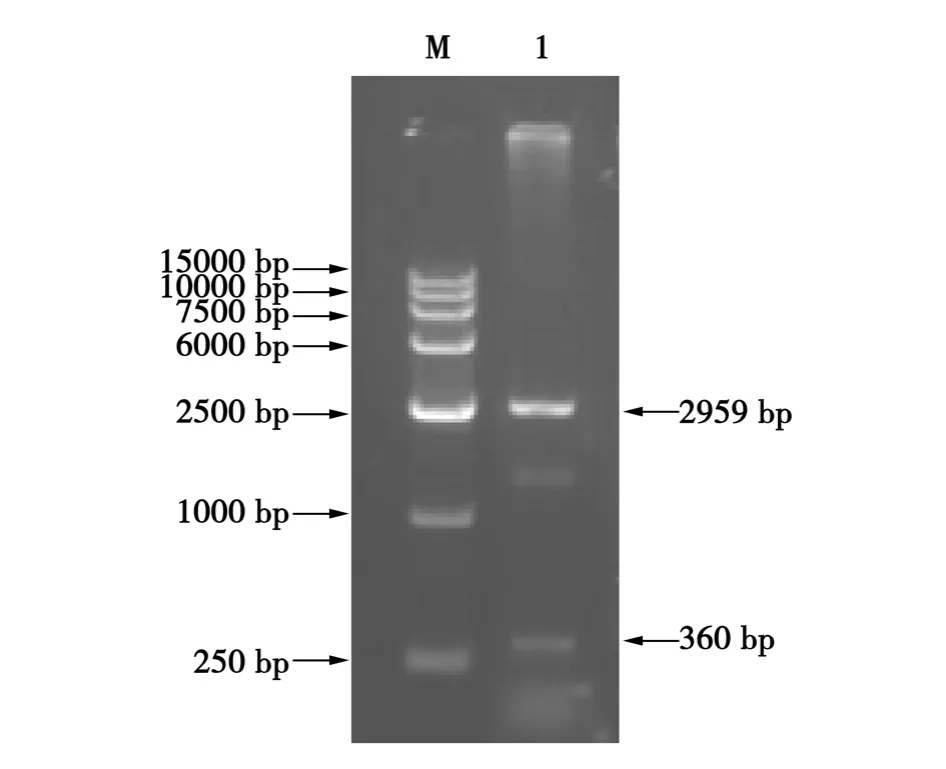
图3 pMD-AHP7P载体Eco RⅠ和HindⅢ双酶切鉴定结果Fig.3 Identification of vector pMD-AHP7P by Eco RⅠand HindⅢ
2.2 抗高血压七肽串联基因毕赤酵母表达载体的构建
用 XhoⅠ和 NotⅠ双酶切质粒 pMD-AHP7P,回收300 bp的目的片段。将pPIC9载体同样用XhoⅠ和NotⅠ双酶切,回收载体大片段。将两个回收的片段连接构建表达载体pPIC9-AHP7P,载体构建过程见图4。转化大肠杆菌DH5α,得到的转化子用Bam HⅠ和NotⅠ双酶切鉴定,切出约560 bp条带,说明载体构建正确。鉴定正确的转化子用于下一步试验,酶切鉴定结果见图5。

图4 pPIC9-AHP7P载体的构建Fig.4 Construction of vector pPIC9-AHP7P
2.3 毕赤酵母的转化
将构建好的表达载体pPIC9-AHP7P用BglⅡ酶线性化,酶切结果见图6,回收约7.0 kb的片段。制备毕赤酵母GS115菌株的感受态,通过电击将回收的线性化片段转入毕赤酵母中,在MD固体培养基上培养,结果见图7。
采用反复冻融法裂解酵母,取裂解产物直接进行PCR,并以pPIC9-AHP7P载体质粒为阳性对照,空载体为阴性对照。结果得到的2个酵母转化子均为阳性。PCR结果见图8。
2.4 毕赤酵母诱导表达蛋白的SDS-PAGE检测
将表达载体pPIC9-AHP7P转化毕赤酵母菌株,然后接于BMG培养基中培养至OD600=2.000~6.000(约16~18 h),收集菌体,用BMM培养基重悬菌体,使OD600=1.000左右(约100~200 mL)。每24 h向培养基中添加100%甲醇至终浓度为0.5%~1.0%,诱导菌株经超声波破碎处理,进行SDS-PAGE分析。SDS-PAGE分析表明(见图9),与未经诱导的对照以及诱导的pPIC9空载体对照相比,经诱导的重组菌有明显的重组蛋白表达带。经计算目的蛋白分子质量约为12 ku。电泳结果与预计相符。

图5 pPIC9-AHP7P载体Bam H I和NotⅠ双酶切鉴定结果Fig.5 Identification of vector pPIC9-AHP7P by Bam H I and NotⅠ

图6 pPIC9-AHP7P载体BglⅡ酶切线性化结果Fig.6 Digestion of vector pPIC9-AHP7P by BglⅡ
2.5 半抑制浓度的测定
在评价食源性ACE抑制肽活性强弱时,IC50值是不依附与样品浓度,最直观的评价指标,为了更加准确地评价表达蛋白水解物对ACE抑制活性的大小,进行了不同纯化阶段的表达蛋白水解物ACE抑制肽的IC50值测定。以样品浓度为横坐标,该浓度下样品ACE抑制率为纵坐标绘制曲线,如图10所示。从图10中可以看出,随着样品浓度的增加,ACE抑制活性逐渐增大,说明样品浓度与其ACE抑制活性有一定的效应关系,但当浓度增加到一定时,ACE抑制活性趋于稳定。通过Origin 7.5软件进行回归分析得到拟合出的方程,通过方程计算出当ACE抑制率为50%时样品的浓度,即为样品的IC50值,由方程可以算出样品的IC50值为0.0203 mg·mL-1。

图7 pPIC9-AHP7P载体电击转化毕赤酵母结果Fig.7 Result of vector pPIC9-AHP7P transformation into Pichia pastoris by electroporation

图8 转化子PCR鉴定结果Fig.8 Identification of transformants by PCR
2.6 表达产物的ACE抑制活性
表达产物经胰蛋白酶水解后,体外ACE酶抑制活性研究表明,水解产物的ACE酶活性的抑制率达65.12%,具有抗高血压肽活性。

图9 重组表达抗高血压肽的SDS-PAGE分析Fig.9 Analysis of recombinant expressed antihypertensive peptide by SDS-PAG
M-低分子质量蛋白Marker;1-甲醇诱导的pPIC9-AHP7P菌株上清;2-甲醇诱导pPIC9-AHP7P菌株沉淀;3-没有诱导的pPIC9-AHP7P菌株上清;4-诱导的pPIC9菌株上清
M-Standard protein molecular weight;1-Recombinant supernate strain pPIC9AHP7P induced by Methanol;2-Recombinant precipitation strain pPIC9-AHP7P induced by methanol;3-Uninduced recombinant supernate strain pPIC9-AHP7P;4-Supernate strain pPIC9 induced by methanol

图10 表达蛋白水解物浓度与ACE抑制活性关系曲线Fig.10 Active relations curve of expresses protein hydrolysate density and ACE suppresses
3 讨论
随着人们生活水平的不断提高,现代富贵病发病率逐年上升,高血压已成为危及人们身体健康的主要的疾病。利用血管紧张素转化酶抑制剂类药物抑制ACE的活性是临床治疗高血压的重要途径[15]。目前已有十几种化学合成药物作为降血压药物用于临床治疗,长期服用有一定的副作用[16]。而源于天然食物原料的抗高血压肽,也是一种有效的ACE抑制剂。通过酶解方法分离制备多种抗高血压肽国内外已有很多报道[17-19]。但是该方法分离纯化过程环节多、产量低,限制了抗高血压药品及保健品的产业化[20-21]。当前利用微生物基因工程技术高效表达外源蛋白质及多肽已成为解决从天然原料分离纯化蛋白质多肽低效率、低产率的重要技术,因此本研究采用基因工程技构建高表达抗高血压七肽的基因工程菌。
4 结论
抗高血压肽属小分子功能肽,这类多肽由于比较短小(一般只有几个至十几个氨基酸),利用基因工程菌表达时存在表达产物易被降解、表达量低等难题[22-25]。本研究通过特定的反常规PCR将引物重叠延伸合成出一条编码重复七肽序列的串联基因,将毕赤酵母表达载体pPIC9与PCR合成的目的基因连接,构建了目的基因的酵母表达载体pPIC9-AHP7P。将表达载体pPIC9-AHP7P通过电击法转入毕赤酵母,使其在毕赤酵母中表达,通过甲醇诱导,表达产物经胰蛋白酶水解后,体外ACE酶抑制活性研究表明,水解产物的ACE酶活性的抑制率达65.12%。通过试验确定了毕赤酵母表达蛋白酶切产物IC50值为0.0203 mg·mL-1。基于以上研究重组抗高血压肽可以进一步研制成为功能性食品乃至降血压药物,对提高国民健康水平有极重要的现实意义和广泛的应用前景。
[1] Fujita H K,Yokoyama M.Classification and antihypertensive activity of angiotensin Iconverting enzyme inhibitory peptides derived from food proteins[J].Food Sci,2000,65(4):564-569.
[2] 吕桂善,霍贵成.乳及乳制品中的抗高血压活性肽[J].中国乳品工业,2002,30(5):53-56.
[3] 吴炜亮,吴国杰,梁道双,等.ACE抑制肽的生理功能和研究进展[J].现代食品科技,2006,89:251-254.
[4] 肖红,段玉峰,刘平,等.食品蛋白质降血压肽及其研究进展[J].食品研究与开发,2004,25(10):3-7.
[5] Cushman D W,Ondetti M A.Design of angiotensin converting enzyme inhibitors[J].Nature Medicine,1999,5(10):1110-1113.
[6] 冯兴军,王建华,单安山.抗菌肽基因工程研究及表达策略[J].中国生物工程杂志,2006,26(3):63-67.
[7] 张军,杨雅麟,王建华.多肽串联基因构建策略[J].生物工程杂志,2009,29(8):107-112.
[8] 徐天鹏.里氏木霉纤维素酶基因的克隆及其在毕赤酵母中表达的研究[D].哈尔滨:东北农业大学,2007.
[9] Turner A J,Hooper N M.The angiotensin-converting enzyme gene family:Genomics and pharmacology[J].Trends in Pharmacological Sciences,2002,23(4):177-182.
[10] Sambrook J,Fritsch E F,Maniatis T.Molecular cloning:A laboratory manual[M].3rd Edition.New York:Cold Spring Harbor Laboratory Press,2003:34-259.
[11] Matoba N,Doyama N,Yamada Y.Design and production of genetically modified soybean protein with antihypertensive activity by incorporating potent analogue of Ovokinin(2-7)[J].FEBS Letters,2001,497:50-54.
[12] 中华人民共和国卫生部,中华人民共和国科学技术部,中华人民共和国国家统计局.中国居民营养与健康状况[M].北京:人民卫生出版社,2005:15-16.
[13] Yanewa J.Charaterization of inhibiton and stability of soyprotein derived angio-tensin-converting enzyme inhibitory peptides[J].Food Research Internation,2002,35(4):367-372.
[14]仲伟麒.里氏木霉木聚糖酶基因的克隆及其在毕赤酵母中高效表达的研究[D].哈尔滨:东北农业大学,2008.
[15] Nakamura Y,Yamamoto N,Sakai K,et al.Purification and characterization of angiotensin I-converting enzyme inhibitors from sour milk[J].J Dairy Sci,1995,78:777-783.
[16] Nakamura Y,Yamamoto N,Sakai K,et al.Antihypertensive effect of sour milk and peptides isolated from it that are inhibitors to angiotensin I-converting enzyme[J].J Dairy Sci,1995,78:1253-1257.
17] 冯建辉,周俊.高血压药物治疗进展[J].现代诊断与治疗,2007,18(1):63-64.
[18] Fitz G R J,Meisel H.Milk protein derived peptide inhibitors of angiotensin I-converting enzyme[J].British J Nutr,2000,84(1):33-37.
[19] 王海燕.发酵乳中降血压产品的研究[J].保定:河北农业大学,2002:13-14.
[20] 王海燕,张佳程.食品降血压肽的比较与评价方法[J].食品与发酵工业,2001,27(10):67-68.
[21] 赵骏,宫霞,郭本恒.乳酪蛋白源ACE抑制肽的分离纯化[J].中国乳品工业,2006,34(6):8-11.
[22] 薛向阳,孔繁东,祖国仁,等.食品抗高血压肽的研究进展和前景分析[J].食品研究与开发,2004,25(6):28-32.
[23] 沈小琴,李朝慧,罗康永.乳清蛋白酶解ACE抑制肽分离纯化技术的研究明[J].中国乳品工业,2005(11):4-6.
[24] 何海伦,陈秀兰,孙彩云,等.血管紧张素转化酶抑制肽的研究进展[J].中国生物工程杂志,2004,25(24):7-l1.
[25] 戴军,陈尚卫,谢广发,等.绍兴黄酒中ACE活性抑制肽的分离分析[J].分析测试学报,2006,25(4):74-77.
