镜泊湖沉积物中有机磷的矿化特性研究
2011-04-10李英军熊善高魏自民
李英军,熊善高,魏自民*,张 斌,白 雪
(1.北京农业职业学院,北京 100012;2.东北农业大学生命科学学院,哈尔滨 150030)
在适宜的环境下,磷的释放主要取决于无机磷的解吸和有机磷的矿化。微生物对有机磷的矿化降解是沉积物向上覆水体中释放磷的一种重要方式。国外有许多研究聚焦于有机磷如何转化为无机态的正磷酸盐[1-2]。碱性磷酸酶是一种胞外酶,能催化有机磷的水解反应,使有机磷转化为无机磷,提高磷的生物可利用性。它是一种专一性较广的磷酸水解酶,可以催化所有的磷酸酯的水解反应和磷酸基团的转移反应,在生物体内具有非常重要的生理功能。它直接参与磷代谢,并与DNA、RNA、蛋白质、脂质等代谢有关,它对磷酸钙的沉积具有重要意义[3]。其主要是来源于细菌、浮游植物、浮游动物[4-5]。Klotz发现一类可为碱性磷酸酶水解的有机磷能被溪流沉积物吸附或释放。印度某海岸和港湾沉积物中磷酸酶的活性在夏季月出现高峰,这种现象与有机碎屑的大量沉积和矿化过程之间有某种联系[6]。威尼斯泻湖沉积物中碱性磷酸酶的活性正比于磷的释放速率,且由间隙水中溶解活性磷的浓度调节[7]。可见,微生物主要是通过分泌磷酸酶的方式,催化磷酸酯类有机化合物水解产生正磷酸盐,完成对有机磷的矿化。
镜泊湖为一河道型火山堰塞湖,位于中国黑龙江省牡丹江市境内。该湖南北长41 km,平均宽2.33 km,湖面面积91.15 km2,最高水位可达海拔353.5 m,北部吊水楼,由于断裂影响形成落差达12 m的瀑布,流出湖区入牡丹江[8]。湖区内以林业为主,农业、工业次之,渔业、旅游业近年有所发展。镜泊湖主要功能为水源地,兼有旅游、养殖、发电、水运、调节水量多种功能。
影响沉积物中磷释放的因素有很多,如pH、温度、容氧等,对此国内已进行了大量的研究。而微生物对沉积物中有机磷的矿化,特别是以东北地区湖库沉积物为研究对象的研究则很少。本文通过室内模拟实验,初步探讨微生物对沉积物中有机磷矿化的过程,旨在进一步认识微生物在有机磷矿化中的作用,为预防湖泊富营养化提供理论依据。
1 材料与方法
1.1 实验方案
2010年10月用彼得逊泥样采集器采集了镜泊湖HJ6号样点(见图1)的表层沉积物,剔除植物和贝类等残体,用聚乙烯保鲜袋运回实验室,并相应采集了上覆水。将采集的鲜泥分别置于两组3.3 L的塑料桶中,同时加入适应的上覆水,并保持泥水比为1∶4,其中一组塑料桶中向上覆水加入氯仿灭菌,氯仿浓度为0.5%。两组桶四周用黑色的塑料袋包裹,并置于遮光处,防止藻类的生长。每隔3 d取水样和底泥鲜样分析上覆水中总磷、溶解态总磷、溶解性磷酸盐及沉积物中碱性磷酸酶、有机质和有机磷的含量,实验周期为30 d。

图1 镜泊湖采样点示意Fig.1 Map showing sampling sites of Jingbo Lake
1.2 实验方法
水体中pH用pH电极测定,总磷、溶解性总磷、溶解性磷酸盐采用钼锑抗比色法测定[9]。沉积物中有机磷(Org-P)采用酸碱浸提法[10],沉积物中碱性磷酸酶的测定参照土壤分析方法[10]。

图2 水体中pH的变化Fig.2 Variation of pH in water
2 结果与分析
2.1 pH变化
湖水pH是湖泊及流域各种自然地理因素综合作用的结果,pH被认为是底泥与上覆水磷交换的重要因素。在对太湖沉积物磷释放影响的实验研究中发现,沉积物磷释放量随pH升高呈“U”形曲线,即在中性条件下磷的释放量最小,偏酸或偏碱都能促进磷的释放[11]。当pH升高时,由于氢氧根与非晶体磷和铝、铁结合态磷交换作用加强,发生竞争性吸附,容易发生离子交换,并从络合态中解吸出来[12]。当pH降低时,钙、铁结合态磷由于底质有机物降解产生CO2使其溶解度增加,导致磷的释放量增大[13]。矿化实验中水体pH的变化情况如图2所示,未灭菌处理,在0~15 d内pH逐渐下降,而在18 d时,其值上升,随后又逐渐下降。对于灭菌处理,pH随时间都表现为降低,从图可知,无论是未灭菌处理还是灭菌处理,水体中pH都随着时间而逐渐下降,其中经过灭菌处理比未灭菌处理下降幅度更大。其值降低的原因可能是由于微生物在矿化过程中,分泌一些小分子的有机酸类物质,从而引起水体pH下降,而对灭菌处理来说,菌体的自溶而产生大量的的有机残体,这些有机物质降解过程中也会产生有机酸。
2.2 上覆水中各形态磷的变化
由图3所示,对于未灭菌处理,水体中TP的值在0~9 d内有上升的趋势,在12 d时稍有下降,随后又逐渐上升,在30 d时上升到最大值。而对于经过灭菌处理,TP的浓度总体表现为先上升后下降的趋势。生物作用对沉积物中磷的影响主要表现在无机磷的溶解和有机磷的矿化两个方面上。经过对比可得出,微生物的活动对沉积物中磷的矿化和溶解有着重要的影响,未灭菌处理比灭菌处理中TP浓度更高,上覆水中TDP和DRP含量0~15 d呈现一定差异性,而在15~30 d内,其含量均逐渐降低。未灭菌处理,TDP和DRP的浓度0~15 d内逐渐上升的趋势,表明微生物对沉积物中磷的影响逐渐加强,通过矿化和溶解形成的磷酸盐逐渐释放的水体中,而灭菌处理中,在0~15 d内表现出先下降后上升的趋势,其原因可能为微生物前期大量的死亡,产生生物残体等有机物质,和水中的磷酸盐产生吸附沉淀作用,从导致水体中磷酸盐浓度降低,随后在pH逐渐下降的情况下,会导致一部分无机难溶性磷的溶解而释放出磷酸盐。15 d后,两种处理水体中TDP和DRP浓度都降低,而TP未出现此种情况,其原因应该是随着实验的后期,矿化培养液逐渐减少,取样过程中沉积物易悬浮,导致大部分磷以颗粒吸附态的形式存在,溶解性磷酸盐的含量则逐渐减少。
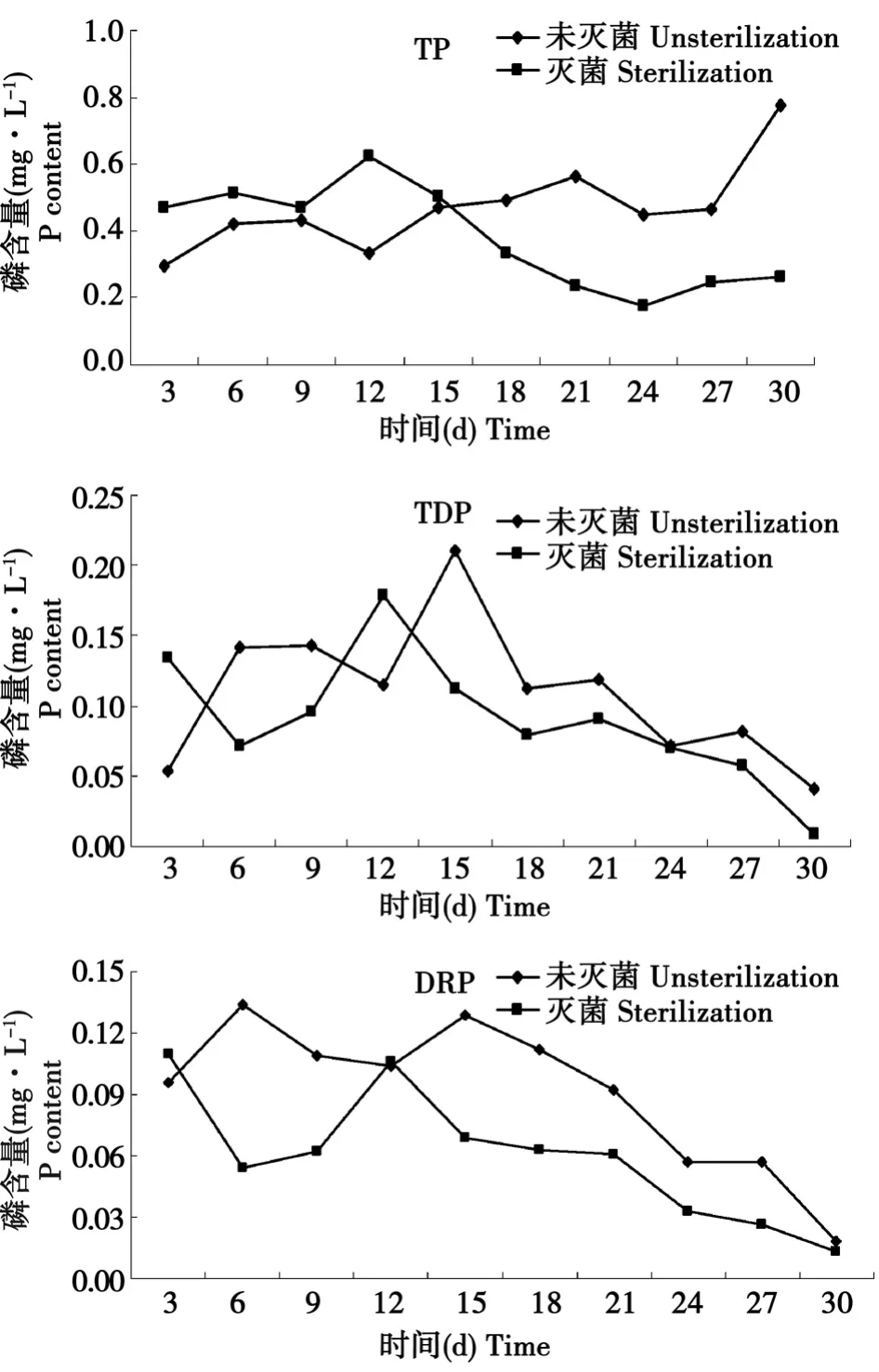
图3 上覆水中各形态磷的变化Fig.3 Variations of the concentrations of phosphorus in the overlying waters
2.3 碱性磷酸酶活性变化
一般认为,碱性磷酸酶与有机磷的矿化作用关系更为密切,二者之间呈正相关关系。作为胞外酶,碱性磷酸酶大量存在于沉积物中,可以催化核苷、含糖磷酸酯和不饱和肌醇磷酸酯等较简单的含磷有机物尽快的水解脱磷酸。由图4所示,未灭菌和灭菌处理随时间其变化趋势基本一致,呈现波浪形的波动,二者只表现在含量大小的不同。其原因为对于未灭菌的处理,微生物由于前期自身的生长会消耗营养物质,随着资源的耗竭,微生物生长受到影响,菌体破碎死亡,分泌碱性磷酸酶活性逐渐降低,到9 d时,微生物利用生物残体大量繁殖,故分泌磷酸酶逐渐增多。有研究表明,碱性磷酸酶的合成有赖于环境中磷的营养状态,当磷酸盐浓度>0.20 mg·L-1时,碱性磷酸酶的活性则会显著地减少[14]。由图可知,在15 d时,上覆水中磷酸盐浓度已达到最大值,对磷酸酶的合成会产生一定抑制作用,15~21 d,碱性磷酸酶活性逐渐减低,随着水体中溶解性磷酸盐含量逐渐的降低,其碱性磷酸酶活性表现在21~30 d内又显著增强。对于灭菌处理来说,前期灭菌作用,导致微生物大量死亡,而沉积物中少量的耐性菌体存活下来,表现在0~9 d内分泌碱性磷酸酶活性逐渐减少,在中期,耐性菌由于逐渐适应并大量繁殖,分泌磷酸酶的含量也逐渐增多,到后期,由于碱性磷酸酶合成受其他组分磷的影响,而表现出先下降后上升的趋势。

图4 沉积物中碱性磷酸酶活性的变化Fig.4 Variation of alkaline phosphatase in sediment
2.4 沉积物中有机磷的变化
微生物对有机磷的影响,主要表现在一定的磷环境条件下,通过分泌胞外酶,分解有机磷,从而维持自身生长所需的能源和营养源。矿化实验结果见图5,结果表明,对于未灭菌处理,沉积物中有机磷的含量表现出一定的起伏,在矿化前期,其含量逐渐减少,主要原因是微生物对有机磷的矿化作用,使沉积物中的有机态磷转化成无机态磷酸盐,使有机磷的含量变小。在15 d时,含量逐渐上升,其原因很可能是由于微生物的作用明显加强,从而对有机磷产生固定作用,即沉积物中存在大量能够在体内积累多聚磷酸盐的微生物,这些微生物对水体中可溶性磷酸盐进行吸收转化,以有机磷的形式存储在体内,从而使微生物量磷也成为有机磷的一部分,增大有机磷在总磷中的含量。在实验后期,其含量表现为“潮汐式”的回升和降落,微生物的活动是其主要原因。对于灭菌处理,有机磷的含量在前期略有上升,其原因为在前期,由于灭菌的处理使生物残体大量富集在沉积物中。在中后期,随着时间的推移,有机磷有少量被矿化。相关分析表明两种处理均与时间负相关,其中灭菌处理相关性较显著(P<0.05)。

图5 沉积物中有机磷的变化Fig.5 Variation of organic phosphorus in sediment
3 讨 论
在沉积物中,微生物的作用以细菌为主。细菌对沉积物中磷的释放的影响包括直接和间接的两个方面[15-16]。而有机磷作为直接分级的化合物,在微生物影响下,其变化最为明显。
沉积物中微生物对有机磷的矿化是以微生物为中介来实现的:微生物利用含磷有机物中的碳以获取能量,而磷则以代谢产物的形式释放出来,这种矿化途径称为生物矿化。许多微生物都能分泌出磷酸酶,在它的酶促作用下,有机磷化合物被水解,释放出磷酸盐。当水体中缺乏正磷酸盐时,可在藻类及细菌体中诱导产生,催化有机磷的分解,释放正磷酸盐。这种转化是生物可利用磷的重要补充途径,尤其在以微生物为主体的湖泊沉积物生态系统中具有重要作用。分析表明,未灭菌和灭菌处理有机磷含量逐渐减少,但前者比后者减少的程度更大。未灭菌处理比灭菌处理碱性磷酸酶的含量要高些。
碱性磷酸酶与生物活性、磷浓度自己有着独特的响应机制。与磷营养水平之间呈明显的负相关关系[17-18]。其活性通常仅出现在极低的磷酸盐条件下[19],而水体中磷含量高于某一浓度时,其活性则被抑制。碱性磷酸酶与水体中磷含量之间存在一定的“抑制-诱导”关系[20]。实验结果也验证了此观点。不同水生生态系统中,其阈值不同[14]。这说明了碱性磷酸酶与磷营养水平之间的响应复杂,要想彻底的弄清二者相互影响的机制,还有待进一步的研究,例如利用DGGE技术从微观方面分析微生物分子结构特征与酶类的互相关系。
4 结论
a.对未灭菌处理中TP的浓度,比灭菌处理中TP浓度要高,说明微生物促进了沉积物中磷向水体的释放,而两种处理TDP和DRP的含量在实验后期都降低,表明实验后期沉积物中释放的磷主要以颗粒态的形式存在于水体中。
b.两种处理中碱性磷酸酶的变化趋势基本一致,但未灭菌处理中碱性磷酸酶活性明显增强,同时表现出与外界磷浓度的响应关系。
c.矿化过程中,两种处理有机磷含量都表现出下降的趋势,与灭菌处理比较,未灭菌处理有机态磷矿化进程明显加快。
[1] Cotner J H,Heath R T.Potential phosphate release from phosphomonoesters by acid phosphatase in a bog lake[J].Arch Hy-drobil,1988,111:329-338.
[2] Klotz R L,Cycling of phosphatase hydrolyzable phosphorus in streams[J].Can J Fish Aquat Sci,1991,48:1460-1467.
[3]何振立.土壤微生物量及其在养分循环和环境评价中的意义[J].土壤,1997(2):61-67.
[4] 桑青,魏西莲,张志南.水体及沉积物中碱性磷酸酶的研究进展[J].聊城大学学报,2003,16(4):33~36.
[5] Raheb J,Naghdi S,Flint K P.Alkaline phosphatase activity of Flexibacter chinensis under starvation stress in water microcosms[J].Enzyme Microb Technol,2006,40:132.
[6] EenkanteswarnK,Natarajan R.Distribution of free phosphatase in sediments of Porto Novo.[J].Indian J Mar Sic,1983,14:231-232.
[7] Gegobbis D,Homme Maslaowska E,OrioA A,et al.The role of alkaline phosphatase in the sediments of Venjice Laggon on nurtient regeneration[J].Estuar Coast Shelf Sci,I986,22:425-437.
[8] 崔晓丹,左彦东,郎贵林.镜泊湖水质现状的调查及防治对策的研究[J].黑龙江环境通报,2005,29(2):75-76.
[9] 国家环境保护总局.水和废水监测分析方法[M].4版,北京:中国环境科学出版社,2002:244-248.
[10] 鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,2000:168-181.
[11] 刘玉生,邹兰,郑丙辉,等.光照、温度和藻类对底泥释放磷的影响[J].环境科学研究,1992,5(2):41-44.
[12] Paul C M Boers.The influence of pH on phosphate release from lake sediments[J].Wat Res,1991,25(3):309-311.
[13] 吴文卫,陈建中,潘波,等.城市浅水湖泊沉积物与上覆水之间磷的行为研究[J].江西农业学报,2007,19(6):118-120.
[14] 高光,高锡芸,秦伯强.太湖水体中碱性磷酸酶的作用阐值[J].湖泊科学,2000,12:353~358.
[15] Zohary T,robarts R D.Experimental study of microbial P limitation in the eastern mediterranean[J].Limnology and Oceangraphy,1998,43(3):387-395.
[16] 叶琳琳,朱燕,徐圣友.微生物对巢湖沉积物生物可利用磷的稳定性影响[J].资源环境与工程,2007,21(3):341-342.
[17]许云台.西湖沉积物中微生物对有机磷循环影响研究[D].杭州:浙江大学,2005.
[18] 路娜,胡维平,邓建才,等.太湖水体中碱性磷酸酶的空间分布及生态意义[J].环境科学,2009,30(10):2899-2902.
[19] Jansson M,Olsson H,Pettersson K,Phosphatases:origin,characteristic and function in lakes[J].Hydrobioligia,1988,170:157-175.
[20] 高光,朱广伟,秦伯强,等.太湖水体中碱性磷酸酶的活性及磷的矿化速率[J].中国科学D辑:地球科学,2005,35:157-165.
