HPLC-UV法测定微生物降解体系中3-苯氧基苯甲酸含量
2011-04-06刘书亮袁怀瑜
赵 楠,刘书亮,赖 文,袁怀瑜
(四川农业大学食品学院,四川 雅安 625014)
HPLC-UV法测定微生物降解体系中3-苯氧基苯甲酸含量
赵 楠,刘书亮*,赖 文,袁怀瑜
(四川农业大学食品学院,四川 雅安 625014)
采用高效液相色谱-紫外(high-performance liquid chromatography with ultraviolet,HPLC-UV)法测定微生物降解体系中3-苯氧基苯甲酸(3-PBA)的含量。以Gemini 100A C18柱(150mm×4.60mm,5.0μm)为色谱柱,乙腈-水(70∶30,V/V)为流动相,流速0.7mL/min,用紫外检测器在210nm处检测3-PBA。结果显示:3-PBA对照品的保留时间为4.268min,线性范围为0.5~50.0mg/L,3-PBA平均回收率为98.919%,RSD为2.78%;运用该方法测得4种不同来源的混合菌株发酵液中3-PBA的残留量分别为24.467、86.266、2.633、1.921mg/L。本法简单、快速、准确、分离度好。
高效液相色谱-紫外(HPLC-UV法);3-苯氧基苯甲酸(3-PBA);微生物降解体系;检测
3-苯氧基苯甲酸(3-PBA)是大多数拟除虫菊酯类农药的主要降解产物之一,易在环境中迁移,半衰期长达180d[1],且具有一定生殖毒性[2-4],与拟除虫菊酯类农药相比,该物质在环境中的危险性相对较大[1]。随着拟除虫菊酯类农药的大量使用,其降解产物3-PBA在造成农产品二次污染的同时[5],也导致拟除虫菊酯类农药生物矿化作用受阻,从而切断该类农药彻底转化为无毒小分子的生物降解途径[6],间接地使农产品农残问题更加严峻化。因此为了彻底降解拟除虫菊酯类农药,避免其降解产物再造成二次污染,3-PBA的降解逐渐成为研究的热点。
微生物降解法不失为消除有害化合物污染的佳选方法之一[7-8]。在微生物降解3-PBA的研究中,简单、快速、准确的检测方法是能够获得理想菌株并进一步研究菌株降解特性的基础,然而针对微生物降解体系中3-PBA检测的方法研究未见报道。现今对于3-PBA检测方法的研究主要集中于人与动物血液及尿液方面[9-11],并以气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)[12-14]法、液相色谱-质谱(liquid chromatographymass spectrometry,LC-MS)[15-16]法为主,虽然这些方法灵敏度高、检测结果准确,但对于微生物降解体系中3-PBA含量较高、成分简单的基质而言,采用这些方法检测,会导致其前处理过程相对复杂、耗时,分析成本也相对较高。高效液色谱-紫外(high-performance liquid chromatography with ultraviolet,HPLC-UV)法由于操作简单、准确可靠、重复性好,广泛应用于定性、定量检测。Ding等[11]和谢文军等[17]分别以HPLC-UV法检测小鼠血液和土壤中的3-PBA残留量,该法灵敏、准确,且样品前处理方法简单,分析成本相对较低,但以上方法并非针对微生物降解体系建立,因此其前处理步骤还是相对较复杂、分析时间相对较长。本实验旨在针对微生物降解体系,建立一种简单、快速、准确的HPLC-UV法检测微生物降解体系中的3-PBA残留量,为筛选3-PBA降解菌及其进一步研究提供方法参考。
1 材料与方法
1.1 培养基、试剂和菌种
无机盐培养基(MM)[18-19]:硫酸铵1.5g,磷酸二氢钾0.5g,磷酸氢二钾1.5g,七水硫酸镁 0.2g,氯化钠0.5g,去离子水1000mL,pH7.5,121℃灭菌15min。
3-PBA(纯度98%) 美国Sigma公司;检测用乙腈(色谱纯) 德国CNW Technologies GmbH公司;提取用乙腈(分析纯) 天津科密欧化学试剂有限公司;其他试剂均为分析纯。
从不同农药厂采集土壤或污水样品(表1),在含有150mg/L 3-PBA的MM培养基中驯化后,待进一步测定确定其3-PBA降解率后进行分离、筛选的混合菌株发酵液。

表1 样品采集地Table 1 Information about 4 different microbial degradation systems
1.2 仪器与设备
LC-10A2010C HT型液相色谱系统[配有可变波长紫外检测器(UV)和LC-solution1.1色谱工作站] 日本岛津公司;UV-3200(PC)紫外-可见分光光度计 上海美谱达仪器有限公司;AS10200A超声波清洗器 天津奥特赛恩斯公司;BT 124S型电子天平 德国塞多利斯公司;BR4i 型冷冻离心机 美国热电公司;Mill-Q 超纯水仪德国密理博公司。
1.3 方法
1.3.1 色谱条件
色谱柱:Gemini 100A C18柱(150mm×4.60mm,5.0μm);流动相:以乙腈和水作流动相,用磷酸将水pH值调为2.5,比较不同乙腈比例组成(40%、45%、50%、55%、60%、65%、70%、75%、80%)的流动相、不同流速(0.6、0.7、0.8mL/min)对3-PBA测定的影响;检测波长:210nm;柱温:25℃;进样量:5μL。
1.3.2 标准溶液的配制
准确称取0.01g 3-PBA标准品,用乙腈定容于10mL棕色容量瓶中,得质量浓度为1000mg/L的对照品储备液,再精确吸取1mL标准储备液,定容至10mL,得质量浓度为100mg/L的对照品储备液(4℃贮存)。
1.3.3 样品处理
取经过反复驯化后的混合菌株发酵液1mL接种于30mL含有100mg/L 3-PBA的MM培养基中。30℃、120r/min 培养5d,然后取1mL菌液用2mol/L的盐酸酸化到pH2,用乙腈定容至10mL。取4mL定容后的样品13000r/min离心10min,将上清液用0.45μm的有机相滤膜过滤,弃去初滤液,取续滤液供液相色谱分析用。
2 结果与分析
2.1 检测波长的确定
以流动相将3-PBA的对照品溶解,制成质量浓度约10mg/L的溶液,在200~400nm的波长范围进行紫外光全波长扫描(图1)。从图1可看出,3-PBA的最大吸收波长为208.9nm,故选择210nm作为检测波长。

图1 3-PBA对照品吸收光谱Fig.1 UV scanning spectrum of 3-PBA standard
2.2 流动相的确定
以40%~80%的不同乙腈比例组成,每次增加5%乙腈的方式探讨了流动相对3-PBA分析的影响。实验发现随着乙腈比例的增加,3-PBA出峰时间相应提前,信号强度增高,但与培养基中的非目标峰分离变差。当乙腈与水比例为70∶30时,拖尾因子最小其峰形最佳,与非目标峰分离较好,并且当乙腈与水比例为70∶30时,增加乙腈在流动相中的比例,信号强度、保留时间的增加和提前相对变缓,因此最终确定乙腈与水组成比例为70∶30(V/V)为最终的流动相组成。同时,对不同流速(0.60、0.70、0.80mL/min)条件下的分离情况进行考察。随着流速的提高,出峰时间提前,柱压上升,但其与非目标峰的分离也相应变差。当流速在0.7mL/min时,3-PBA保留时间较0.6mL/min明显缩短;而与0.8mL/min相比,其与非目标峰的分离较好,保留时间略长。综合以上各方因素,最终选择流动相流速为0.7mL/min。在该色谱条件下3-PBA标准品保留时间为4.249min,峰形良好,无拖尾(图2A);而在样品中目标物质保留时间为4.268min,峰形良好,与非目标物质的分离也很好(图2B)。整个样品检测可在5min内完成,提高了检测效率。
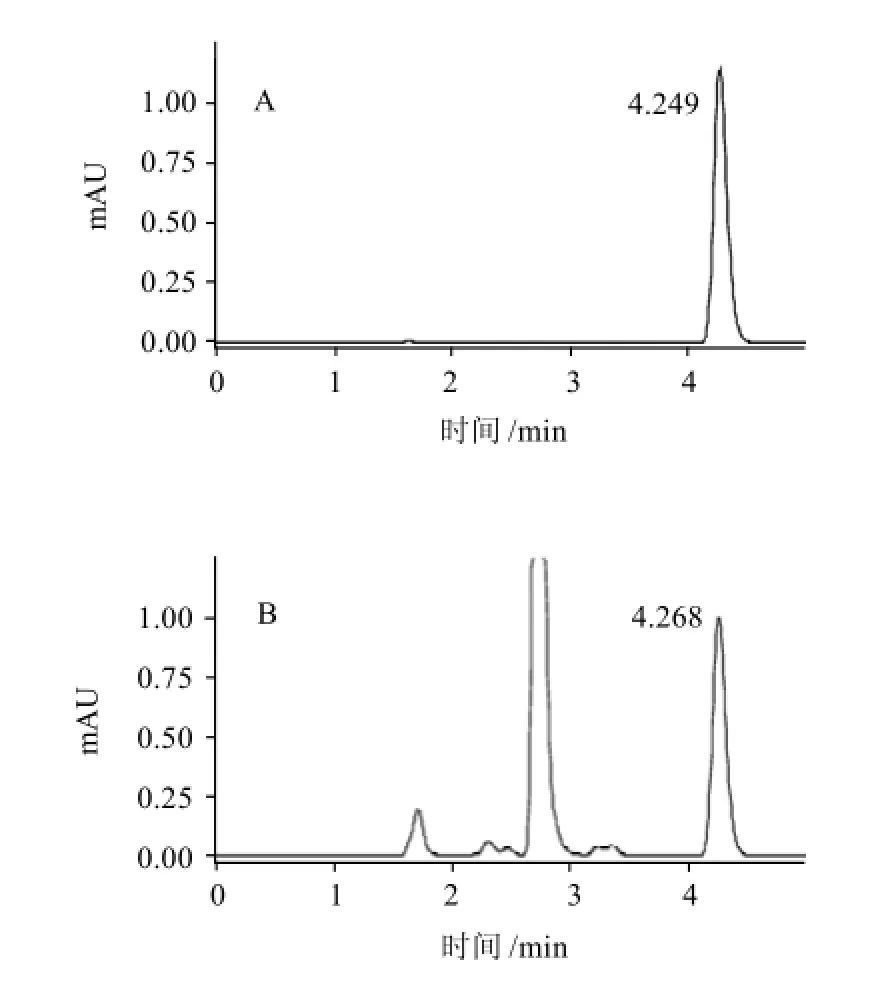
图2 3-PBA对照品(A)和3-PBA样品(B)溶液色谱图Fig.2 Chromatogram of 3-PBA standard and sample
2.33 -PBA标准曲线
分别吸取100mg/L 3-PBA 标准储备液5.0、4.0、3.0、2.5、2.0、1.5、1.0、0.5、0.2、0.1、0.05mL以乙腈-水(70∶30,V/V)定容至10mL,配制得质量浓度分别为50.0、40.0、30.0、25 .0、20.0、15.0、10.0、5.0、2.0、1.0、0.50mg/L的系列标准曲线工作液。按1.3.1节色谱条件测定,以质量浓度X/(mg/L)为横坐标、峰面积(Y)为纵坐标进行线性回归。结果表明,3-PBA进样量在0.50~50.0mg/L范围内线性关系良好,得回归方程为Y=104372X+5427,相关系数R2=0.9991。
2.4 精密度实验
在以上确定的色谱条件下,对同一3-PBA对照品溶液连续进样5次,进行HPLC分析。测得吸收峰面积分别为527812、526469、542823、531724和540123,相对标准偏差(RSD)为1.37%,表明实验精密度高。
2.5 重复性实验
取同一样品,按1.3.3节样品处理方法,分别提取制备5份样品液,HPLC 测定3-PBA含量考察方法重现性,结果见表2。从表2可以看出,发酵液中3-PBA的平均质量浓度为24.470mg/L,RSD为0.63%,表明样品前处理步骤简单,重复性好,符合分析要求。

表2 重复性实验测定结果Table 2 Results of reproducibility test
2.6 回收率实验
在已知质量浓度的3-PBA发酵液中分别加入一定量的3-PBA对照溶液进行回收率实验,具体加标水平及结果见表3。分别按1.3.3节样品处理方法定容至10mL制备成3份样品溶液,精密吸取10μL 进样测定3-PBA峰面积。由表3可见,3-PBA平均回收率为98.919%,RSD为2.78%。

表3 回收率实验测定结果Table 3 Results of spike recovery test
2.7 样品测定
按上述方法和色谱条件对4种不同来源的混合菌株发酵液中的3-PBA残留量进行测定(每个样品抽取3 瓶),结果如表4所示。所有样品中3-PBA的质量浓度均较发酵液中的3-PBA原始添加质量浓度(100mg/L)均有不同程度的减少,4种发酵液中残留的3-PBA分别24.467、86.266、2.633、1.921mg/L,这为4种不同来源混合菌株发酵液中微生物的分离、纯化和进一步研究提供参考依据。

表4 4种发酵液中3-PBA残留情况Table 4 3-PBA residues in different microbial degradation systems
3 结 论
本实验以3-PBA混合菌发酵液为研究对象,探讨了在筛选3-PBA降解菌和3-PBA降解菌特性研究工作中,利用HPLC-UV法检测微生物降解体系中3-PBA的残留量。该方法操作简单、分析快速、且结果准确,所选流动相能将微生物降解体系中残留的3-PBA和其他非目标物质进行有效分离,测定微生物降解体系中3-PBA的分析时间只需5min,分析时间短,降低了分析的成本,为高效筛选和研究3-PBA降解菌提供了方法保障。实验还发现在4种不同来源混合菌发酵液中添加的3-PBA均有减少,具有进一步分离研究的价值。
[1]TOPP E, AKHTAR M H. Mineralization of 3-phenoxybenzoate by a two-membered bacterial co-culture[J]. Can J Microbiol, 1990, 36(7)∶495-499.
[2]SUN Hong, XU Xiaolin, XU Lichun, et al. Antiandrogenic activity of pyrethroid pesticides and their metabolite in reporter gene assay[J]. Chemosphere, 2007, 66(3)∶ 474-479.
[3]JIN Meiqing, LI Ling, XU Chao, et al. Estrogenic activities of two synthetic pyrethroids and their metabolites[J]. J Environ Sci, 2010, 22 (2)∶ 290-296.
[4]HAN Yan, XIA Yankai, HAN Jiayuan, et al. The relationship of 3-PBA pyrethroids metabolite and male reproductive hormones among nonoccupational exposure males[J]. J Chromatogr B, 2008, 72(5)∶ 785-790.
[5]MARTINEZ V J. Determination of pesticide transformation products∶ a review of extraction and detection methods[J]. J Chromatogr A, 2009, 1216(40)∶ 6767-88.
[6]WHITE G F, RUSSELL N J, TISWELL E C, et al. Bacterial scission of ether bonds[J]. Microbiol Rev, 1996, 60(1)∶ 216-232.
[7]王兆守, 李顺鹏. 拟除虫菊酯类农药微生物降解研究进展[J]. 土壤, 2005, 37(6)∶ 577-580.
[8]李顺鹏, 刘君寒, 王兆守. 拟除虫菊酯类农药降解菌改良农作物品质的应用∶ 中国, 200710022920.3[P]. 2007-10-24.
[9]APREA C, STRIDORI A, SCIARRA G, et al. Analytical method for the determination of urinary 3-phenoxybenzoic acid in subjects occupationally exposed to pyrethroid insecticides[J]. J Chromatogr B, 1997, 695 (2)∶ 227-236.
[10]KIM H, AHN K C, MA S J, et al. Development of sensitive immunoassays for the detection of the glucuronide conjugate of 3-phenoxybenzyl alcohol, a putative human urinary biomarker for pyrethroid exposure[J]. J Agric Food Chem, 2007, 55(10)∶ 3750-3757.
[11]DING Y, WHITE C A, MURALIDHARA S, et al. Determination of deltamethrin and its metabolite 3-phenoxybenzoic acid in male rat plasma by high-performance liquid chromatography[J]. J Chromatogr B, 2004, 810(2)∶ 221-227.
[12]ANGERER J, RITTER A. Determination of metabolites of pyrethroids in human urine using solid-phase extraction and gas chromatographymass spectrometry[J]. J Chromatogr B∶ Biomed Sci Appl, 1997, 695(2)∶217-226.
[14]LENG G, GRIES W. Simultaneous determination of pyrethroid and pyrethrin metabolites in human urine by gas chromatography-high resolution mass spectrometry[J]. J Chromatogr B, 2005, 814(2)∶285-294.
[15]OLSSON A O, BAKER S E, NGUYEN J V, et al. Liquid chromatography-tandem mass spectrometry multiresidue method for quantification of specific metabolites of organophosphorus pesticides, synthetic pyrethroids, selected herbicides, and DEET in human urine[J]. Anal Chem, 2004, 76 (9)∶ 2453-2461.
[16]BAKER S E, OLSSON A O, BARR D B, et al. Isotope dilution highperformance liquid chromatography-tandem mass spectrometry method for quantifying urinary metabolites of synthetic pyrethroid insecticides [J]. Arch Environ Con Tox, 2004, 46(3)∶ 281-288.
[17]谢文军, 周健民, 王火焰. HPLC法测定土壤中3-苯氧基苯甲酸[J].农业环境科学学报, 2007, 26(2)∶ 608-611.
[18]蔡宝立, 朱昌寿. 阿特拉津降解菌株的分离和鉴定[J]. 微生物学通报, 2001, 28(2)∶ 22-26.
[19]许育新, 李晓慧, 秦华. 3-苯氧基苯甲酸降解菌的分离及降解特性研究[J]. 微生物学通报, 2005, 32(5)∶ 62-66.
Determination of 3-Phenoxybenzoic Acid in Microbial Degradation Systems by HPLC-UV Detection
ZHAO Nan,LIU Shu-liang*,LAI Wen,YUAN Huai-yu
(College of Food Science, Sichuan Agricultural University, Ya’an 625014, China)
A HPLC method with UV detection was proposed to determine the concentration of 3-phenoxybenzoic acid (3-PBA) in microbial degradation systems. The chromatographic separation was performed on a Gemini 100A C18 column (5.0μm, 150 mm × 4.60 mm, i.d.) using a mobile phase made up of acetonitrile and water (70∶30, V/V) at a flow rate of 0.7 mL/min, and 3-PBA was detected at 210 nm using a UV detector. The retention time of 3-PBA was 4.268 min. The linear range of the method was 0.5-50.0 mg/L. The average spike recovery for 3-PBA was 98.919%, with a relative standard deviation (RSD) of 2.78%. The residues of 3-PBA in 4 different microbial degradation systems were 24.467, 86.266, 2.633 mg/L and 1.921 mg/L, respectively. The developed method demonstrated the benefits of simplicity, rapidity, high accuracy and good separation.
HPLC-UV;3-phenoxybenzoic acid;microbial degradation system;determination
TS201.3
A
1002-6630(2011)14-0181-04
2010-09-25
国家自然科学基金面上项目(21072137)
赵楠(1986—),女,硕士研究生,研究方向为食品微生物与检测。E-mail:zhaonan19861115@yahoo.cn
*通信作者:刘书亮(1968—),男,副教授,硕士,研究方向为食品微生物与发酵工程。E-mail:lsliang999@163.com
